Цветные реакции на белки
Белки
Методические указания к лабораторному практикуму
по дисциплине ”Биохимия» для студентов специальностей
49 01 01 “Технология хранения и переработки растительного сырья”
49 01 02 “Технология хранения и переработки животного сырья”
91 0101 “Производство продуктов и организация общественного
питания”
Могилев 2003
УДК 557.1
Рассмотрены и утверждены
на заседании кафедры ХТВМС
Протокол № 10 от 20 мая 2003 г.
Составители: доц. О.Н.Макасеева
ст. препод. О.В.Дудинская
асс. Л.М.Ткаченко
Рецензент доц., к.т.н. Т.М.Тананайко
Редактор Т.Л. Бажанова
Технический редактор А.А.Щербакова
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾
Подписано в печать_____________ Формат 60х84 1/16
Печать офсетная. Усл. печ. л _________ Уч.-изд. л _________
Тираж _____ экз._______Заказ ______ Бесплатно
Лицензия № 226 от 12.02.2003г.
¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾
Отпечатано на ризографе МГУП
212027, г. Могилев, пр. Шмидта, 3
Ó Могилевский государственный университет продовольствия
Содержание
1 Общие указания к методике выполнения и защиты лабораторных работ. 4
2 Цветные реакции на белки. 4
2.1 Биуретовая реакция. 5
2.2 Нингидриновая реакция. 6
2.3 Ксантопротеиновая реакция. 7
2.4 Реакция Адамкевича. 8
2.5 Реакция Фоля. 9
3 Физико-химические свойства белков. 10
3.1 Определение изоэлектрической точки белков. 10
3.2 Высаливание белков сульфатом аммония. 11
3.3 Необратимое осаждение белков. 12
3.3.1 Осаждение белков органическими веществами. 12
3.3.2 Денатурация белков при нагревании. 13
3.3.3 Осаждение белков концентрированными минеральными кислотами. 14
3.3.4 Осаждение белков органическими кислотами. 14
3.3.5 Осаждение белков солями тяжелых металлов. 14
3.4 Разделение и очистка белков методом диализа. 15
4 Методы определения азота в биологических объектах. 17
4.1 Количественное определение общего азота по методу Къельдаля. 17
4.2 Определение различных форм азота в молоке и сыре. 21
4.2.1 Метод определения общего количества азота в сыре. 23
4.2.2 Метод определения общего количества растворимого азота. 24
4.2.3 Метод определения азотосодержащих небелковых соединений. 25
4.2.4 Метод определения аминного азота (пептиды, аминокислоты, амиды, аммиак) 25
4.3 Определение белка в молоке по Лоури. 26
5 Определение влажности весовым методом. 28
5.1 Метод высушивания до постоянной массы.. 28
5.2 Определение влажности ускоренным методом высушивания. 29
5.3 Определение влажности экспрессным методом высушивания. 29
6 Нуклеопротеиды.. 30
6.1 Гидролиз нуклепротеидов дрожжей. 31
Список используемых источников. 33
1 Общие указания к методике выполнения
и защиты лабораторных работ
Перед выполнением лабораторных работ студенты должны самостоятельно изучить теоретический материал соответствующих тем курса, используя рекомендуемую литературу, оформить первых два раздела отчета – «Теория» и «Методика». В разделе «Теория» приводятся основные положения, формулировка теорий и гипотез, уравнения химических реакций с написанием структурных формул, в разделе «Методика» – принципы и изложение метода.
К работе допускаются студенты, выполнившие эти требования и ознакомленные с оборудованием и приборами, знающие свойства используемых химических реагентов и образуемых продуктов реакции в ходе эксперимента.
Во время выполнения работы проводятся соответствующие наблюдения над объектами исследования. В лабораторном журнале отмечаются физические и физико-химические эффекты, сопровождающие химические взаимодействия, делаются расчеты, составляются таблицы и рисунки, формулируется результат, что определяет содержание третьего раздела отчета «Наблюдение и результаты». В последнем разделе студенты делают выводы на основании полученного результата и знания теории.
Записи выполняются четко и аккуратно, без сокращений, за исключением принятых, оставляются поля. До ухода с занятий отчет представляют на подпись преподавателю. Защита проводится в соответствии с графиком выполнения и защиты лабораторных работ.
Цветные реакции на белки
Присутствие белка в биологических объектах или растворах можно обнаружить с помощью цветных реакций, которые обусловлены наличием аминокислот в белке, их специфическими группами или пептидными группами.
Существуют универсальные цветные реакции, которые дают все белки (биуретовая и нингидриновая). Кроме того, имеются специфические реакции, которые обусловлены наличием определенных аминокислот в молекуле белка. На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот, которые широко используются в биохимических анализах.
В данной работе студент должен не только провести универсальные и специфические реакции на белки, но и сделать вывод о питательной ценности исследованных белков, которая определяется содержанием незаменимых аминокислот.
Незаменимых (обязательных) аминокислот для человека восемь: валин (Вал), лейцин (Лей), изолейцин (Иле), треонин (Тре) , метионин (Мет), лизин (Лиз) , фенилаланин (Фен),триптофан (Трп). Две аминокислоты являются частично незаменимыми – это аргинин и гистидин. Они не синтезируются в организме детей. Эти аминокислоты, как и все другие, синтезируют микроорганизмы и зеленые растения, но не могут синтезироваться в организме животного и человека, т.к. нет аналогов соответствующих кетокислот, необходимых для их биосинтеза. Незаменимые аминокислоты должны быть обязательно введены в организм человека или животного с пищей. Если их будет в пище недостаточно, то нормальное развитие и жизнедеятельность организма нарушаются, т.к. не могут синтезироваться белки, содержащие их.
Отдельные пищевые белки могут быть биологически неполноценными по своему аминокислотному составу. Однако необходимо исследовать аминокислотный состав не отдельных белков, а всего их комплекса, содержащегося в пищевом продукте. Только при таком подходе могут быть получены правильные данные об аминокислотном составе, а следовательно, и о пищевой ценности продукта. Для питания большое значение имеет сбалансированность аминокислотного состава белков.
По содержанию в белке незаменимых аминокислот, определяемых химическими методами, вычисляют аминокислотный скор, которым характеризуют биологическую ценность белка. В продукте определяют содержание каждой незаменимой аминокислоты. Найденное количество вычисляют в процентах к содержанию той же аминокислоты в идеальном белке (куриного яйца, молока). Чаще всего в качестве идеального белка применяют аминокислотную шкалу Комитета ФАО/ВОЗ (ФАО-Продовольственная и сельскохозяйственная организация ООН – межправительственная организация, специализированное учреждение ООН. ВОЗ- Всемирная организация здравоохранения).
Аминокислотный скор каждой незаменимой аминокислоты в идеальном белке (шкале ФАО/ВОЗ) принимают за 100%.
Расчет аминокислотного скора ведут по формуле
B
АK = ¾¾¾¾ × 100, (1)
C
где АK – аминокислота;
В - содержание (мг) незаменимой аминокислоты в 1 г исследуемого белка;
С – содержание (мг) этой же незаменимой кислоты в 1 г идеального белка (шкале ФАО/ВОЗ).
По вычисленному скору определяют лимитирующую биологическую ценность изучаемого белка. Аминокислота с наименьшим скором является дефицитной в данном белке. Для растительного белка чаще всего дефицитным является лизин, триптофан, метионин и треонин. Белки животного происхождения – мяса, молока, яиц – биологически более ценные, т.к. их аминокислотный состав ближе к аминокислотному составу органов и тканей.
Биуретовая реакция
Принцип метода. В щелочной среде в присутствии солей меди растворы белка приобретают фиолетовый цвет с красным или синим оттенком, зависящим от количества пептидных связей в молекуле. Продукты неполного гидролиза белка, содержащие не менее двух пептидных связей, дают биуретовую реакцию с красным оттенком. Реакция обусловлена наличием пептидных групп, которые в щелочной среде образуют с ионами двухвалентной меди окрашенные комплексы.
В щелочной среде пептидная группа присутствует в своей таутомерной енольной форме:
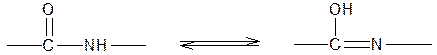
Ион меди взаимодействует с отрицательным зарядом диссоциированной в этих условиях ОН-группой – возникает солеобразная связь; кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их неподеленных электронных пар. Комплексное соединение меди с енолизованными пептидными группами при участии четырех атомов азота можно представить следующим образом:
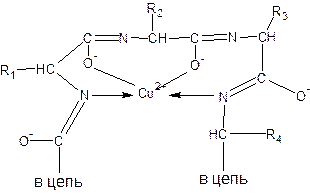
Ход работы.В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. В каждую пробирку добавляют по 10 капель 10%-ного раствора NаОН и по одной капле 1%-ного раствора сульфата меди. Содержимое пробирок тщательно перемешивают. Развивается фиолетовое окрашивание с соответствующим оттенком.
Нингидриновая реакция
Принцип метода. Белки, полипептиды, как и свободные a-аминокислоты, дают синее или фиолетовое окрашивание с нингидрином (гидрат трикетогидриндена). Реакция характерна для a-аминогрупп аминокислот.
На I стадии реакции образуется восстановленный нингидрин за счет окислительного дезаминирования (образование NН3) и декарбоксилирования (образование СО2) a-аминокислот: 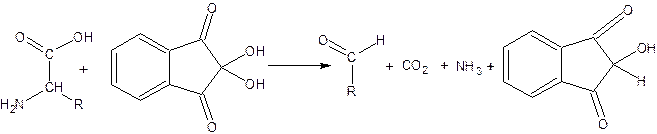
Окисленный Восстановленный
нингидрин нингидрин
На II стадии образовавшийся аммиак реагирует с эквимолярными количествами окисленного и восстановленного нингидрина, образуя сине-фиолетовый продукт, интенсивность окраски которого (при 570нм) пропорциональна количеству аминокислоты:
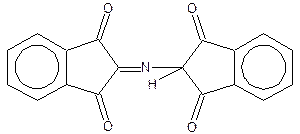
Ход работы.В одну пробирку наливают 5 капель разбавленного раствора яичного альбумина, во вторую – 5 капель 1%-ного раствора желатина, в третью – 5 капель 1%-ного раствора растительного альбумина. В каждую пробирку добавляют по 3 капли 0,5%-ного раствора нингидрина и нагревают до кипения. Через 2–3 минуты в пробирках появляется розовое, красное, а затем сине-фиолетовое окрашивание.
