Модели биофазы и Хилла, их использование для описания закономерностей взаимодействия веществ с активными центрами биологических мембран.
Для целей интерпретации рассматриваемых зависимостей исполь-зуется ряд подходов. Один из них - это описание на базе балансвых уравнений (так, как это принято в фармакологии и токсикологии). Вводится понятие «биофазы» - компартмента, содержащего рецепторы и находящегося в контакте со средой. В этом случае можно записать систему дифференциальных уравнений, характеризующих динамику перемещений эффектора в компартменты в соответствии со структурой его баланса, предполагаемой избранной моделью (рис. 4.5). В простейшем случае, рассмотренном Р.Е. Фурхготтом, биофаза находится в непосредственном контакте с компартментом, являющимся источником эффектора; выход эффектора из биофазы в прочие компартменты рассматривается как реакция первого порядка; стехиомет-рия связывания эффектора с активным центром в данном случае принимается равной 1:1.
В этом случае
d`с
 |  |
–––– = k1С(B – `с) – k1´`с – k2´`с(Q – Z) + k2´Z – k3 с
dt
dZ
–––– = k2 с (Q – Z) – k2´Z, (4.9)
dt
где `с – концентрация эффектора в биофазе; B – предельная емкость биофазы; ki, ki´ – константы скоростей реакций, смысл которых ясен из рис. 4.5.
Стационарная величина количества образовавшихся комплексов окажется равной
QСB/ (B+К1)
Z = ––––––––––––––––––––––, (4.10)
С + (K2 + К2/К1)( B+К1)
где К1 = k1´/k1 – коэффициент распределения эффектора между биофазой и средой, содержащей эффектор в концентрации С; К2 = k2´/k2 – константа диссоциации комплекса.
При очень малых концентрациях эффектора С и сравнительно небольших значениях К1 и К2 можно предположить Q > Z, B > C и система (4.9) упрощается:
d`с
–––– = k1СB – a`с – k2Q `с + k2´Z, (4.11)
dt
(4.11)
dZ
––– = k2 Q`с – k2Z,
dt
где a = k1С + k1´ + k3.
Процесс отмыва связанного эффектора после перенесения тестового объекта в контрольный раствор описывается уравнением
b2 b1
Z = Zо (———e-b1t – ———e-b2t), (4.12)
b2 – b1 b2 – b1
где b1 = [k2´ + a + k2Q –  ( k2´ + a + k2Q)2 + 4a k2´]/2,
( k2´ + a + k2Q)2 + 4a k2´]/2,
b1 = [k2´ + a + k2Q +  ( k2´ + a + k2Q)2 + 4a k2´]/2. (4.13)
( k2´ + a + k2Q)2 + 4a k2´]/2. (4.13)
Рассмотренные выше примеры предполагают связывание с одним рецептором одной молекулы лиганда. В принципе можно допустить существование комплексов лиганд-рецептор RAn с любыми стехио- метрическими коэффициентами. Могут, например, существовать многовалентные места (рецепторы), образующие комплексы RAn путем последовательного присоединения лигандов:
R +А = RA|,
RA| + А = RA2, (4.14)
RA„-i +А = RAn.
Если присоединение каждой последующей молекулы лиганда не зависит от количества ранее связанных с активным центром (рецептором) молекул, то данный процесс подчиняется уравнениям (4.4) и (4.5). В противном случае имеют место эффекты, обычно называемые кооперативными (например, связывание каждым рецептором двух молекул), причем кооперативность бывает отрицательной и положительной.Когда присоединение каждой последующей молекулы облегчается вследствие посадки предыдущей, то говорят о положительной коопе- ративности, если, наоборот, затрудняется, - имеем отрицательную кооперативность.Положительную кооперативность можно продемонстрировать на примере связывания кислорода молекулой гемоглобина, которая состоит из четырех субъединиц: двух а- и двух р-цепей. Каждая из субъединиц может связывать одну молекулу кислорода. Оказалось, что сродство к кислороду отдельного центра связывания (гема) тем выше, чем больше других центров связывания уже занято молекулами кислорода.Существует несколько характерных приемов установления признаков кооперативности. Препарат рецепторов, насыщенный радиоактивным лигандом, можно перенести в среду, не содержащую его, и измерить скорость диссоциации «меченых» комплексов. При этом часть препарата помещается в раствор, содержащий высокую концентрацию немеченого лиганда, часть - в раствор без лиганда. Если в первом случае скорость распада комплекса выше, это может свидетельствовать о наличии отрицательной кооперативности: нерадиоактивный лиганд, связываясь со свободными, незанятыми радиоактивными рецепторами, ослабляет меченые комплексы. И наоборот, если в присутствии нера диоактивного лиганда скорость диссоциации снижается, говорят о проявлении положительной кооперативности.
Но самый популярный среди исследователей способ выявления кооперативности - это анализ характера отличий концентрационной зависимости количества связывающегося лиганда от классического уравнения (4.5). Представляя полученные данные в скэтчардовских координатах (рис. 4.6), при вогнутой кривой говорят об отрицательной кооперативности, при выпуклой - о положительной.
Предельному случаю сильно выраженной положительной кооперативности (п>1) соответствует популярное уравнение Хилла. Здесь речь идет о механизме, допускающем лишь одновременное присоединение всех молекул эффектора к рецептору без образования промежуточных комплексов RA^ RA2... RAn:
Соотношение, описывающее образование комплексов, имеет вид:
QC n
Z (t) = –––––– [1 – e (-k’+kCn) t], (4.16)
K + C n
а диссоциация комплексов при отмыве:
Z(t) = Zoe-k’t . (4.17)
Следует отметить, что чем больше величина n, тем сильнее выражен S-образный характер кривой.
39.Пиноцитоз и фагоцитоз белки, полинуклеоти- ды, полисахариды, а также твердые частицы. Тем не менее в большинстве клеток указанные вещества проходят в обоих направлениях через плазматические мембраны. Механизмы, с помощью которых осуществляются эти процессы, сильно отличаются от механизмов, опосредующих транспорт небольших молекул и ионов. При переносе макромолекул или твердых частиц происходит инвагинация (впячивание или выпячивание) мембраны с последующим образованием пузырьков (везикул). Например, для того чтобы секретировать инсулин, клетки, индуцирующие этот гормон, упаковывают его во внутриклеточные пузырьки, которые сливаются с плазматической мембраной и отрываются во внеклеточное пространство, высвобождая при этом инсулин. Подобный процесс называется экзоцитозом. Клетки способны также поглощать макромолекулы и частицы и в обратном направлении. Этот процесс называется эндоцитозом (внутрь клетки).Тем не менее каждый пузырек сливается только со специфическими мембранными структурами, что гарантирует правильный перенос макромолекул и их распределение между внеклеточным пространством и внутренностью клеток. Одни секретируемые молекулы адсорбируются на поверхности клетки и становятся частью клеточной оболочки, другие включаются в межклеточный матрикс, а третьи попадают в интерстициальную жидкость и (или) в кровь, где они служат для других клеток в качестве питательных веществ или каких-то сигналов.Пиноцитоз подразделяется на несколько этапов:
1) адсорбция на мембране молекул вещества; 2) впячивание или выпячивание (инвагинация) мембраны, образование пиноцитозного пузырька и отрыв его от мембраны с затратой энергии АТФ; 3) миграция пузырька внутрь протопласта, органеллы или наружу; 4) растворение мембраны пузырька (при действии фермента) или просто ее разрыв.
Исходя из функционирования транспортных механизмов на мембранах, последние делят на четыре типа.
К первому типу относят мембраны, через которые транспорт ве-. ществ осуществляется путем простой диффузии, а скорость переноса прямо пропорциональна разности концентраций по обеим сторонам мембраны. Они препятствуют прохождению ионов и пропускают нейтральные молекулы. Через такие мембраны быстрее всего диффундируют молекулы веществ с высоким коэффициентом распределения в системе масло-вода, т. е. веществ, обладающих выраженными липо- фильными свойствами.
Мембраны второго типа характеризуются наличием в них специфического переносчика, обеспечивающего облегченную диффузию и способствуют всасыванию ряда веществ, плохо проникающих через мембраны первого типа из-за высокой степени ионизированности или высокой гидрофильности. Транспортируемая молекула в мембране обратимо соединяется с переносчиком. Иллюстрацией может служить транспорт глюкозы в эритроциты человека. Особый интерес представляет облегченная диффузия в клетку молекулы холина. Простая диффузия ионизированной гидрофильной молекулы холина невозможна, однако специфический переносчик быстро доставляет его в эритроциты и другие клетки.
Мембраны третьего типа (наиболее сложные из всех) способны при необходимости переносить вещества против градиента концентрации. Эта так называемая система активного транспорта требует затраты энергии, высокочувствительна к изменениям температуры.
Примерами а) транспорт Na+ и К+ в клетки млекопитающих, перенос Н+ и К+ в клетках растений и т. д.; б) всасывание и выведение различных ионизированных и неионизированных веществ почечными канальцами и в меньшей мере через мембраны эпителия желудочно- кишечного тракта; в) захват бактериями неорганических ионов, Сахаров и аминокислот; г) накопление ионов йода щитовидной железой;
Мембраны четвертого типа отличаются от первого типа наличием пор (каналов), диаметр которых можно оценить по размерам самых больших молекул, проникающих через них. Один из наиболее изученных примеров мембран четвертого типа представлен почечным клубочком в капсулах Боумана. Мембраны четвертого типа встречаются в основном в капиллярах млекопитающих и в паренхиме почек.
40. Пассивный транспортПри пассивной диффузии ксенобиотики проходят через мембрану в результате случайного молекулярного движения, и величина потока линейно зависит от концентрации и коэффициента проницаемости мембраны для данного вещества. «Сердцевина» мембраны представляет собой в основном гидрофобную область, поэтому неполярные вещества сравнительно легко проникают в клетки. Гидрофобные группы способствуют увеличению проникающей способности, полярные - ее уменьшению.Различие в проницаемости зависит от скорости диффузии через мембрану, причем уменьшение скорости диффузии для разветвленной углеводородной цепи обусловлено стерическими факторами. В качестве количественного параметра проникновения любого вещества в клетку вводится коэффициент проницаемости. В этом случае скорость переноса определяют с помощью закона Фика:
1 dS (Сн-Св)
-------------------------------- = -DKp------------ ,
A dt Ах
где D - коэффициент диффузии; А - площадь поверхности; С", Св - концентрация снаружи и внутри соответственно; Кр - коэффициент распределения, представляющий отношение концентрации растворенного вещества в мембране к концентрации вне мембраны; Ах - расстояние, преодолеваемое соединением при прохождении через мембрану.
Так как молекуле, возможно, приходится преодолевать путь Дх, не обязательно равный толщине мембраны, то этот путь трудно измерить непосредственно. Коэффициент распределения обычно определяют, используя в качестве липидной фазы оливковое масло, а не истинные липиды, что вводит некоторую неопределенность в величину К. Зависимость D от х также неизвестна ни для какой мембраны. Поэтому Р = DKp/Ax (коэффициент проницаемости) является единственной измеряемой величиной,dS/dt = РА(СН - С'),где размерность Р - длина в единицу времени (т. е. скорость), см/с.Чем выше липофильность вещества, тем выше коэффициент распределения.Отношение концентраций какого-либо вещества, состоящего из простых молекул, в двух находящихся в равновесии фазах имеет постоянное значение и называется константой распределения Кр:КР = С2/С„где С, - водная фаза, С2 - неводная фаза (масло, липид).Коэффициент распределения некоторого вещества зависит от способности его молекул к образованию водородных связей. Кроме того, для соединений с одинаковым коэффициентом распределения в системе липид-вода скорость диффузии через мембрану может значительно варьировать в зависимости от пространственной структуры молекул.
Пассивный перенос - это движение вещества по градиенту электрохимического потенциала без затраты энергии, т. е. движущей силой пассивного транспорта веществ служит градиент электрохимического потенциала. Электрохимический потенциал (р) характеризуется свободной энергией некоторого вещества j. Химический потенциал, так же как и другие виды потенциальной энергии, является относительной величиной, т. е. он определяется каким-то условным уровнем энергии (вводится константа аддитивности или стандартный член р*):мю = jij* + RTlnCj + ZjFT. В случае переноса через мембрану незаряженных частиц уравнение (5.4) упрощается и химический потенциал вещества можно выразить как функцию его концентрации:мю = мю* + RTlnCj.
Здесь мю - энергия на единицу количества вещества (Дж/моль); С} - концентрация вещества; Zj - заряд; Ч7 - электрический потенциал; R - газовая постоянная; Т - абсолютная температура.Фактор RT, на который умножается величина lnCj, необходим для перевода активности в единицы энергии на 1 моль.
Если рассмотреть систему в состоянии равновесия, когда электрохимический потенциал вещества одинаков по обеим сторонам мембраны, то:мюв= мюH. (5.6)
В этом случае нет градиента электрохимического потенциала и никакая движущая сила не действует на переносимый ксенобиотик; он проходит в результате беспорядочного теплового движения, но при этом два противоположно направленных потока сбалансированы. В этом случаеRTlnCj" + ZjFT" = RTlnCj® + ZjFFB, и соотношение для разности электрических потенциалов будет иметь вид:
RT CjH
фи =In.
ZjF CjB
Величину фи азывают потенциалом Нернста. Экспериментально измерив мембранный потенциал и концентрацию ионов по обе стороны мембраны, на основании выражения (5.8) можно предсказать направление пассивного переноса ксенобиотика.Проницаемость мембран для некоторых малых молекул оказывается более высокой, чем это можно было бы ожидать на основании данных об их растворимости в липидах. Предполагают, что эти молекулы проходят через особые участки мембраны, так называемые «поры» (каналы). Аналогично считают, что заряженные частицы (ионы) движутся через ионные каналы.Через ионные каналы осуществляется не только транспорт веществ, они также непосредственно участвуют в передаче сигнала возбудимым клеткам (генерация потенциала действия). Существуют хемовозбуди- мые (рецепторы ацетил холи на, у-АМК, глутамата, глицина и др.) и электровозбудимые (натриевые, калиевые, хлорные и др.) каналы.
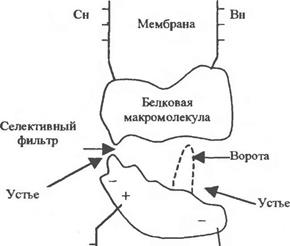 |
Канал - это две макромолекулы, образующие в мембране пору через бислои липидов. В поре имеется узкий селективный фильтр вблизи наружной поверхности мембраны и воротное устройство вблизи ее внутренней поверхности. Пространство между селективным фильтром и воротами получило название туннеля. Сенсор напряжения, расположенный в липидном слое, управляет открытием ворот под влиянием внутримембранного поля. Расширенные части канала у наружной и внутренней поверхности образуют устья (или вестибюли).
41. Масштабы химического загрязнения биосферы.Серьезные экологические проблемы, возникшие перед человече-ством и биологическими науками, в частности ксенобиологией, свя-заны с действием двух основных факторов: быстрым повышением народонаселения в мире (демографический взрыв): с I млрд человек в 1825 г. до 6,0 млрд в 2000 г. и ростом промышленного производства, приведшим к большому антропогенному прессу на природу. К основным причинам, усложнившим экологическую проблему, можно отнести следующие:- значительное увеличение объема промышленного производства, связанное с повышением производительности труда;-появление экологически опасных видов техники и технологии;- накопление на химпредприятиях больших запасов опасных токси-ческих веществ;- резкое повышение расходования природных ресурсов (нефть, газ, уголь, сланцы) с выбросом продуктов из хозяйственного использова-ния в биосферу;-повышение сложности технических систем, с которыми опериру-ет человек, приводящее к увеличению частоты промышленных аварий и катастроф.В настоящее время считают, что в биосфере находится более 6 млн индивидуальных химических соединений, не говоря уже об их комбинациях. Из всех веществ, имеющихся в биосфере, 90 % - синте-тического происхождения, которые в подавляющем большинстве яв-ляются для организма чужеродными.Выделяют следующие типы глобального химического загрязнения биосферы:загрязнение газообразными веществами;тяжелыми металлами;удобрениями и биогенными элементами;органическими соединениями;радиоактивными веществами (радионуклидами).
42.Неорганические ксенобиотики. Металлы. Двухфазность биореакции на действие тяжелых металлов. Факторы, способствующие хелатообразованию.
Живые организмы нуждаются в катионах металлов, обеспечиваю-щих протекание многих жизненно важных процессов. Более того, многие из этих металлов необходимы для всех форм жизни. К ним относятся: а) тяжелые металлы (кобальт, медь, железо, марганец, молибден, цинк и в меньших количествах хром, ванадий, никель и свинец); б) легкие металлы, обычно встречающиеся в большом количестве (кальций, магний, калий и натрий).Медь, железо, молибден, кобальт и иногда марганец принимают участие в окислительно-восстановительных процессах; действие цин-ка, магния и марганца связано с процессами гидролиза и переноса групп; кальций играет наиболее важную роль при создании гибких или жестких структур, а также может инициировать реакцию, вызывая по- видимому, структурные изменения (подобное действие иногда проявляет и магний), является вторичным мессенджером. Натрий и калий, благодаря их распространенности, служат переносчиками заряда; они очень слабо связываются и поэтому могут быстро обмениваться.Когда речь идет о тяжелых металлах, то многие из них необходимы в следовых количествах. Повышенные же их концентрации в организме вызывают токсические эффекты.Токсическое действие чужеродных металлов часто обусловлено антагонизмом катионов. Так, например, свинец - известный нейротоксин, вытесняет кальций из некоторых отделов нервной системы и тем самым препятствует выделению нейромедиаторов. В 1960 г. широко распространившееся загрязнение восточного побережья Японии кадмием в сочетании с низким уровнем поглощения кальция привело к развитию у людей мучительной болезни - одной из разновидностей остеомиелита. Выяснилось, что причина этого заболевания - антагонизм кадмия и кальция.С другой стороны, известны случаи синергического действия ме-таллов. Например, показано, что внесение отдельных металлов в кон-центрациях, соответствующих предельно-допустимым (Канада, США), в культуру водорослей хлорелла, сценедесмус и других не влияло на рост клеток, тогда как их смесь сильно подавляла рост, даже при более низких концентрациях. Число таких примеров достаточно велико.Относительно концентрационных эффектов металлов следует подчеркнуть, что реакция (р) организма на тяжелые металлы является двухфазной (рис 7.1).Если организм получает слишком мало металлов, ему наносится тяжелый ущерб. Это объясняется тем, что в организме содержится множество ферментов, которые могут функционировать только в присутствии тяжелых металлов, хотя бы в следовых количествах. Однако если организм получает слишком много металла, то наступает вторая фаза, связанная с токсическим действием избыточного количества. Примером такой двухфазной реакции может служить действие ме-ди на овес: как избыточное, так и недостаточное количество этого ме-талла наносит вред процессам его роста и развития (см. рис. 7.1). Рост микроорганизмов также часто зависит от концентрации одного или нескольких катионов металлов в питательной среде: следует избегать как избыточных, так и недостаточных концентраций, так как в любом случае рост будет заторможен.
Хелатообразование зависит от степени ионизации хелатообразую- щих агентов. Вещества, обладающие меньшим сродством к металлам (на что указывает более низкая константа устойчивости), за счет раз-личий в значениях рКа могут образовывать значительно больше анио-нов, чем другие агенты.В этом случае вещество, обладающее меньшим сродством к метал-лу, может присоединить большее количество катионов металла, чем вещества, у которых это сродство больше. Это объясняется тем, что для хелатообразования необходимо не только наличие сродства между лигандом и металлом, но также быстрое образование анионов лиганда из агента (или молекул лиганда). Большинство металлов легче соединяются с лигандами, содержа-щими кислород, чем серу. Однако Cu+, Ag+, Hg2+, As+ и Sb3+ отдают предпочтение сере; у Си Ni2+ и Со2+ сродство к сере несколько выше, чем к кислороду, если сера находится в неионизированном состоянии, как, например, в органических сульфидах.Еще одним фактором, влияющим на относительное сродство ряда металлов, служит изменение окислительно-восстановительного потенциала металла, вызванного образованием хелатных соединений с металлами, имеющими переменную валентность (например, Си, Fe, Со, Mn, Mo, V).
