Твердофазный непрямой иммуноферментный анализ
1. На твердую фазу стандартных 96-луночных планшетов сорбируют заданные антигены. В большинстве тест-систем используют в качестве антигенов либо рекомбинантные белки, либо синтетические пептиды, реже - компоненты лизата натуральных вирусов. Антигены растворяют до конечной концентрации 1-10 мкг/мл или опытным путем подбирают более подходящие концентрации, чаще всего в 0,05 М карбонат-бикарбонатном буфере при рН 9,6.
Для приготовления 1 л буферного раствора берут 0,015 М (1,59 г) Na2CO3 и 0,035 M, 94 г NaHCO3 и растворяют в воде.
Раствор АГ вносят в лунки планшетов в объеме 50-100 мкл.
Существуют другие варианты посадочных буферов, например фосфатно-солевой буфер, рН 7,2 (PBS).
Для приготовления 1 л раствора PBS берут 0,0025 М дигидрофосфата натрия (0,345 г NaH2PO4 × H2O, MW 137,99); 0,0075 М гидрофосфата натрия (2,68 г Na2HPO4 × 12 H2O, MW 358,14) и 0,145 М хлористого натрия (8,474 г NaCl, MW 58,44).
Время, отводимое на сорбцию, подбирают опытным путем. Как правило, достаточно 12-16 ч при комнатной температуре или при +4 °С.
2. Лунки планшета тщательно промывают фосфатно-солевым буфером или водой с детергентом (0,1% Tween-20) 5-10 раз. В современных лабораториях процедуры отмывки осуществляют в аппаратах типа «вошер» (англ. to wash - мыть).
3. В некоторых случаях на следующем этапе в лунки вносят 1% раствор бычьего сывороточного альбумина (БСА) или иного консервативного белка, например казеина, для так называемой «забивки» не покрытых антигеном площадей на дне лунок. Инкубируют 30-60 мин, после чего отмывают.
4. В лунки вносят исследуемые образцы биопроб в тех или иных разведениях. Для каждого разведения используют 2-3 лунки («параллели»). В качестве разводящей жидкости применяют PBS. В некоторых случаях в него добавляют 1% БСА. Инкубируют 1 ч и дольше. Время либо подбирают опытным путем, либо следуют инструкции к коммерческой тест-системе.
5. Отмывают (как описано выше).
6. Вносят конъюгат антииммуноглобулиновых антител с ферментом в заранее подобранном рабочем разведении или по инструкции к тест-системе. Инкубируют 1 ч.
7. Отмывают (как описано выше).
8. Вносят в лунки раствор субстрата того фермента, который входит в состав антииммуноглобулинового конъюгата. Если фермент - пероксидаза хрена, то субстратами могут быть ортофенилендиамин и перекись водорода. Эти субстраты растворяют в 0,1 М цитрат-фосфатном буфере, рН 5: цитрат χ H2O 0,0347 M (7,3 г/л, MW 210,14); гидрофосфат натрия 0,0667 M (Na2HPO4 × 12 H2O 23,87 г/л, MW 358,14).
На один планшет требуется 10 мл раствора. C небольшим запасом к 12 мл субстратного буфера добавляют 8 мг ортофенилендиамина и 5 мкл 30% перекиси водорода, быстро растворяют и раскапывают по лункам.
9. Через 15-30 мин в лунках, где произошла реакция «антиген- антитело», появится желто-коричневая окраска. Другие лунки останутся бесцветными. Для остановки ферментативной реакции в лунки вносят по 50 мкл 1 М раствора серной кислоты (55,5 мл 96 серной кислоты на 900 мл воды; строго добавлять кислоту в воду, а не наоборот!!!).
10. Интенсивность ферментативной реакции измеряют в единицах величины оптической плотности на спектрофотометрах, приспособленных для планшетов («мультисканах»). Для ортофенилендиамина
длина волны проходящего света должна быть 492 нм (для тетраметилбензидина - 450нм). В связи с этим в мультискане устанавливают соответствующий светофильтр.
11. Современные спектрофотометры оснащены программным обеспечением, в котором предусмотрен автоматический расчет средних значений между параллелями и сравнение опытных показателей с показателями в контрольных лунках. Если такого обеспечения нет, то результаты анализируют «вручную».
Оптическую плотность (OD - optical density) в контрольных лунках принимают за некий «фон». Эти показатели умножают на 2; такую величину условно принимают за «линию раздела» - границу (cut off) между положительными и отрицательными значениями OD: значения ниже «cut off» считают отрицательными, значения выше «cut off» - положительными, значения, близкие к «cut off», - неопределенными, или «серой зоной».
Метод иммуноблота
Метод иммуноблоттинга (первоначальное название Western blot, WB1) был разработан главным образом в целях обнаружения в сыворотках пациентов антител, реагирующих с отдельными белками возбудителей инфекционных заболеваний, чаще всего вирусов.
Метод представляет собой следующее.
1. В культурах клеток in vitro (в настоящее время, как правило, в промышленных масштабах) выращивают препаративные количества реплицирующихся вирусов.
2. Клетки разрушают (ультразвуком или иначе), вирусную массу выделяют из культуральной смеси методами ультрацентрифугирования.
3. Вирусные частицы диссоциируют на отдельные белки детергентами и подвергают электрофорезу в геле. В результате каждый вирусный белок в соответствии со своей молекулярной массой и электрическим зарядом занимает определенную позицию в геле. Без применения красок и специальных проявляющих реагентов фракционированные электрофорезом белки в геле не видимы глазу.
1 Впервые блестящая методическая идея «блоттинга» (переноса на «промокашку»; blot по-английски - пятно на промокашке) пришла в голову и была реализована применительно к электрофоретическому анализу ДНК биохимиком E.M. Southern в 1975 г. Из уважения к автору коллеги-биохимики воспользовались лингвистической особенностью фамилии Southern (южный) и тот же метод, примененный к РНК, назвали Northern blot (северный), а к белкам - Western blot (западный).
4. В целях существенной экономии дорогостоящих реагентов в дальнейшем фракционированные белки из геля «промокают», перенося таким образом на плоский пористый материал - нитроцеллюлозу. В производственных масштабах перенос продуктов электрофоретического разделения в геле на нитроцеллюлозу осуществляют также электрофорезом.
5. Лист нитроцеллюлозы с перенесенными на нее электрофоретически разделенными белками вируса нарезают на тонкие полоскистрипы (strip), соответствующие по формату специальным выпускаемым промышленностью пластмассовым «корытцам», в которых стрипы обрабатывают испытуемыми сыворотками и проявляющими реагентами.
6. Стрип заливают испытуемой неразведенной и разведенной 1:10 (или подбирают иные разведения) сывороткой, инкубируют 1 ч или более, тщательно промывают фосфатным солевым буфером с детергентом (0,1% Tween-20), заливают раствором конъюгата антииммуноглобулиновых антител с ферментом (например, пероксидазой хрена), инкубируют 1 ч, тщательно промывают, вносят раствор субстрата (например, ортофенилендиамина с перекисью водорода), после чего наблюдают, не проявятся ли окрашенные полосы в зонах расположения фракционированных вирусных белков.
В случае, если у человека в крови нет противовирусных антител, стрип остается неокрашенным (имеет место лишь неспецифический легкий фон по всей площади стрипа). Это отрицательный результат. Если окрашенными оказываются все полосы вирусных белков, результат квалифицируют как положительный. Если окрашиваются не все, а 1-2 полосы, результат рассматривают как неопределенный.
Ложноотрицательные результаты в иммуноблоте крайне маловероятны. Поэтому по международным соглашениям сертифицированные для клинической диагностики промышленно выпускаемые иммуноблоттинговые тест-системы приняты в качестве подтверждающихпо отношению к планшетным и прочим скрининговым иммуноанализам. На рис. 4.11. представлена схема «сэндвича», приготовленного для блоттинга.
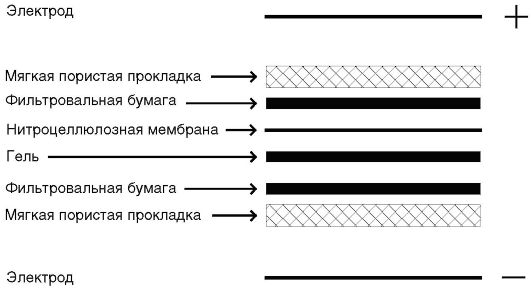 Рис. 4.11.Схема «сэндвича», приготовленного для блоттинга
Рис. 4.11.Схема «сэндвича», приготовленного для блоттинга
