Светооптические микроскопы и методы микроскопирования
Световой микроскоп. Устройство и принцип работы
Основная оптическая часть микроскопа состоит из объектива и окуляра. Объектив является наиболее ответственной оптической системой, дающей увеличенное изображение предмета.
Объективы подразделяются: а) по степени совершенства исправлений аберраций (искажений) на монохроматы (предназначены для работы при монохроматическом освещении), ахроматы (хроматическая аберрация исправлена для 2 цветов спектра); апохроматы (хроматическая аберрация неправлена для 3 цветов спектра); планмонохроматы, планахроматы, планапохроматы (исправлена кривизна поверхности изображения);
б) по степени увеличения на объективы малых увеличений (увеличение ≤10); объективы средних увеличений (увеличение ≤40); объективы больших увеличений (увеличение ≥40);
в) по свойствам иммерсии на безиммерсионные (сухие системы) и иммерсионные системы.
Получение максимального увеличения возможно только с помощью иммерсионного объектива (как правило, объектива с увеличением 90).
Иммерсионные объективы рассчитываются на работу с покровными стеклами не толще 0,17 мм.
Окуляр — оптическая система, которая служит в качестве лупы при визуальном наблюдении увеличенного изображения предмета, даваемого объективом, и в качестве проекционного устройства при микрофотографировании. Окуляр обычно увеличивает изображение в 5-25 раз.
Наиболее распространенными являются окуляры Гюйгенса и компенсационные. Окуляры типа Гюйгенса применяются в сочетании с ахроматами, окуляры компенсационного типа — с апохроматами и планахроматами.
Важнейшими характеристиками микроскопа являются разрешающая способность и увеличение.
Разрешающая способность (d) — минимальное расстояние между двумя точками объекта, которые видны раздельно.
Известно, что
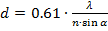 ,
,
где λ – длина волны света, в котором наблюдается объект; п — показатель преломления среды между объектом и объективом; а — угол между оптической осью объектива и наиболее отклоненным лучом, попадающим в объектив.
Величина n-sin α является важной оптической характеристикой объектива и называется числовой апертурой объектива. Из формулы следует, что разрешающая способность микроскопа тем выше, чем меньше длина волны и чем больше апертура объектива.
Увеличение микроскопа — величина, показывающая, во сколько раз линейные размеры изображения, формируемого оптической системой микроскопа, больше линейных размеров объекта. Увеличение микроскопа зависит от увеличений объектива и окуляра и численно равно произведению этих увеличений. При этом необходимо помнить, что объектив увеличивает изучаемый объект, а окуляр — изображение, полученное при помощи объектива, не добавляя к нему новых деталей, не выявленных объективом.
Современные оптические микроскопы имеют предел полезного увеличения до 1500 раз. Большее увеличение практически бесполезно, так как оно не ведет к выявлению новых деталей микрообъекта.
Техника микроскопирования гистологических препаратов
Микроскопирование гистологического препарата начинают с установки освещения. Для этого с помощью вогнутого зеркала (при естественном освещении) или плоского (при искусственном освещении) достигается равномерное освещение поля зрения. Препарат помещается на предметный столик покровным стеклом вверх. Изучение препарата начинают при малом увеличении. Расстояние между объективом и покровным стеклом препарата должно быть около 1 см. Наводка на резкость производится с помощью макровинта. Перемещая препарат на предметном столике, рассматривают его детали по всей площади.
К изучению препарата на большом увеличении приступают после осмотра его при малом увеличении. Установив в центр поля зрения участок препарата, который следует изучить при большом увеличении, с помощью револьверного устройства ставят более мощный объектив. Наводка на резкость производится с помощью микровинта плавным вращением его вперед или назад.
Для изучения очень мелких гистологических структур используется иммерсия, позволяющая повысить разрешающую способность микроскопа. При этом на покровное стекло препарата наносится капля иммерсионной жидкости (вода, глицерин, кедровое масло и др.), после чего с помощью макровинта объектив осторожно опускается до соприкосновения его фронтальной линзы с иммерсионной жидкостью. Плавно вращая микровинт, добиваются появления четкого изображения. По окончании работы иммерсионная жидкость удаляется с объектива и покровного стекла сухой марлей.
При работе на больших увеличениях конденсор необходимо поднять вплоть до соприкосновения с предметным стеклом. При работе на малом увеличении конденсор следует несколько опустить.
Специальные методы светооптической микроскопии
Сравнительная микроскопия. Оптическая схема микроскопа сравнения представляет собой систему из двух микроскопов с собственными осветительными устройствами. Изображения левого и правого объектов с помощью объективов и прямоугольных призм сводятся на разделительную призму в одно общее поле зрения окуляра. Поскольку призменный блок неподвижен, то поле зрения всегда остается разделенным на две равные части и, таким образом, в поле зрения микроскопа оба исследуемых объекта всегда видны одновременно. При. необходимости изображение может быть спроектировано на матовую пластинку.
Микроскопы сравнения наиболее эффективны при проведении сравнительного микроскопического анализа нормальных и патологически измененных, тканей, клеток, при изучении изменений в исследуемом объекте во времени.
Фазово-контрастная микроскопия применяется для изучения малоконтрастных прозрачных препаратов, которые почти не поглощают света, т. е. не изменяют амплитуду световой волны, но изменяют фазу проходящей волны. Однако глаз не может регистрировать фазовых изменений.
Метод фазового контраста дает возможность преобразовать фазовые изменения света в амплитудные, в результате чего появляется видимое изображение препарата, в котором распределение освещенностей соответствует распределению фаз. Практически метод фазового контраста реализуется введением в оптическую систему микроскопа кольцевой диафрагмы и специальной фазовой пластинки. Метод используется для изучения живых объектов или неокрашенных препаратов.
Люминесцентная микроскопия. Предметом изучения в люминесцентной микроскопии является фотолюминесценция гистологических структур, возбуждаемая электромагнитным излучением видимой или ультрафиолетовой области спектра. Поэтому в люминесцентных микроскопах в качестве источника света используются ртутные лампы.
Различают два вида флюоресценции: собственную и наведенную. Любая клетка живого организма обладает собственной флюоресценцией, однако она обычно бывает чрезвычайно слабой. Наведенная (вторичная) флюоресценция возникает при обработке препаратов специальными красителями — флюорохромами. Их концентрация настолько мала, что они не влияют на состав и структуру препарата, а также не нарушают жизнедеятельность биологических объектов. Это дает возможность с помощью люминесцентной микроскопии проводить прижизненное микроскопическое исследование. Люминесцентный анализ — очень чувствительный метод исследования, позволяющий определять химический состав отдельных элементов структуры, их химические превращения, количество тех или иных компонентов и т. д.
Ультрафиолетовая микроскопия. В ультрафиолетовых микроскопах используется излучение ультрафиолетовой области спектра, длина волны которого вдвое меньше длины волны видимого света. Благодаря этому разрешающая способность ультрафиолетового микроскопа в 2 раза выше, чем у обычного светового.
В основе ультрафиолетовой микроскопии лежит избирательное поглощение биологическими тканями и клетками коротковолнового излучения, вследствие чего микроскопирование ультрафиолетовых изображений позволяет увидеть их структуру. Преобразование невидимого изображения, формируемого УФ-микроскопом, в видимое осуществляется с помощью флюоресцентного экрана.
Электронная микроскопия
Электронные микроскопы в настоящее время обладают самой высокой разрешающей способностью, которая обусловлена очень небольшой длиной волны электромагнитных колебаний потока электронов, используемых в приборе. При употреблении высоких ускоряющих напряжений (при разности потенциалов около 50 000 вольт) длина электромагнитной волны может составлять приблизительно 0,005 нм, а разрешающая способность — 0,0025 нм (  ). Таким образом, в электронном микроскопе теоретически возможно повышение разрешающей способности и соответственно увеличения изображения в 100 000 раз большее по сравнению со световым микроскопом.
). Таким образом, в электронном микроскопе теоретически возможно повышение разрешающей способности и соответственно увеличения изображения в 100 000 раз большее по сравнению со световым микроскопом.
Практически лучшие современные электронные микроскопы имеют разрешающую способность 0,1-0,3 нм, что позволяет исследовать все ультраструктуры клетки на молекулярном уровне. При этом достигается увеличение объекта до 150000 раз. Направление движения и фокусировка потока электронов производятся с помощью электромагнитных линз, которые играют роль объектива и окуляра, в результате чего достигается эффект прохождения лучей, аналогичный их прохождению в световом микроскопе.
Конечное увеличенное изображение объекта формирует проекционная линза, его невозможно увидеть глазом, так как длина волны электромагнитных колебаний лежит далеко за пределами видимой части спектра. Поэтому изображение проецируется на экран, покрытый люминофором. Поток электронов, взаимодействуя с люминофором, вызывает свечение, лежащее уже в видимой части спектра.
Наиболее часто в морфологических исследованиях используются, просвечивающие электронные микроскопы, позволяющие получить плоскостное изображение изучаемого объекта. В последние годы активно применяют растровые (сканирующие) электронные микроскопы, способные создавать трехмерные изображения, т. е. получать пространственное изображение структур.
Техника микроскопирования в электронном микроскопе состоит в следующем:
1. Препараты (срезы на сеточках) помещают в специальный объектодержатель в электронном микроскопе.
2. С помощью регулировочных винтов устанавливаются увеличение, фокус, максимальная освещенность объекта, что контролируется просмотром изображения на люминесцирующем экране.
3. Перемещая образец, находят интересующую исследователя ультраструктуру.
4. Объект фотографируется на микрофотопластинки (или фотопленки), помещенные в специальные кассеты (магазин).
5. Электронные микрофотографии, полученные с этих пластинок, являются объектом, по которому изучаются ультраструктуры.
Цель занятия— овладение методами световой и электронной микроскопии гистологических объектов.
Задачи:
1. Ознакомиться с устройством и принципом работы различных световых микроскопов.
2. Овладеть техникой микроскопирования гистологических препаратов в световых микроскопах.
3. Ознакомиться со специальными методами исследования гистологических препаратов: сравнительная, фазово-контрастная, люминесцентная и ультрафиолетовая микроскопия.
4. Ознакомиться с принципами работы электронного микроскопа и особенностями микроскопирования в нем микрообъектов.
Необходимый исходный уровень знаний:
1. Световой микроскоп, его устройство, основные характеристики.
2. Методы фазового контраста, люминесцентной и ультрафиолетовой микроскопии.
3. Электронный микроскоп, его устройство, основные характеристики.
4. Основные требования к гистологическому препарату, предназначенному для микроскопирования.
Задания:
1. Возьмите биологический рабочий микроскоп (МБР). Изучите его составные части. Наладьте освещение. Поставьте на предметный столик препарат, проследите за тем, чтобы покровное стекло было обращено вверх. На малом увеличении найдите интересующую вас структуру и рассмотрите ее при большом увеличении.
2. В микроскопе сравнения в одной половине поля зрения виден орган контрольного, в другом — подопытного животного; сравните особенности их структуры.
3. Возьмите чешуйку луковицы. Снимите с нее тонкую пленку, поместите в каплю физиологического раствора и изучите строение живой растительной клетки с помощью фазово-контрастного микроскопа.
4. Изучите с помощью люминесцентного микроскопа препарат, окрашенный акридином оранжевым. Обратите внимание на зеленое свечение ядер и красное цитоплазмы.
5. Ознакомьтесь с методикой получения ультратонких срезов на ультратоме и с основными приемами изучения гистологических объектов в электронном микроскопе.
Контрольные вопросы:
1. В чем состоят сходство и отличия светового и электронного микроскопов, каковы их разрешающие способности и увеличения?
2. Каковы преимущества фазово-контрастного микроскопа?
3. С какой целью применяется микроскоп сравнения?
4. Каковы отличительные особенности ультрафиолетовой микроскопии?
5. В чем состоит достоинство люминесцентной микроскопии?
Ситуационные задачи:
1. Вам необходимо рассмотреть форму неокрашенных живых клеток. Какие виды микроскопии можно применить?
2. Вы намерены изучить структуру клеточной оболочки, имеющей толщину 7-10 нм. Каким микроскопом вы воспользуетесь?
3. Перед вами стоит задача изучить на уровне световой микроскопии мелкие детали строения клетки. Какой объектив вы используете: Х8, Х40 или иммерсионный?
4. Необходимо выявить возможно большее число гистологических структур. Какой из двух режимов микроскопирования (объектив Х40, окуляр Х10 или объектив Х20, окуляр Х20) вы выберете?
5. -Дано задание выяснить, имеются ли изменения в интенсивности гистохимического окрашивания изучаемой структуры в норме и после какого-либо воздействия. Какой вид микроскопирования лучше применить?
ПодтемаЗ
СОВРЕМЕННЫЕ МЕТОДЫ
