Механизмы повреждения клеточных структур
I. Липидный механизм
- Свободнорадикальное и перикисное окисление липидов
Свободные радикалы – это атомы (или молекулы) с неспаренными электронами на внешних атомных или молекулярных орбитах, отличающиеся высокой реакционной способностью.
Два электрона одной орбитали (спаренные) имеют противоположные спины (направление вращения электрона вокруг собственной оси, которое создает магнитное поле с параллельным, или антипараллельным вектором относительно магнитного поля Земли), а отсюда и нулевой общий магнитный момент.
Неспаренный электрон придает атому (или содержащей его молекуле) магнитный момент, который предопределяет его химическую реакционную способность.
Неспаренные электроны стремятся ликвидировать феномен неспаренности двумя путями.
· Взаимодействием с другими свободнорадикальными атомами (или молекулами) с образованием химически инертного продукта;
· «Выдергиванием» неспаренного электрона с противоположным спином из внешней оболочки свободных или связанных атомов. Объектом такого воздействия являются переходные металлы, богатые неспаренными электронами, в результате взаимодействия радикал становится химически инертным (тушится), а металл изменяет заряд. Но свободные радикалы способны «выдергивать» электроны и из биоорганических соединений, которые превращаются в свободнорадикальные (перикисные) соединения с патологическим нарушением биохимических процессов.
Свободные радикалы постоянно образуются в организме и попадают в него из окружающей среды (все виды излучения).
Свободные радикалы не бывают «хорошими» или «плохими». Они необходимы организму для выполнения ряда функции, например в дыхательной цепочке, но оказывают повреждающее действие при увеличении их количества.
В процессе биологического окисления образуются супероксидный радикал О2Ÿ и гидроксидный радикал ŸОН (свободные радикалы), оксид азота NОŸ (преимущественно участвует в регуляции сосудистого тонуса) и перекись водорода Н2О2(последняя не является свободным радикалом, но в результате менталлокатализа превращается в гидроксильный радикал). Н2О2 легко разрушается каталазой.
супероксидный радикал О2Ÿ генерируется лейкоцитами при фагоцитозе, образуется в митохондриях в процессе окислительных реакций, в тканях при метаболической трансформации катехоламинов, синтезе простогландинов. Некоторые реакции сопровождаются образованием гидроксильного радикала ŸОН и пероксида водорода Н2О2 (необходимых киллерам и фагоцитам).
Кислородные радикалы обеспечивают свободнорадикальное окисление субстратов, основными из которых являются полиненасыщенные жирные кислоты клеточных мембран. Это влияет на полярность гидрофобных углеводородных хвостов жирных кислот, которые образуют липидный бислой мембраны. В результате изменяется структура мембраны, ее проницаемость и ионный транспорт. В физиологических условиях это один из способов регуляции функции клетки.
Оксид азота NO· легко проходит через мембранные структуры и в качестве посредника обуславливает расслабление гладких мышц стенки сосудов, ЖКТ, бронхов и других полых органов, выполняет роль нейротрансмиттера, а также антигрегантную и адгезивную функцию. Особое внимание заслуживает противомикробное и противопаразитарное действие NO·. Именно этим объясняется генерация больших количеств оксида азота клетками эпителия бронхов, а также иммунной системы (лейкоциты, макрофаги). Чужеродные липополисахариды в указанных клетках часто одновременно активируют и мембранную НАДФН-оксидазу, генерирующую супероксид O2·¾, который нейтрализует NO· с образованием пероксинитрита (ONOO-). При физиологическом рН превращается в слабую пероксинитрокислоту.
Цитотоксическое действие пероксинитрита объясняется возможностью его распада на NO2- и OH·. Гидроксильный радикал способен запускать окисление липидов, белков и нуклеиновых кислот.
Физиологическое значение свободных радикалов заключается в регуляции генетической программы и апоптоза, образовании катехоламинов, стероидных гормонов и др., детоксикации ксенобиотиков, медиаторов и гормонов, разрушении фагоцитированных структур в фагоцитах.
ПОЛ – физиологический процесс регуляции клеточной активности, однако при избытке свободных радикалов приводит к гибели клетки.
Патологический эффект в организме возникает при избыточной продукции свободных радикалов, или при дефиците антиоксидантных факторов.
При избытке образования свободных радикалов структуры клетки разрушаются, и она гибнет.
Антиоксидантная система подразделяется на неэнзимную и энзимную.
a) Неэнзимные антиоксиданты являются донорами электронов для радикальных молекул, превращают их в инертные молекулы, но являются «двуликими» и сами становятся свободнорадикальными. Выполняют лишь буферную роль в антиоксидантной защите организма.
· водорастворимые соединения (аскорбиновая кислота, мочевая кислота, глютатион);
· жирорастворимые соединения (a-токоферол, ретинол).
· спирты и тиолы (цистеин, дитиотретиол, маннитол, тиомочевина, этанол и др.)
b) Ферментные антиоксиданты способны выступать в качестве доноров или акцепторов свободных электронов, являются основной защитой организма от оксидативного стресса.
· супероксиддисмутаза нейтрализует свободнорадикальный кислород с образованием перекиси водорода и атомарного кислорода;
· каталаза разлагает перекись водорода;
· глутатионпероксидаза в цитозоле клеток разлагает перекись водорода.
c) Липидные антиоксидантные «ловушки» (перехват свободных радикалов) – это холестерол клеточных мембран, гидрофильные головки фосфолипидов клеточных мембран.
- Активация фосфолипаз ионами Са++, что приводит к расщеплению структурных элементов мембран и образованию лизофосфолипидов (детергентов).
- Накопление свободных жирных кислот, обладающих детергентными свойствами.
II. Кальциевые механизмы
Существует 2 вида Ca++ насосов: Са++ АТФаза и Na+/Ca++ АТФаза.
Если Са++ появляется в цитоплазме, то начинается активация ферментов. В зависимости от происхождения клетки, Са++ может активировать разные функции: в мышечных – сокращение, в нервных – возбуждение, в тучных клетках – выброс гистамина и т. д.
Накопление Са++ в цитоплазме мышечной клетки приводит к активации ферментов: кальмодулина (сокращение мышечного волокна), протеинкиназ (синтез белка и, следовательно гипертрофия мышц).
Но, если Са++ чуть больше, начинается активация фосфолипаз (расщепление фосфолипидов мембран, причем мембран как клеточной, происходит аутолиз клетки, так и мембран органелл, например, лизосом, лизосомальный аутолиз клетки,повреждение мембран митохондрий с последующим выходом из них Са++ (митохондрии – аккумулируют Са++ ).
Активации лизосомальных ферментов способствует изменение pH в кислую сторону (аналогично перевариванию в ЖКТ).
Основные проявления повреждения клеток:
1. Дистрофия – это нарушение обмена веществ в клетке (трофики), сопровождающееся нарушением функции и структуры клетки и ведущее к ее гибели.
Основные механизмы дистрофии:
- синтез аномальных веществ в клетке (например, β-амилоид при болезни Альцгеймера);
- трансформация - избыточное превращение общих исходных продуктов обмена веществ (жиры, белки, углеводы) в продукты одного вида обмена веществ (углеводы);
- декомпозиция (фанероз) – накопление в тканях продуктов нарушенного обмена веществ вследствие распада структур клетки и межклеточного вещества;
- инфильтрация (например, отложение холестерина в стенке сосуда).
2. Дисплазия – это нарушение развития клеток, проявляющееся стойким нарушением их структуры и функции, ведущее к нарушению их жизнедеятельности. Вызывают дисплазии различные факторы, повреждающие клеточный геном. В отличие от дистрофий дисплазии необратимы. Основной механизм дисплазий – нарушение дифференцировки клеток.
3. Некроз – это необратимая гибель клеток.
Стадии умирания клетки:
- Паранекроз – сходное с гибелью обратимое изменение обмена веществ и функционирования клетки под влиянием патогенного фактора.
- Некробиоз – необратимое состояние между жизнью и смертью, агония клетки.
- Некроз – гибель клетки.
- Аутолиз – саморазрушение клеточных структур и клетки в целом. Механизмы аутолиза – гидролиз компонентов клеток и межклеточного вещества под влиянием ферментов лизосом (основной) и свободнорадикальное и перекисное окисление липидов.
Виды некроза:
a) Морфологически:
· коагуляционный (сухой) – преобладание процессов уплотнения, свертывания и обезвоживания, развивается в тканях, богатых белками (сердце, мышцы, печень, почки).
· колликвационный (влажный) – разжижение, размягчение с образованием кист и полостей, развивается в тканях, богатых жидкостью (мозг).
b) Анатомически:
· инфаркт – это некроз в результате прекращения кровоснабжения органа (или ткани).
· гангрена – вид некроза тканей, соприкасающихся с внешней средой (сухая и влажная).
· секвестр – отделение омертвевшего участка от живых тканей (например, при остеолмиелите).
4. Апоптоз – запрограммированная, активная (энергозатратная) форма гибели клеток, проявляющаяся уменьшением ее размеров, конденсацией и фрагментацией хроматина, уплотнением мембраны без выхода содержимого в окружающую среду.
Считается, что термин апоптоз предложил древнеримский врач Гален. В процессе наблюдения за природой он заметил, что если надломить ветку дерева, с которой уже начали опадать листья, то листопад прекращается, а листья, хотя и меняют цвет, остаются на ветке. То есть опадание листьев, в отличие от их омертвения на сломанной ветке, - физиологический процесс, преднамеренное самоубийство листьев.
Сегодня термин апоптоз, буквально означающий «опадание листьев», применяется к физиологическому явлению - самоубийству клеток, т.е. генетически запрограммированной гибели клеток. Другими словами существует особая генетическая программа, реализация которой при определенных условиях приводит клетку к гибели. В современную науку использование термина апоптоз введено Керром (J.F.R. Kerr) в 1972 году.
Апоптозом управляют особые гены: стимулирует апоптоз ген р53 (ему принадлежит важнейшая роль в противоопухолевой защите), ингибирует апоптоз – ген bcl2 (относится к протоонкогенам из-за его способности предотвращать апоптоз и сохранять клетки с мутациями).
Апоптоз противопоставляется другой распространенной форме гибели клеток – некрозу.
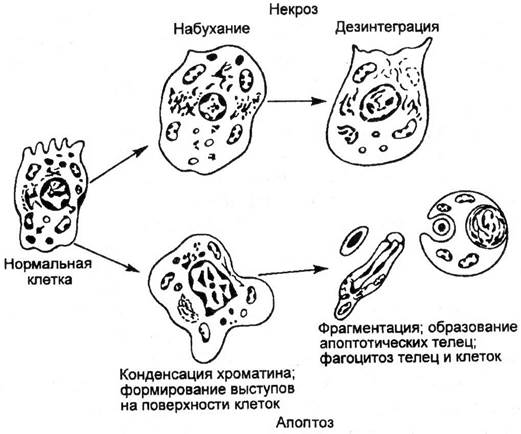
Рис. 2.2. Сравнительное изображение развития некроза и апоптоза клеток.
Апоптоз проявляется уменьшением объема клетки в противоположность ее набуханию при некрозе; конденсацией и фрагментацией хроматина; снижением трансмембранного потенциала митохондрий; уплотнением цитоплазматической мембраны без выхода содержимого в окружающую среду. В результате фагоцитоза, которому клетки подвергаются уже в процессе апоптоза, их содержимое не выделяется в окружающую среду, как это бывает при некрозе, когда вокруг гибнущих клеток скапливаются активные внутриклеточные компоненты, включая энзимы, закисляется среда, что способствует гибели других клеток и развитию очага воспаления. Апоптоз поражает индивидуальные клетки и практически не отражается на их окружении.
Стадии апоптоза:
I. Индукторная. Сигналами к развитию апоптоза (индукторами апоптоза) являются внеклеточные (антигены, гормоны (например, кортикостероиды), цитокины, УФ- и g-излучение, нагревание) и внутриклеточные (повреждение хромосом и дефицит сигналов) факторы. К универсальным индукторам относятся также нарушение осмотического равновесия, высокое содержание Ca++ и NO. Индукторы апоптоза в свою очередь запускают ферменты (каспазы), которые регулируют весь процесс апоптоза. Эта стадия подразумевает прохождение неких контрольных точек, в которых клетке предоставляется выбор между индукцией и блокадой апоптоза, т. е. данная стадия еще является обратимой. После их прохождения клетка вступает в следующую необратимую фазу апоптоза.
II. Эффекторная – в клетке происходит снижение трансмембранного потенциала митохондрий, развивается массовый протеолиз и расщепление ядерной ДНК с формированием крупных фрагментов (олигонуклеосом и нуклеосом. Такая фрагментация считается биохимическим маркером апоптоза, а на ее выявлении основаны современные методы диагностики апоптоза.
III. Деградация клетки.
Роль апоптоза:
· Поддержание постоянства численности клеток (своего рода контроль перенаселения.
· Определение формы организма и его частей (например, наблюдается интенсивный апоптоз нервных клеток в процессе формирования коры у зародыша на 12-23-й неделях беременности).
· Обеспечение правильного соотношения численности клеток различных типов (быстрая атрофия гормон-зависимых тканей при снижении концентрации соответствующих гормонов, например, в женских половых органах в течение менструального цикла, или в простате при снижении концентрации андрогенов).
· Удаление генетически дефектных клеток.
· Селекция лимфоцитов и регуляция иммунных процессов.
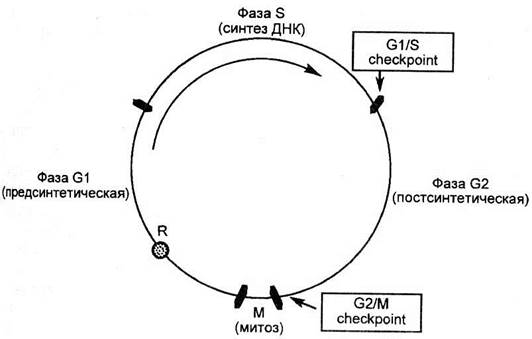
Рис. 2.3. Схема клеточного цикла.
Ингибиторы апоптоза:
- мутация Р53;
- теломераза;
- интерферон j.
Воздействие радиации вызывает (через свободно-радикальное повреждение) мутации и изменение в структуре ДНК. В результате – клетка остается в G1-фазе митоза (если она входит в S-фазу, то происходит апоптоз). Мутационная форма белка Р53 не обладает способностью останавливать клеточный цикл, это явление наблюдается у опухолевых клеток
Теломераза – фермент, обеспечивающий восстановление длины теломерного (концевого) участка хромосомной ДНК. Каждое деление делает хромосому короче на 10-20 теломерных фрагментов. Что дает возможность произвести только 50 делении (лимит Хайфлика).
У человека теломераза функционирует только в эмбриональных клетках и семенниках, вырабатывающих сперматозоиды в течение всей жизни. В опухолевых клетках теломераза активна.
Патология, обусловленная нарушением апоптоза:
A) Ослабление апоптоза
· аутоиммунные процессы (семейный аутоиммунный лимфопролиферативный синдром, системная красная волчанка, ревматоидный артрит);
· злокачественные опухоли (лимфома Беркитта, лейкозы, солидные опухоли).
b) Ускорение апоптоза
· врожденные уродства (волчья пасть, заячья губа и др.);
· болезни крови (миелодисплазии, анемии (железо- фолио- В12 – дефицитные), тромбоцитопения, нейтропения).
· инфекционные заболевания (СПИД, бактериальный сепсис и др.);
· дистрофические заболевания нервной системы (боковой амиотрофический склероз, болезнь Альцгеймера, спинальная мышечная атрофия);
· другие заболевания (инфаркт миокарда, токсические гепатиты).
IV. Компенсаторные механизмы клетки при повреждении.
