Классификация белков. простые и сложные белки
Принципы классификации белков
В основу классификации белков положена их структурная организация. Наиболее полная классификация структур белков представлена в компьютерных классификаторах«Dali/FASS», сделанных Л. Холмом и К. Сандером; в классификаторах, сделанных в группе Дж. Торнтон «CATH» (Class-Architecture-Topology—Homology) и в классификаторе «SCOP» (Structural Classification of Proteins), созданном А.Г. Мурзиным.
Классификация относится к строению доменов (компактных глобул), существующих либо сами по себе, либо в составе многодоменного белка. Она начинается со структурного класса домена (α, β и т.д.). Классы подразделяются по архитектурным типам каркаса, сложенного из α- и/или β-участков; архитектуры подразделяются по топологиям прохождения цепи через каркас, т.е. по мотивам укладки цепи.
И уже далее мотивы подразделяются на суперсемейства, где просматривается хоть какая-то гомология (след общего происхождения) последовательностей, суперсемейства – на семейства с явно проявляющейся гомологией, и т.д. вплоть до отдельных белков конкретных организмов.
Физическая классификация белковых структур (класс-архитектура-топология) дает возможность не только систематизировать уже изученные структуры, но и предсказывать будущие открытия белковых структур. Так, долгое время были известны только такие β-белки, которые сложены из антипараллельной β-структуры, а на месте β-белков, сложенных из параллельной β-структуры зияла лакуна, но потом она заполнилась.
По химическому составу все белки делят на простые, состоящие только из аминокислотных остатков, и сложные. Сложные могут включать ионы металла (металлопротеины) или пигмент (хромопротеины), образовывать прочные комплексы с липидами (липопротеины), нуклеиновыми кислотами (нуклеопротеины), а также ковалентно связывать остаток фосфорной кислоты (фосфопротеины), углевода (гликопротеины).
Простые белки подразделяют на фибриллярные, растворимые в воде (актин, миозин) и нерастворимые (кератин, эластин, коллаген), и глобулярные (альбумины, глобулины, протамины, гистоны, проламины).
Фибриллярные белки
Коллагены, эластин, кератин относятся к нерастворимым фибриллярным белкам, которые составляют наружный покров тела животного и находятся в скелете и в соединительной ткани.
Коллагены широко распространены в живых организмах. Из них состоит соединительная ткань; они находятся в хрящах. Кости позвоночных животных состоят из неорганических веществ (фосфорнокислого и углекислого кальция), жира и коллагенов. При кипячении с водой или действии перегретого водяного пара коллагены образуют клей. Если из костей извлечь жир и потом, обработав их кислотой, растворить фосфорнокислый кальций, останется белковое вещество – оссеин. При обработке оссеина перегретым водяным паром он переходит в клей. Чистый костяной клей называется желатиной. Особенно чистая желатина получается из рыбьего пузыря кипячением с водой.
Типичная молекула коллагена состоит из трех полипептидных целей разных типов (α-спиралей), скрученных в виде правойтройной спирали. Полипептидные цепи построены из часто повторяющихся фрагментов, имеющих характерную последовательность: -Gly-X-Y-.Каждым третьим аминокислотным остатком является глицин. Часто встречаются остатки пролина и 4-гидроксипролина. Молекула коллагена содержит остатки З-гидроксипролина и 5-гидроксилизина. Присутствие в полипептидной цепи остатков гидроксиаминокислот является характерной особенностью коллагена. На одном из концов молекула коллагена сшита поперечными связями, образованными боковыми цепями остатков лизина. Количество поперечных связей возрастает по мере старения организма. Известны 12 вариантов коллагена, характеризующихся различным сочетанием полипептидных α-цепей. Молекулы коллагенов обладают свойством спонтанно агрегировать с образованием более сложных структур, микрофибрилл и фибрилл. Большинство коллагенов образуют фибриллы цилиндрической формы диаметром 20-500 нм с характерными поперечными полосами, повторяющимися через каждые 64-67 нм.
Эластин – основной белковый компонент, из которого состоят эластические волокна. Общим для коллагена и эластина является большое количество пролина и глицина, небольшое – метионина, отсутствие триптофана и цистеина. В отличие от коллагена в эластине много валина и аланина и меньше глутаминовой кислоты и аргинина. В целом, эластин характеризуется слишком малым количеством полярных аминокислотных остатков. Эластин входит в состав жил и других эластичных веществ соединительной ткани. Нити сырого шелка состоят из белкового вещества (фиброина), покрытого другим белковым веществом, играющим роль шелкового клея (серицином). При кипячении с водой шелк освобождается от клея, который при этом переходит в раствор.
Кератин является главной составной частью волос, рогов, копыт, ногтей, перьев и верхнего слоя кожи. Скорлупа куриного яйца состоит из извести и кератина. Если растворить известь скорлупы яйца в кислоте, останется мягкая кожа, состоящая из кератина; из кератина состоит кожица, которая следует за скорлупой яйца. По химическому составу кератин богат серой.
Глобулярные белки
Альбумины растворимы в воде, свёртываются при нагревании, нейтральны, сравнительно трудно осаждаются растворами солей. Примерами их могут служить альбумин белка куриного яйца, альбумин кровяной сыворотки, альбумин мышечной ткани, молочный альбумин. Поддерживают онкотическое давление плазмы крови, выполняют транспортные функции.
Глобулины нерастворимы в воде, но растворяются в очень слабых растворах солей. Более концентрированными растворами солей они вновь осаждаются; осаждение происходит при меньшей концентрации, чем та, которая необходима для осаждения альбуминов. Эти белки являются очень слабыми кислотами. Примерами глобулинов могут служить: фибриноген, глобулин кровяной сыворотки, глобулин мышечной ткани, глобулин белка куриного яйца. Выполняют транспортную и защитную функцию.
Гистоны ‒ белки основного характера. Находятся в составе нуклеопротеинов. В их состав входят лизин и аргинин, содержание которых не превышает 20-30%. Играют важную роль в регуляции экспрессии генов.
Протамины не содержат серы, обладают сравнительно сильными основными свойствами, обусловленными наличием в их составе аргинина (60-85%). Протамины хорошо растворимы в воде, изоэлектрическая точка их лежит в щелочной среде, образуют кристаллические соли, содержатся (в виде нуклеопротеинов) в сперматозоидах рыб. Имеют небольшую молекулярную массу (до 5000).
Проламины и глютелины находятся в зернах различных хлебных злаков. Растворяются в 80%-ном этиловом спирте, в то время как остальные белки в этих условиях выпадают в осадок. Представителем этих белков может служить глиадин, составляющий главную часть клейковины.
Сложные белки
Сложные белки – белки, содержащие прочно связанную небелковую часть молекулы, называемую простетической группой. В зависимости от природы простетической группы сложные белки подразделяются на ряд классов:
1) липопротеины (хиломикроны, липопротеины разной плотности);
2) гликопротеины (содержат остатки сахаров, масса белковой части превышает массу углеводной части);
3) протеогликаны (полисахариды, содержащие полипептидные участки);
4) фосфопротеины (казеин);
5) металлопротеины (ферритин);
6) хромопротеины (гемоглобин, цитохромы, миоглобин);
7) нуклеопротеины.
Липопротеины
Представляют собой комплекс белков с жирами (рис.8.1). Разные фракции липопротеинов в сыворотке осуществляют транспорт жиров в организме. Кроме того, липопротеины могут входить в состав клеточных мембран, внутриклеточных образований, оболочек нервов.
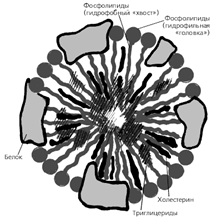
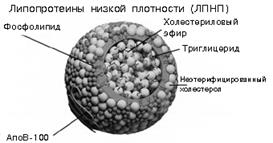
Рис.8.1. Структура липопротеинов низкой плотности
Гликопротеины
В состав гликопротеинов входят углеводные компоненты ‒ гетероолигосахаридные цепи, содержащие от двух до десяти, реже 15 мономерных остатков гексоз (галактоза и манноза, реже глюкоза), пентоз (ксилоза, арабиноза) и конечный углевод, чаще всего представленный N-ацетилгалактозамином, L-фукозой или сиаловой кислотой. В отличие от протеогликанов гликопротеины не содержат уроновых кислот и серной кислоты.
Некоторые белки этой группы встречаются в слизистых соединениях животных организмов и обусловливают свойства этих выделений тянуться в нити даже при сравнительно большом разбавлении. Эти белки образуются в подчелюстной железе (подчелюстная железа ‒ одна из слюнных желез), печени, железах желудка и кишечника. Другие гликопротеины находятся в хрящах, яичном белке, стекловидном теле глаза и т.д. К типичным гликопротеинам относят большинство белковых гормонов, мембранные сложные белки, все антитела (иммуноглобулины), белки плазмы крови, молока, овальбумин, интерфероны, факторы комплемента, группы крови, рецепторные белки и др.
Гликопротеины выполняют специфические функции: обеспечивают клеточную адгезию, молекулярное и клеточное узнавание, антигенную активность опухолевых клеток, оказывают защитное и гормональное, а также антивирусное действие (рис.8.2).
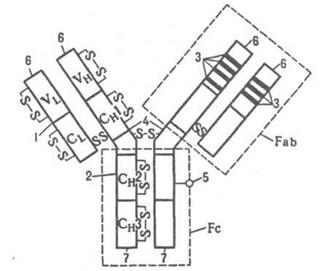
Рис.8.2. Гликопротеин (иммуноглобулин М)
Протеогликаны
Протеогликаны состоят из белка и гликозаминогликанов. Наибольшее количество протеогликанов содержится в соединительной ткани животных, где эти вещества, в первую очередь, протеохондроитинсульфаты и протеодерматансульфаты, в комплексе с гиалуроновой кислотой, коллагеном и некоторыми другими белками обеспечивают необходимые физико-механические свойства таких образований, как кости, сухожилия, хрящи, межпозвоночные диски, кожа, стенки кровеносных сосудов, роговица, стекловидное тело глаза и др.
Протеогепарансульфаты – компоненты клеточной поверхности во многих типах тканей и участвуют в обеспечении специфической клеточной адгезии и защите клеток от повреждения при инфекциях (рис.8.3). Протеогепарин синтезируется и накапливается в специализированных («тучных») клетках, продукты его ферментативного расщепления являются природными регуляторами процесса свертывания крови (антикоагулянтами). Нарушения биосинтеза или катаболизма протеогликанов вызывают ряд тяжелых заболеваний (нарушение зрения и функций костно-суставного аппарата, воспалительные артриты, атеросклероз и др.).
Рис.8.3. Схематическое изображение структур протеогликанов: 1 − протеогликан хряща, 2 − протеогепарин; 3 − протеодерматансульфат с олигосахаридами муцинового типа, 4 − протеохондроитинсульфат или протеодерматансульфат небольшой молекулярной массы, 5 ‒ протеокератансульфат роговицы; 6 ‒ протеогепарансульфат клеточной поверхности
Фосфопротеины
Содержат в своем составе фосфор, имеют определенно выраженный кислотный характер. Главным представителем фосфопротеинов является казеин молока. Он обладает настолько ясно выраженным кислотным характером, что разлагает углекислые соли с выделением углекислого газа. Казеин растворяется в слабых растворах щелочей, образуя с ними соли. Соли казеина называются казеинатами. При нагревании казеин не свертывается. При действии кислот на соли казеина он выделяется в свободном виде. Этим объясняется свертывание молока при прокисании. Казеин содержит фосфор в виде сложного эфира фосфорной кислоты. Вителлин находится в желтке куриного яйца.
Металлопротеины
В своем составе сдержат ионы одного или нескольких металлов. Выполняют функцию транспорта и хранения металлов в организме (например, ферритин, в отличие от гемоглобина, участвует в транспорте и депонировании железа в организме). К металлопротеинам относится и ряд ферментов. Например, супероксиддисмутаза − Сu,Zn-СОД, в которой Zn выполняет структурную функцию, Cu – каталитическую.
Нуклеопротеины
Находятся в клеточных ядрах. Выполняют структурную и регуляторную функции. При осторожном гидролизе они расщепляются на белок и нуклеиновую кислоту (рис.8.4). Нуклеиновые кислоты являются весьма сложными веществами, расщепляющимися при гидролизе на фосфорную кислоту, углеводы и азотосодержащие органические вещества группы пиримидина и группы пурина.
В природе обнаружено 2 типа нуклеопротеинов, отличающихся друг от друга по составу, размерам и физико-химическим свойствам,: дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП).
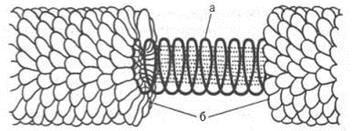
Рис. 8.4. Модель вируса мозаичной болезни табака, а ‒ спираль РНК; б ‒ субъединицы белка
Хромопротеины
Хромопротеины – белки, имеющие в качестве простетической группы окрашенное вещество. Из хромопротеинов наиболее изучены гемоглобин, миоглобин, цитохромы, хлорофилл.
Гемоглобин
Красящее вещество красных кровяных телец ‒ эритроцитов. Гемоглобин представляет собой соединение белка глобина с гемохромогеном (рис.8.5). Гемоглобин, соединяясь с кислородом, превращается в оксигемоглобин, который, отдавая свой кислород другим веществам, снова превращается в гемоглобин. Гемоглобин играет роль переносчика кислорода от легких к тканям. Образовавшийся в легких оксигемоглобин кровью разносится по телу и, отдавая свой кислород, способствует протеканию в организме окислительных процессов. Кроме того, гемоглобин вместе с плазмой крови осуществляет регуляцию величины рН крови и перенос углекислоты в организме.
Характерной особенностью гемоглобина является его способность соединяться с окисью углерода, после чего он теряет способность соединяться с кислородом. Этим объясняется ядовитое действие окиси углерода.
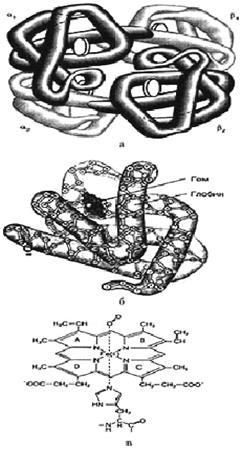
Рис.8.5. Гемоглобин: а – олигомер гемоглобина; б – субъединица гемоглобина; в – структура гема
Вне организма гемоглобин, при действии воздуха, превращается в метгемоглобин, который отличается от оксигемоглобина прочностью связи с кислородом. При обработке ледяной уксусной кислотой метгемоглобин расщепляется с образованием глобина и гематина. При обработке метгемоглобина тем же реактивом, но в присутствии NаСl, получается хлористая соль гематина, называемая гемином. Гемин образует характерные красно-коричневые ромбики, которые позволяют обнаружить открыть присутствие крови в пятнах даже через несколько лет. Гематин очень близок гемохромогену, но все же отличается от него.
Белковая структура гемоглобина более сложна. Гемоглобин млекопитающих (в том числе человека) имеет молекулярную массу 64500 Да и состоит из четырех полипептидных цепей, каждая из которых содержит свой собственный гем. Преобладающая форма гемоглобина у взрослых людей – гемоглобин А – имеет две пары полипептидных цепей (α-цепей, каждая из которых состоит из 141 аминокислотного остатка, и β-цепей – по 146 остатков в каждой). Несмотря на то, что аминокислотные последовательности полипептидных цепей гемоглобина и миоглобина в значительной степени различаются; – трехмерные структуры их сходны и гемы в молекулах того и другого занимают гидрофобные полости внутри свернутых полипептидных цепей.
Четыре полипептидные цепи гемоглобина ассоциированы в тетраэдрическую структуру и образуют сферическую молекулу. Каждая из α-цепей контактирует с двумя β-цепями, в то время как между двумя α-цепями или между двумя β-цепями взаимодействие почти отсутствует. Каждый из четырех гемов гемоглобина способен присоединить одну молекулу кислорода. Кислородсодержащая форма гемоглобина называется оксигемоглобином, а форма, не содержащая кислорода, – дезоксигемоглобином. Когда дезоксигемоглобин поглощает кислород, в его трехмерной структуре происходит ряд изменений, главным образом перемещение атома Fe2+ в плоскость системы колец гема. Как и в случае миоглобина, окисление Fe2+ до Fe3+ приводит к образованию неактивной формы гемоглобина ‒ метгемоглобина, который не способен присоединять молекулярный кислород.
Способность обратимо образовывать комплексы с кислородом обусловливает жизненно важную роль гемоглобина как переносчика кислорода у животных. Способность артериальной крови переносить кислород в присутствии гемоглобина в 70 раз выше, чем в его отсутствие.
Характерные особенности связывания кислорода гемоглобином:
1) кривая связывания ‒ освобождения кислорода гемоглобином имеет сигмоидную форму, что свидетельствует о том, что связывание кислорода гемом ‒ кооперативный процесс, т.е. связывание кислорода одним гемом облегчает его связывание другими генами;
2) сродство гемоглобина к кислороду зависит от величины рН и содержания СО2;
3) органические фосфаты, особенно 2,3-дифосфоглицерат (2,3-ДФГ), также оказывают влияние на сродство гемоглобина к кислороду.
Аллостерические свойства гемоглобина обусловлены взаимодействием четырех субъединиц его молекулы. При связывании кислорода происходит перемещение атома железа гема в плоскость гема оксигемоглобина, а проксимальный гистидин приближается к кольцу гема. Такое перемещение вызывает последующие небольшие изменения третичной структуры субъединицы, в частности, изменяется положение тирозинового остатка и смежной С-концевой аминокислоты. В результате исчезают некоторые взаимодействия между субъединицами и четвертичная структура дестабилизируется. При этом изменяется конформация других субъединиц, что облегчает связывание ими кислорода. И, наоборот, освобождение кислорода одним из гемов приводит к изменениям конформации и взаимодействия между субъединицами, что облегчает освобождение кислорода другими гемами.
С понижением значения рН освобождение О2 гемоглобином упрощается. То же самое происходит при повышении концентрации СО2. Это важно с физиологической точки зрения, т.к. в тканях с быстро протекающим обменом веществ образуется много СО2 и кислот. Высокие уровни СО2 и Н+ стимулируют освобождение О2 из гемоглобина, и таким образом удовлетворяется потребность в большом количестве кислорода. После освобождения кислорода дезоксигемоглобин присоединяет Н+ и СО2. Для альвеолярных капилляров легких характерна высокая концентрация кислорода, и там по мере связывания кислорода дезоксигемоглобином происходит освобождение Н+ и СО2.
Структурные превращения, которые претерпевает молекула гемоглобина, были подробно изучены. При переходе от оксигемоглобина к дезоксигемоглобину в результате конформационных изменений карбоксилсодержащие аминокислотные остатки приближаются к некоторым гистидиновым остаткам и концевым NH2-группам. С изменением локального заряда микроокружения повышается величина рК кислого остатка и таким образом возрастает его сродство к НСО3-, которая значительно легче связывается с дезоксигемоглобином, чем с оксигемоглобином. Она связывается с концевой NH2-группой каждой цепи с образованием карбаминопроизводных.
У человека 2,3-дифосфоглицерат снижает сродство гемоглобина к кислороду в 26 раз. Это важно с физиологической точки зрения, поскольку в отсутствие этого механизма гемоглобину было бы трудно освобождать много кислорода в капиллярах тканей. Такое действие 2,3-дифосфоглицерата обусловлено его способностью связываться с дезоксигемоглобином, а не с оксигемоглобином. 2,3-ДФГ связывается с гемоглобиновым тетрамером, располагаясь в центральном пространстве, в непосредственной близости от всех четырех субъединиц. Связывание 2,3-дифосфоглицерата и О2 – взаимоисключающие процессы. В ходе оксигенации конформационные изменения приводят к значительному уменьшению центрального пространства в гемоглобиновом тетрамере и молекула 2,3-дифосфоглицерата вытесняется. При этом необходимо нарушение 2,3-дифосфоглицерат-белкового взаимодействия, что затрудняет связывание кислорода гемоглобином. Для поглощения 2,3-дифосфоглицерата требуется расщепление связи гемоглобин-О2, так что 2,3-дифосфоглицерат упрощает высвобождение кислорода.
Сродство гемоглобина к окиси углерода больше, чем к кислороду; следовательно, СО может вытеснять кислород из оксигемоглобина. Образующийся карбоксигемоглобин не способен служить переносчиком кислорода, и поэтому окись углерода является весьма эффективным ядом. Карбоксигемоглобин имеет вишневокрасную окраску, характерную для цвета лица людей, отравившихся окисью углерода, что позволяет легко диагностировать отравление. Функционирование гемоглобина могут серьезно нарушать различные лекарственные препараты. Продукты метаболизма ацетанилида, фенацетина и некоторых других индуцируют окисление гемоглобина до Fе3+-формы, приводя к серьезному снижению кислородпереносящей способности крови.
Так же, как и у большинства других животных, у человека на разных стадиях развития организма имеются различные типы гемоглобина в крови. Гемоглобин плода и гемоглобин взрослого человека различаются по спектрам поглощения света и электрофоретическим свойствам. В крови зародыша на ранних стадиях его развития присутствует гемоглобин третьего типа. Зародышевый гемоглобин F обладает более высоким сродством к кислороду, чем гемоглобин А взрослых людей. Благодаря этому возможен оптимальный перенос кислорода от гемоглобина А матери к гемоглобину F плода. Более высокое сродство гемоглобина F к кислороду подтверждается также тем, что он связывает 2,3-дифосфоглицерат менее прочно, чем гемоглобин А.
Существует много генетических вариаций человеческого гемоглобина. Наиболее известная из них найдена при «серповидно-клеточной анемии» – мутации одного гена, которая в гомозиготном состоянии вызывает деформацию эритроцитов с образованием клеток, имеющих форму серпа. Гемоглобин S серповидных клеток отличается от нормального гемоглобина одним аминокислотным остатком в β-цепях. В нем происходит замена полярной глутаминовой кислоты на неполярную аминокислоту валин, что приводит к очень сильному снижению растворимости дезоксигемоглобина S, хотя растворимость оксигемоглобина при этом остается нормальной. Дезоксигемоглобин S образует волокнистый осадок, который вызывает деформацию и разрушение эритроцитов и, как следствие, – хроническую гемолитическую анемию.
В настоящее время известны более 100 мутантных гемоглобинов. Некоторые из замен являются безвредными «поверхностными» заменами, тогда как другие, затрагивающие кислородсвязывающие участки, третичную структуру или взаимодействия субъединиц в четвертичной структуре (что сказывается на аллостерических эффектах), могут очень сильно влиять на связывание кислорода.
Миоглобин
Второй важный белок (миоглобин), транспортирующий кислород и углекислый газ находится непосредственно в клетках. Миоглобин – небольшой глобулярный белок (молекулярная масса 16500 Да); молекула его состоит из одной полипептидной цкпи (153 аминокислотных остатка) и одного гема (рис.8.6). Сродство к кислороду у миоглобина значительно больше, чем у гемоглобина, поэтому миоглобин может принимать кислород от гемоглобина для использования или сохранения его в мышечных клетках. Подобно гемоглобину он образует оксимиоглобин, карбокси- и метмиоглобин.
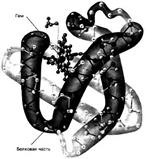
Рис.8.6. Миоглобин
