Патологическая чувствительность к дитилину
Дитилин - миорелаксант. Используется для расслабления гладкой мускулатуры (в хирургии - при интубации трахеи, бронхоскопии и др.), а также в зоологии (при вскрытии червей) и т.п.
С химической точки зрения дитилин - диацетилхолин, может рассматриваться как удвоенная молекула ацетилхолина. Фермент сывороточная холинэстераза расщепляет дитилин (разрушает сложноэфирную связь, дитилин расщепляется на холин и янтарную кислоту) и делает его неактивным за 1-2 минуты у людей с нормальным (непатологическим) генотипом. Препарат оказывает быстрое и кратковременное действие, кумулятивным эффектом не обладает.
Полиморфная система по локусу, контролирующему синтез сывороточной холинэстеразы.
Известно три аллеля гена сыворототочной холинэстеразы (Е - ез^егаза). Еи -нормальный аллель дикого типа. Мутантные аллели -
Аллель Е - контролирует синтез фермента с нормальной активностью.
Аллели Е, Е - мутантные аллели, обусловливающие синтез фермента с пониженной активностью.
 нормальные генотипы (нормальная активность фермента)
нормальные генотипы (нормальная активность фермента)
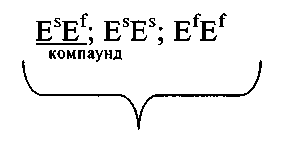
эти генотипы характеризуется пониженной активностью холинэстеразы (дефектный, аномальный фермент).
Аномальная холинэстераза не инактивирует дитилин, применяющийся в хирургии как мышечный релаксант, поэтому у обладателей такого фермента наблюдается длительная остановка дыхания (в течение 1 часа).
При этих генотипах (EsEf: ESES; EfEf) наблюдается повышенная чувствительность к дитилину —> при операции с использованием дитилина человек может умереть от удушья (если не применять искусственную вентиляцию легких).
У гомо- и гетерозигот по аллелям Es, Ef дитилин инактивируется медленно (в течение 1 часа).
Частота встречаемости мутантных аллелей в Европе - 1:3500.
Полиморфная система по локусу PI, контролирующему синтез а-антитрипсина — белка сыворотки, которой служит ингибитором протеаз.
Идентифицировано 23 разных аллеля этого гена —> 23 фенотипа этого белка. Локус PI (proteasa ingibitor) - полиморфный.
PIn - определяет нормальную активность белка а-антитрипсина.
Рlс, pls , Рlz - определяют пониженную активность белка а-антитрипсина.
Трипсин - фермент, расщепляющий белки. Антитрипсин - антагонист трипсина, ингибитор протеаз. При воздействии пыли увеличивается количество белков соединительной ткани легких (стромы легких). В норме трипсин расщепляет эти белки, а а-антитрипсин снижает его активность (это сбалансированные процессы). При пониженной активности а-антитрипсина трипсин активно расщепляет белки —> строма легких истончается, что приводит к развитию эмфиземы легких. Гипоксия приводит к дистрофическим изменениям в ткани легких —> истончение соединительной ткани —>• переполнение альвеол воздухом —> эмфизема легких.
Вывод. Индивидуумы с наследственной недостаточностью
а-антитрипсина склонны к развитию эмфиземы легких при длительном воздействии пылевых частиц и других атмосферных загрязнений.
Среди гомозигот PIZ PIZ эмфизема легких встречаемости в 30 раз чаще, чем в общей популяции. Частота встречаемости гомозигот у европейцев 0,05%.
Частота встречаемости гетерозигот в некоторых популяциях достигает 2-4%.
