Ферменты, их роль в процессах жизнедеятельности
Химическая организация клетки.
1. Содержание химических элементов в клетке.
2. Вода и другие неорганические вещества, их роль в жизнедеятельности клетки.
3. Органические вещества:
3.1 Углеводы, липиды. Строение и функции.
3.2 Белки. Строение и функции. Ферменты, их роль в процессе жизнедеятельности.
3.3 Нуклеиновые кислоты. Строение и функции ДНК и РНК. Редупликация ДНК. АТФ. Строение и функции. Значение АТФ в жизнедеятельности клетки.
Клетки сходны не только по строению, но и по химическому составу. Это свидетельствует о единстве их происхождения.
В клетках обнаружено около 70 элементов периодической системы Д.И. Менделеева, причем 24 из них являются обязательными и постоянно встречаются в живых организмах.
В соответствии с процентным содержанием в клетке химические элементы можно разделить на 3 группы: макроэлементы, микроэлементы и ультрамикроэлементы.
Макроэлементы составляют основную массу вещества клетки. На их долю приходится около 99 % всей массы клетки. Особенно высока концентрация четырех элементов: кислорода, углерода, азота и водорода ( 98% всех макроэлементов). К макроэлементам относят также элементы, содержание которых в клетке исчисляется десятыми и сотыми долями процента. Это, например, такие элементы, как калий, магний, натрий, кальций, железо, сера, фосфор, хлор. Каждый из этих элементов выполняет важную функцию в клетке. Кальций и фосфор участвуют в формировании костной ткани, определяя прочность кости. Железо входит в состав гемоглобина - белка эритроцитов, участвующего в переносе кислорода от легких к тканям.
Микроэлементы. К ним относятся преимущественно ионы тяжелых металлов, входящие в состав ферментов, гормонов и других жизненно важных веществ. В организме эти элементы содержатся в очень небольших количествах: от 10-3 % до 10-7 %; в числе таких элементов бор, кобальт, медь, молибден, цинк, ванадий, йод, бром и др. Они также важны для организма. Цинк, например, входит в молекулу гормона поджелудочной железы - инсулина, йод является необходимым компонентом тироксина - гормона щитовидной железы. Недостаточное содержание фтора приводит к поражению зубов кариесом.
Ультрамикроэлементы. Концентрация их не превышает 10-7 % -10-12 %
Физиологическая роль большинства этих элементов в организмах растений, животных и клетках бактерий пока не установлена. К ним относится уран, радий, золото, ртуть, бериллий, цезий, селен и другие редкие элементы.
Все перечисленные химические элементы участвуют в построении организма либо в виде ионов, либо в составе тех или иных соединений - молекул неорганических и органических веществ. Напр., углерод, водород и кислород входят в состав углеводов и жиров. В составе белков к ним добавляются азот и сера, в составе нуклеиновых кислот - азот и фосфор.
Все имеющиеся в клетке соединения можно разбить на две группы - неорганические и органические. К неорганическим соединениям относятся вода и минеральные соли, а к органическим - соединения углерода с молекулярной массой от 100 до нескольких сот тысяч (углеводы, липиды, белки, нуклеиновые кислоты и др.). Органические соединения характерны только для живых организмов, тогда как неорганические существуют и в неживой природе.
Неорганические вещества.
Вода. В количественном отношении первое место среди химических соединений любой клетки занимает вода. Ее содержание колеблется в зависимости от вида организма, условий его местообитания, типа клеток и их функционального состояния. Так в быстрорастущих клетках эмбрионов человека и животных содержится около 95% воды. В клетках костной ткани содержится не более 20%, жировой ткани - около 40%, мышечной ткани-76% воды. С возрастом количество воды в клетках любого организма заметно снижается. В клетках молодого организма воды до 80%, а к старости количество ее снижается до 60%.
Наличие воды - обязательное условие жизненной активности клетки. Она составляет основную часть цитоплазмы. Смерть в результате лишения воды наступает раньше, чем от отсутствия пищи. У растений вода поступает в клетку из окружающей среды, а у животных образуется непосредственно в клетке при расщеплении жиров, белков, углеводов и поступает из окружающей среды.
Роль воды в клетки определяется ее химическими и структурными свойствами. Эти свойства связаны с малыми размерами молекул, их полярностью и способностью соединяться друг с другом водородными связями.
Вода находится в клетке в двух формах: свободной и связанной. Свободная вода составляет 95% всей воды в клетке и используется главным образом как растворитель и как дисперсионная среда коллоидной системы протоплазмы. Связанная вода, на долю которой приходится всего 4-5% всей воды клетки, непрочно соединена с белками водородными и другими связями.
Свойства воды обусловлены ассиметричным строением ее молекулы. Из-за ассиметричного распределения зарядов молекула воды действует как диполь и поэтому может быть связана как с положительно, так и отрицательно заряженными группами белков.
Дипольный характер строения молекул обуславливает способность воды активно вступать во взаимодействие с различными веществами. Ее молекулы вызывают диссоциацию ряда водорастворимых веществ на катионы и анионы. Большинство химических реакций представляют собой взаимодействие растворенных в воде веществ.
Благодаря полярности молекул и способности образовывать водородные связи, за счет которых возникают комплексы нескольких молекул, вода является хорошим растворителем для полярных веществ, называемых гидрофильными. Если энергия притяжения между молекулами вода меньше, чем между молекулами вода и вещества, то оно растворяется в воде и называется гидрофильным ( это минеральные соли, белки, углевода и т.д.), Если энергия притяжения между молекулами вода больше, чем энергия притяжения между молекулами вода и вещества, то это вещество нерастворимо в воде - гидрофобное (неполярные вещества, например углеводорода, гидрофобные).
Свойства воды.
1. Универсальный растворитель, в котором растворяются практически все вещества в природе (одни более, другие менее).Вода, как растворитель принимает участие в явлениях осмоса, играющего важную роль в жизнедеятельности клетки и организма. К числу важных в физиологическом отношении свойств вода относится ее способность растворять газы (О2, С02 и др.).
2. Источник кислорода, выделяемого в световую фазу фотосинтеза.
3. Осмотический регулятор. Например, на явлениях осмоса основаны движения воды по проводящей системе растений и напряжение стенок растительных клеток - тургор. В животных клетках пример с эритроцитами.
4. Среда для физиологических и биохимических процессов. Вода является основной средой, где протекают биохимические реакции. Все реакции гидролиза, а также многочисленные окислительно- восстановительные реакции возможны только при непосредственном участии воды.
5. Теплоемкость. Вода обладает наивысшей удельной теплоемкостью из всех известных жидкостей. Это значит, что существенное увеличение тепловой энергии вызывает сравнительно небольшое повышение ее температуры. Такое явление обусловлено тем, что значительная часть этой энергии расходуется на разрыв водородных связей ограничивающих подвижность молекулы воды. Большая теплоемкость воды защищает ткани растений и животных от быстрого и сильного повышения температуры, тогда как высокая теплота парообразования обеспечивает надежную стабилизацию температуры тела организма.
6. Теплопроводность. Вода обладает также высокой теплопроводностью что обеспечивает равномерное распределение тепла по всему организму. Это предохраняет протоплазму клеток от резких изменений температуры, что могло бы послужить причиной повреждения элементов клетки.
Следовательно, высокая удельная теплоемкость и высокая для жидкости теплопроводность делают воду идеальной средой для поддержания оптимального режима организма.
Минеральные вещества. В клетках живых организмов присутствует широкий набор неорганических элементов, которые участвуют во многих обменных процессах, а также в построении ряда тканей. Минеральные соли в определенных концентрациях необходимы для нормальной жизнедеятельности клеток. Так, азот и сера входят в состав белков, фосфор - в состав ДНК, РНК и АТФ, магний - в состав многих ферментов и хлорофилла, железо - в состав гемоглобина, цинк - в состав гормона поджелудочной железы, йод - в состав гормонов щитовидной железы и т.д.
Подавляющая часть неорганических веществ клетки находится в видесолей - либо диссоциированных на ионы, либо в нерастворенном состоянии.
Первые (катионы и анионы) обеспечивают устойчивое количество необходимых химических элементов и осмотическое давление. Из катионов важны K+, Na+, Ca2+, Мg2+, а из анионов Н2РО4-, Сl- и НСО3-.
Присутствие в клетке катионов К+, Na+, Са2+, Mg2+, обеспечивает такое важнейшее свойство живых организмов, как проведение возбуждений и импульсов. При отсутствии или недостатке данных катионов клетка утрачивает возбудимость и погибает. Ионы кальция принимают участие в свертывании крови.
Концентрация различных ионов неодинакова в клетке и окружающей среде. Так, концентрация ионов калия очень высока внутри клетки, а ионов натрия всегда во много раз выше во внеклеточной среде. Напротив, в окружающей среде очень мало ионов калия (К+) и достаточно высока концентрация ионов натрия ( Na+). Пока клетка жива, эти различия в концентрации К+ и Na+ между клеткой и межклеточной средой стойко удерживаются. После смерти клетки содержание в ней быстро уравнивается. От концентрации солей внутри клетки зависят буферные свойства цитоплазмы.
Буферностью называют способность клетки сохранять определенную концентрацию водородных ионов ( рН ).
Анионы слабых кислот и слабые щелочи связывают ионы водорода (Н+) и гидроксила (ОН-), вследствие чего в клетках и межклеточной жидкости на постоянном уровне поддерживается слабощелочная реакция. В клетке поддерживается слабощелочная реакция (рН 7,36). рН крови является важнейшей физиологической характеристикой, поддержание которой является составной частью гомеостаза.
Имеющиеся в организме нерастворимые минеральные соли, например, фосфат кальция, входят в состав межклеточного вещества костной ткани, в раковины моллюсков, обеспечивая прочность их образования, образуют кристаллы в клетках растений.
Органические вещества.
В составе клеток содержится множество органических соединений. В различные типы клеток входит неодинаковое количество тех или иных органических соединений. Например, в растительных клетках преобладают сложные углеводы - полисахариды; в животных - больше белков и жиров. Тем не менее каждая группа органических веществ в любом типе клеток выполняет сходные функции.
Рассмотрим наиболее важные группы, которые определяют основные свойства клетки и организма. Это такие органические вещества, как белки, углеводы, липиды, нуклеиновые кислоты, отдельные нуклеотиды, в частности АТФ.
Биополимеры. Биологические полимеры (биополимеры) или макромолекулы - это высокомолекулярные органические соединения, молекулы которых состоят из большого числа повторяющихся звеньев -мономеров. К биополимерам относятся белки, нуклеиновые кислоты, полисахариды и их производные (крахмал, гликоген, целлюлоза, хитин и др.). Мономерами для них служат соответственно аминокислоты, нуклеотиды и моносахариды.
По форме биополимеры - это линейные (белки, нуклеиновые кислоты) либо ветвящиеся ( гликоген ) цепи. Благодаря такой структуре они характеризуются рядом замечательных свойств.
Белки.
Белки или протеины (от греч.ргоtos - первый, главный) это сложные органические соединения (биополимеры), состоящие из углерода, водорода, кислорода и азота (иногда серы), мономерами которых являются аминокислоты.
Белки содержат в среднем 53% углерода, 22% кислорода, 7% водорода, 16% азота, 2% серы. Кроме того в их состав могут входить фосфор, железо, магний и др.
Среди органических веществ клетки белки занимают первое место как по количеству, так и по значению. Белки составляют 50-80 % от сухой массы клетки. Белки входят в состав всех клеток, клеточных органоидов и межклеточных жидкостей. Токсины бактерий, яды змей и членистоногих, антитела, ферменты и гормоны также являются белками.
В 1871г.русский химик Н.Н. Любавин установил, что белки состоят из аминокислот.
Аминокислоты - это низкомолекулярные органические соединения, в состав которых входят одна или две аминогруппы (-NH2), обладающие основными свойствами и одна или две карбоксильные группы (-СООН), обладающие свойствами кислот. Соединения, которые одновременно могут вести себя как кислоты и основания, называются амфотерными. Этим объясняются амфотерные свойства аминокислот, благодаря чему в клетке они образуют буферный раствор и играют роль буферных систем. Участки молекул, лежащие вне амино- и карбоксильной групп называют радикалами (R). У различных аминокислот радикалы имеют различное строение. В состав радикала могут входить различные группы: гидроксильная (ОН), сульфгидрильная (SH) и др. Аминокислоты различаются именно радикалами.
Общая формула аминокислоты:
R
I
Н2N-CH-COOH
В клетке находятся свободные аминокислоты, составляющие аминокислотный фонд, за счет которого происходит синтез новых белков. Этот фонд пополняется аминокислотами, постоянно поступающими в клетку вследствие расщепления пищеварительными ферментами пищи или собственных запасов белков.
В настоящее время известны свыше 150 аминокислот. Подавляющее большинство аминокислот находится в организмах в свободном виде, но только 20 из них входят в состав белков. Эти аминокислоты получили название белковых или протеиногенных (образующих протеины, т.е. белки). Им присуще одно важнейшее свойство - способность при участии ферментов соединяться по аминным и карбоксильных группам и образовывать цепи.
У растений все необходимые аминокислоты синтезируются из С02, воды и аммиака. Однако человек и многие животные утратили способность синтезировать ряд протеиновых аминокислот, которые стали для них незаменимыми в питании: они обязательно должны поступать с пищей. Недостаточное содержание этих аминокислот в пище человека и рационе животных приводит к нарушению биосинтеза белка, замедлению роста и развития организма, к различным заболеваниям.
Молекулы белков имеют вид длинных цепей, которые состоят из 50 - 1500 аминокислот, соединенных прочной пептидной связью. Соединение аминокислот происходит через общие для них группировки: аминогруппа одной аминокислоты взаимодействует с карбоксильной группой другой аминокислоты и выделяется молекула воды. Между соединившимися аминокислотами возникает связь называемая пептидной (-CO-NH-).
Соединение, полученное из 2-х аминокислот называется дипептидом, из большего числа - полипептидом. В результате образуется полипептидная цепочка - первичная структура белка.
По строению белки делятся на простые и сложные. В состав простых белков входят только аминокислоты, а сложные белки кроме аминокислот могут включать нуклеиновые кислоты (нуклеопротеины), липиды (липопротеины), углеводы (гликопротеины) и др.
Все химические, морфологические и функциональные свойства клеток зависят от содержания в них специфических белков. Специфичность белков определяется набором аминокислот, их количеством и последовательностью расположения в полипептидной цепи. Замена одной единственной аминокислоты в составе молекулы белка или изменение последовательности их расположения, как правило, приводят к изменению его функции. Так, в гемоглобине имеются молекулы белков, построенные из 300 мономерных аминокислот, но достаточно замены одной из них - глутаминовой кислоты - валином, чтобы свойства гемоглобина резко изменились. Люди с таким аномальным гемоглобином страдают заболеванием - серповидноклеточной анемией.
Биологическая активность обусловлена их необыкновенно гибкой, пластичной и в то же время строго упорядоченной структурой.
В строении белков различают следующие уровни организации: первичная, вторичная, третичная и четвертичная.
Первичная структура - полипептидная цепь из аминокислот, связанных в определенной последовательности ковалентными (прочными) пептидными связями.
Вторичная структура представляет полипептидную цепь, закрученную в виде спирали. Витки спирали удерживаются водородными связями, которые образуются между СО- и NH- группами, расположенными на соседних витках. Водородные связи слабее ковалентных, но, многократно повторенные, создают довольно прочное соединение. Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков (коллаген, фибриноген, миозин, актин и др.).
Третичная структура. Многие белковые молекулы становятся функционально активными только после приобретения третичной (глобулярной) структуры. Она формируется путем многократного сворачивания спирали в трехмерное образование - глобулу. Третичная структура образуется благодаря SH группам, двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи, за счет взаимодействия между собой они образуют слабые дисульфидные связи (-S-S-). Благодаря другим, более слабым связям (гидрофобным) белковая спираль сворачивается и приобретает форму шарика или глобулы. Эту структуру имеют большинство белков (альбумины, глобулины).
Четвертичная структура. Для некоторых функций организма требуется участие белков с еще более высоким уровнем организации. Эти белки приобретают четвертичную структуру, которая представляет объединение в единую структуру нескольких (двух, трех и более) молекул с третичной организацией. Например, сложная молекула гемоглобина состоит из четырех макромолекул глобинов, каждая из которых соединена с небелковой частью - гемом (железосодержащим). В результате их объединения образуется функционирующая молекула гемоглобина. В четвертичной структуре белковые субъединицы химически не связаны друг с другом, однако вся структура достаточно прочна за счет действия слабых межмолекулярных сил.
Денатурация белка. Чем выше уровень организации белка, тем слабее поддерживающие его связи. Наиболее устойчива - первичная структура белков, а остальные легко разрушаются.
Утрата белковой молекулой своей структурной организации называется денатурацией. Причиной ее могут быть различные химические (кислоты, щелочи, спирт, соли тяжелых металлов и др.) и физические (высокая температура и давление, ионизирующие излучения и др.) факторы. Вначале разрушается очень слабая четвертичная, затем третичная, вторичная, а при более жестких условиях и первичная структура Если под действием денатурирующего фактора не затрагивается первичная структура, то при возвращение белковых молекул в нормальные условия среды их структура полностью восстанавливается, т.е. происходит ренатурация. Это свойство белковых молекул широко используется в медицине для приготовления вакцин и сывороток и в пищевой промышленности для получения пищевых концентратов. При необратимой денатурации ( разрушении первичной структуры ) белки теряют свои свойства.
Белки выполняют следующие функции:
Структурная (строительная). Белки входят в состав всех клеточных мембран и органелл клетки. Стенки кровеносных сосудов, хрящи, сухожилия у высших животных также состоят из белка.
Двигательная функция белков состоит в том, что все виды двигательных реакций клеток и организмов обеспечиваются специальными белками - актином и миозином. Они содержатся во всех мышцах, ресничках и жгутиках. Их нити сокращаются с использованием энергии АТФ.
Транспортнаяфункция белков заключается в переносе веществ, например кислорода (гемоглобин).
Защитная функция белков связана с выработкой лейкоцитами особых белковых веществ - антител в ответ на проникновение в организм чужеродных белков или микроорганизмов. Антитела связывают, нейтрализуют и разрушают не свойственные организму соединения. Примером защитной функции белков может служить превращение фибриногена в фибрин при свертывании крови.
Сигнальная функция. В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды. Так происходит прием сигналов из внешней среды и передача команд в клетку.
Регуляторнаяфункция свойственна белкам - гормонам, которые оказывают влияние на обмен веществ. Гормоны поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах. Одним из наиболее известных белков-гормонов является инсулин, который снижает содержание сахара в крови.
Каталитическую (ферментативную) функцию выполняют белки-ферменты, в десятки и сотни тысяч раз ускоряющие течение биохимических реакций в клетках при нормальном давлении и температуре около 37°С. Каждый фермент может катализировать только одну реакцию, т.е. действие ферментов специфично. Некоторые ферменты применяются в медицинской практике и пищевой промышленности.
Энергетическая функция. Белки служат также энергетическим материалом или источником энергии. При расщеплении 1г. белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.
Ферменты, их роль в процессах жизнедеятельности
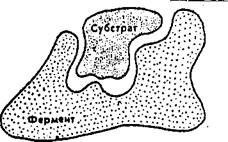
Большая часть химических реакций, протекающих в организме, регулируется ферментами, т.е. белковыми молекулами, выполняющими функцию катализаторов. Катализатором называют вещество, ускоряющее химическую реакцию, которая без него протекает медленно. Сам катализатор во время этой реакции стойких изменений не претерпевает.
Ферменты высокоспецифичны в том смысле, что каждый из них катализирует только те реакции, в которых участвуют молекулы только какого-нибудь одного или нескольких видов. Причина этого в том, что ферменты связываются со своими субстратами, т.е. теми веществами, на которые они действуют. У фермента имеется активный центр. Форма и химическое строение этого активного центра таковы, что с ним могут связываться только определенные субстраты. Катализируя реакцию, фермент тесно сближает молекулы своих субстратов, так что те части молекул, которым предстоит прореагировать, оказываются друг подле друга. Субстрат, присоединившись к ферменту, несколько изменяется. Фермент может, например, притягивать электроны, вследствие чего в некоторых связях молекулы субстрата будет возникать напряжение. Это, в свою очередь, может повышать реакционную способность молекулы.
Предполагается, что именно таким путем фермент и ускоряет реакцию. Активность ферментов находится в прямой зависимости от многих факторов:
Температура. С повышением температуры сверх оптимума ферментативная активность снижается. При температуре 60— 60°С большинство ферментов инактивируется. Очевидно, что в основе инактивации ферментов лежит денатурация белковой молекулы, которая при высоких температурах становится необратимой. Существует ряд ферментов, переносящих высокую температуру. Рибонуклеаза сохраняет активность при температуре 80°С.
При понижении температуры ферменты замедляют свою деятельность, однако необратимая инактивация не наступает.
Кислотность. Важным фактором, действующим непосредственно на фермент, служит кислотность среды (рН). Для каждого фермента характерен свой оптимум рН, при котором проявляется его максимальная активность. Так, фермент пепсин активен только в очень кислой среде рН 2, трипсин же, наоборот, активен в щелочной среде. Большинство ферментов проявляет оптимальную активность в нейтральной среде. Изменение рН среды в ту или иную сторону может привести к необратимой инактивации ферментов.
Активность фермента зависит и от количества (концентрации) молекул субстрата, самих ферментов и коферментов (витаминов и других веществ).