Мазок с конъюнктивы берут стерильным тампоном и помещают в ВТС, после чего проводят центрифугирование взятого материала и его замораживание
Лабораторная диагностика вирусных инфекций
Этиологическая диагностика вирусных заболеваний проводится вирусологическим, вирусоскопическим, серологическим и молекулярно-генетическим методами. Три последних метода могут быть использованы как экспресс-диагностические.
Вирусологический метод диагностики.
Конечной целью метода является идентификация вирусов до вида или серологического варианта. Вирусологический метод включает несколько этапов: 1) отбор материала для исследования; 2) обработку вируссодержащего материала; 3) заражение материалом чувствительных живых систем; 4) индикацию вирусов в живых системах; 5) титрование выделенных вирусов; 6) идентификацию вирусов в иммунных реакциях.
1. Отбор материала для исследования. Проводится в ранние сроки заболевания при соблюдении правил, предотвращающих контаминацию материала посторонней микрофлорой и инфицирование медицинского персонала. Для предупреждения инактивации вирусов при транспортировке материала, он помещается в вирусную транспортировочную среду (ВТС), состоящую из сбалансированного солевого раствора, антибиотиков и сывороточного альбумина. Транспортируется материал в специальном контейнере с термоизоляцией и закрытыми пластиковыми пакетами, содержащими лед. При необходимости материал хранят при -20˚С. Каждый образец материала для исследования должен иметь маркировку и этикетку с указанием фамилии больного, типа материала, даты его забора, развернутый клинический диагноз и другие сведения.
В зависимости от характера заболевания, материалом для исследования могут быть: 1) смывы с носовой части глотки и мазок из глотки; 2) спинномозговая жидкость; 3) кал и ректальные мазки; 4) кровь; 5) моча; 6) жидкость из серозных полостей; 7) мазок с конъюнктивы; 8) содержимое везикул; 8) секционный материал.
Для получения смыва из ротоглотки используют 15-20 мл ВТС. Больной тщательно в течение 1 минуты полощет горло ВТС и собирает смыв в стерильный флакон.
Мазок с задней стенки глотки берут стерильным ватным тампоном, надавливая на корень языка шпателем. Тампон помещают в 2-3 мл ВТС, ополаскивают и отжимают.
Спинномозговую жидкость получают при спинномозговой пункции. 1-2 мл спинномозговой жидкости помещают в стерильную посуду и доставляют в лабораторию.
Пробы кала отбирают в течение 2-3 дней в стерильные флаконы. Из полученного материала готовят 10 % суспензию с использованием раствора Хенкса. Суспензию центрифугируют при 3000 об/мин, собирают надосадочную жидкость, вносят в нее антибиотики и помещают в стерильную посуду.
Кровь, полученную при венепункции в объеме 5-10 мл, дефибринируют путем добавления гепарина. Цельную кровь не замораживают, антибиотики не добавляют. Для получения сыворотки пробы крови выдерживают в термостате при 37˚С в течение 60 минут.
Жидкость из серозных полостей получают при их пункции в количестве 1-2 мл. Жидкость используется сразу или сохраняется в замороженном состоянии.
Мазок с конъюнктивы берут стерильным тампоном и помещают в ВТС, после чего проводят центрифугирование взятого материала и его замораживание.
Содержимое везикул отсасывают шприцем с тонкой иглой и помещают в ВТС. Материал посылается в лабораторию в виде высушенных мазков на предметных стеклах или в запаянных стерильных капиллярах или ампулах.
Секционный материал отбирают в возможно ранние сроки, соблюдая правила асептики. Для отбора каждой пробы используют отдельные наборы стерильных инструментов. Количество отбираемых тканей составляет 1-3 г, которые помещают в стерильные флаконы. Вначале берут пробы внеполостных органов (мозг, лимфатические узлы и др.). Ткани грудной полости берут до вскрытия брюшной полости. Полученные образцы тканей растирают в ступке с добавлением стерильного песка и стерильного раствора натрия хлорид, после чего материал центрифугируют. Надосадочную жидкость собирают во флаконы, добавляют антибиотики. Материал для вирусологического исследования используется сразу или хранится при -20˚С.
2. Обработка вируссодержащего материала. Проводится с целью освобождения материала от сопутствующей бактериальной микрофлоры. Для этого используются физические и химические методы. Физические методы: 1) фильтрование через различные бактериальные фильтры; 2) центрифугирование. Химические методы: 1) обработка материала эфиром в случаях выделения вирусов, не имеющих суперкапсида; 2) добавление к материалу смеси гептана и фреона; 3) внесение антибиотиков (пенициллин – 200-300 ЕД/мл; стрептомицин – 200-500 мкг/мл; нистатин – 100-1000 ЕД/мл).
3. Заражение материалом чувствительных живых систем. Поскольку вирусы являются облигатными внутриклеточными паразитами, для их размножения используют следующие живые системы: 1) лабораторные животные; 2) куриные эмбрионы; 3) культуры органов; 4) культуры тканей.
Лабораторные животные. Используются белые мыши, морские свинки, хомяки, кролики и др. Белые мыши наиболее чувствительны к большому числу видов вирусов. Способ заражения животных определяется тропизмом вируса к тканям. Заражение в мозг применяется при выделении нейротропных вирусов (вирусы бешенства, полиовирусы и др.). Интраназальное заражение проводят при выделении возбудителей респираторных инфекций. Широко используются внутримышечный, внутривенный, внутрибрюшинный, подкожный и другие методы заражения. Заболевших животных усыпляют эфиром, вскрывают и производят забор материала из органов и тканей.
Куриные эмбрионы. Широко доступны и просты в работе. Применяют куриные эмбрионы в возрасте от 5 до 14 дней. Перед заражением куриные эмбрионы овоскопируют: определяют их жизнеспособность, отмечают на скорлупе границу воздушного мешка и месторасположение эмбриона («темный глаз» эмбриона). Работа с куриными эмбрионами проводится в стерильном боксе стерильными инструментами (пинцеты, шприцы, ножницы, копье и др.). После выполнения фрагмента работы инструменты погружают в 70 % этиловый спирт и перед следующей манипуляцией прожигают. Перед заражением скорлупу куриного эмбриона протирают горящим спиртовым тампоном и спиртовым раствором йода. Объем исследуемого материала, вводимого в эмбрион, составляет 0,1-0,2 мл. Для выделения вирусов из одного материала используют не менее 4 куриных эмбрионов.
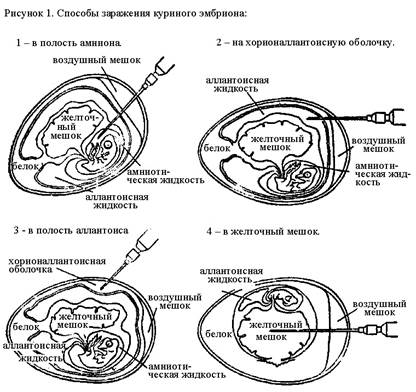 |
Существует несколько способов заражения куриного эмбриона: в полости амниона и аллантоиса, на хорион-аллантоисную оболочку, в желточный мешок (рис. 1).
Заражение в полость аллантоиса. Куриное яйцо располагают вертикально, воздушным мешком вверх. В центре тупого полюса яйца над воздушным мешком прокалывают скорлупу, вводят иглу для внутримышечных инъекций на 2-3 мм ниже границы воздушного мешка и туберкулиновым шприцем вводят исследуемый материал. Прокол в скорлупе закрывают расплавленным парафином или лейкопластырем.
Заражение в полость амниона. Над воздушным мешком вертикально расположенного яйца прорезают окно размером 1х1 см и осторожно снимают часть хорион-аллантоисной оболочки над телом эмбриона. Пинцетом вводят в него исследуемый материал с помощью туберкулинового шприца. Амниона приводят в исходное положение, отпуская пинцет. Отверстие в скорлупе закрывают лейкопластырем.
Заражение на хорион-аллантоисную оболочку. Над воздушной камерой вертикально расположенного яйца вырезают кусочек скорлупы, создавая окно. Затем отслаивают оболочку под скорлупой, обнажая участок хорион-аллантоисной оболочки, на который наносят исследуемый материал. Отверстие в скорлупе заклеивают лейкопластырем.
Заражение в желточный мешок. Яйцо укладывают горизонтально, чтобы тело эмбриона располагалось внизу, а желток над ним. Через прокол скорлупы в области воздушного мешка вводят иглу для внутримышечных инъекций по центральной оси яйца на глубину 2/3 длины иглы и шприцем вводят исследуемый материал. Отверстие в скорлупе заклеивают лейкопластырем.
После заражения эмбрионы инкубируют в термостате, располагая тупым концом кверху. Температура и продолжительность инкубации зависят от биологических свойств изолируемого вируса. По окончании инкубации эмбрионы охлаждают при +4˚С 16-18 ч. После этого куриный эмбрион стерильно вскрывают, вырезая в скорлупе отверстие над воздушным мешком выше обозначенной границы. Пастеровской пипеткой или шприцем отсасывают аллантоисную, затем амниотическую жидкость, разрезают хорион-аллантоисную оболочку для изучения, остальное содержимое яйца извлекают в чашку Петри. Аллантоисная и амниотическая жидкости используются для индикации вирусов.
Культуры органов. Это правильно приготовленные срезы органов, которые in vitro сохраняют свою структуру и функции в течение нескольких дней, а иногда и недель. Культуры органов выращивают на поверхности жидкой питательной среды с помощью «плота» или «платформы». Заражение культуры органов проводят путем внесения кусочков органа или ткани в пробирку с исследуемым материалом. Адсорбцию вируса проводят в течение 1-2 ч при комнатной температуре. Затем исследуемый материал сливают, фрагменты органа или ткани отмывают в растворе Хенкса, помещают в сосуд для культивирования, вносят питательную среду и выдерживают в термостате. Забор материала для обнаружения вируса в культуре ткани начинают со 2 дня культивирования.
Культуры клеток. Культура клеток – это популяция однотипных клеток организма животных или человека, которая выращивается в искусственных условиях и предназначается для культивирования вирусов. По длительности жизни клеточные культуры подразделяются на: 1) первичные; 2) полуперевиваемые; 3) перевиваемые.
Первичные культуры клеток получают из тканей животных и человека путём их ферментативной дезинтеграции. Кусочки ткани помещают в 0,25 % раствор трипсина при температуре 37˚С и периодически перемешивают. В результате этого происходит отделение клеток ткани друг от друга. Порции клеток собирают по мере их отделения, центрифугируют, трипсин сливают, вносят среду роста и суспендируют в ней клетки. Первичные культуры клеток могут претерпевать до 10 делений in vitro, обладают высокой чувствительностью ко многим вирусам, могут быть получены в большом количестве, безопасны в онкогенном отношении. Недостатком первичных культур является значительная трудоёмкость и длительность получения, а также возможная контаминация латентными вирусами. К первичным культурам клеток относятся клетки почки эмбриона человека, макаки резус, эмбриона свиньи, фибробласты куриных эмбрионов.
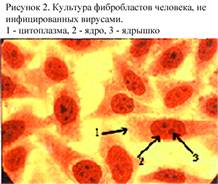 Полуперевиваемые культуры клеток представляют собой диплоидные клетки одного типа, которые способны претерпевать in vitro до 100 делений, сохраняя при этом исходный диплоидный набор хромосом. К полуперевиваемым культурам клеток относятся фибробласты эмбриона человека (рис. 2). Эти клетки чрезвычайно требовательны к условиям культивирования, поэтому в практике вирусологических лабораторий имеют ограниченное применение.
Полуперевиваемые культуры клеток представляют собой диплоидные клетки одного типа, которые способны претерпевать in vitro до 100 делений, сохраняя при этом исходный диплоидный набор хромосом. К полуперевиваемым культурам клеток относятся фибробласты эмбриона человека (рис. 2). Эти клетки чрезвычайно требовательны к условиям культивирования, поэтому в практике вирусологических лабораторий имеют ограниченное применение.
Перевиваемые культуры клеток – это однотипные опухолевые или нормальные клетки человека и животных с изменённым кариотипом, способные к неограниченному росту в условиях in vitro. Перевиваемые культуры клеток просты при культивировании, в связи с чем широко используются при лабораторной диагностике вирусных заболеваний у человека. К перевиваемым культурам клеток относятся линии НеLа (клетки карциномы шейки матки человека), КВ (клетки карциномы полости рта человека), Vero (клетки почки зеленой мартышки), СПЭВ (клетки почки эмбриона свиньи) и др.
Выращивание культур клеток независимо от их типа проводится в стерильных условиях в специальных плоских стеклянных сосудах – матрацах, в которые вносится питательная среда. На дне матраца клетки при своем размножении образуют монослой.
Для культивирования культур клеток используются специальные питательные среды, содержащие физиологические количества аминокислот, углеводов, минеральных солей, и имеющие рН=7,2-7,4. Наряду с питательными веществами в средах имеется индикатор, изменяющий цвет среды при сдвиге рН от оптимального значения. Наиболее широко используемыми при работе с культурами клеток являются: среда 199, среда Игла. Среда 199 включает 60 компонентов и применяется для культивирования перевиваемых и первично-трипсинизированных клеток. Среда Игла содержит минимальный набор аминокислот (13) и витаминов (8). Применяется для культивирования диплоидных и перевиваемых клеточных культур.
Выращивание клеток должно проводится в асептических условиях, в связи с чем в питательные среды вносят антибиотики (например, пенициллин и стрептомицин).
4. Индикация вирусов в живых системах.Индикация вирусов – это обнаружение вирусов в исследуемом материале без установления их принадлежности к семейству, роду, виду или сероварианту.
Индикация вирусов на лабораторных животных. О присутствии вирусов в организме прежде всего свидетельствует развитие симптомов заболевания или гибель животного. У погибшего или предварительно усыпленного эфиром животного отбирают образцы пораженных органов и тканей, помещают их в фарфоровую ступку, добавляют солевой раствор и растирают с песком. Полученную суспензию центрифугируют для осаждения тканевого детрита. В надосадочной жидкости проводят индикацию вирусов по гемагглютинирующему, комплементсвязывающему или другим антигенам.
Индикация вирусов на куриных эмбрионах. В амниотической и аллантоисной жидкости индикацию вирусов осуществляют в реакции гемагглютинации (РГА). При заражении куриного эмбриона на хорион-аллантоисную оболочку нередко обнаруживаются бляшки или оспины, являющиеся вирусоспецифическими повреждениями. Индикацию вирусов в хорион-аллантоисной оболочке проводят в реакциях гемагглютинации или связывания комплемента (РСК). Для этого оболочку растирают в ступке, готовят суспензию, которую центрифугируют для осаждения тканевого детрита, а надосадочную жидкость исследуют в РГА или РСК.
Индикация вирусов в культурах органов и клеток проводится по: 1) цитопатическому действию вирусов (ЦПД); 2) образованию внутриклеточных включений; 3) в реакции гемагглютинации; 4) по образованию бляшки; 5) по цветной пробе; 6) по реакции гемадсорбции.
ЦПД – это морфологические изменения в культуре органов и клеток, возникающие в процессе репродукции вирусов в клетках. Вирусы, вызывающие ЦПД, называют цитопатогенными. Характер ЦПД зависит от биологических свойств вирусов, дозы вируса, свойств клеток и условий их культивирования. ЦПД вирусов может проявляться некрозом, гроздьеобразованием, симпласто- и синцитиеобразованием, круглоклеточной дегенерацией, клеточной пролиферацией, очаговой деструкцией.
 При некротическом ЦПД вирусов полиомиелита, Коксаки, ЕСНО большинство клеток полностью разрушается, оставшиеся клетки сморщены (пикноз ядра и цитоплазматической мембраны, вакуолизация), для них характерно двойное лучепреломление – сильное свечение при микроскопии.
При некротическом ЦПД вирусов полиомиелита, Коксаки, ЕСНО большинство клеток полностью разрушается, оставшиеся клетки сморщены (пикноз ядра и цитоплазматической мембраны, вакуолизация), для них характерно двойное лучепреломление – сильное свечение при микроскопии.
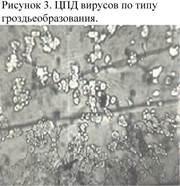
ЦПД по типу гроздьеобразования характерно для аденовирусов, при этом клетки округляются, увеличиваются, частично сливаются между собой с образованием гроздьевидных скоплений (рис. 3).
| |
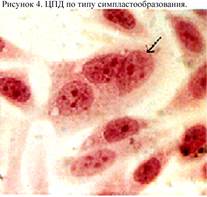
Синцитий состоит из клеток, соединенных цитоплазматическими мостиками, тогда как симпласт – это большая многоядерная клетка, образовавшаяся в результате многократных незавершённых митозов.
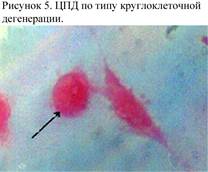
ЦПД вирусов по типу круглоклеточной дегенерации характеризуется округлением клеток и утратой ими межклеточных связей. Может наблюдаться также пикноз, сморщивание и деструкция клеток (рис. 5).
У онкогенных вирусов ЦПД может проявиться трансформацией клеток в злокачественные, что сопровождается интенсивной пролиферацией клеток и образованием многослойных клеточных структур. ЦПД некоторых штаммов вирусов гриппа, осповакцины, натуральной оспы проявляется очаговой деструкцией культуры клеток – на фоне сохранившегося в целом монослоя появляются очаги поражения клеток (микробляшки).
 При отсутствии или слабо выраженном ЦПД проводят заражение культуральной жидкостью новых культур клеток.
При отсутствии или слабо выраженном ЦПД проводят заражение культуральной жидкостью новых культур клеток.
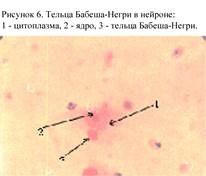
 Внутриклеточные включения в цитоплазме или ядре клетки образуются при репродукции в них вирусов бешенства, оспы, гриппа, герпеса, аденовирусов и др. Внутриклеточные включения представляют собой кристалловидные скопления вирионов. Включения обнаруживают при световой иммерсионной микроскопии после окраски стекол с монослоем по Романовскому-Гимзе, или при люминесцентной микроскопии после обработки акридиновым оранжевым. При окраске по Романовскому-Гимзе вирусные включения приобретают розовый или розово-сиреневый цвет. При окраске акридиновым оранжевым ДНК-структуры дают зеленое свечение, а РНК-структуры – красновато-оранжевое. В настоящее время выявление внутриклеточных включений проводят при диагностике бешенства (тельца Бабеша-Негри) (рис. 6). Ранее при натуральной оспе проводилось выявление телец Гварнери.
Внутриклеточные включения в цитоплазме или ядре клетки образуются при репродукции в них вирусов бешенства, оспы, гриппа, герпеса, аденовирусов и др. Внутриклеточные включения представляют собой кристалловидные скопления вирионов. Включения обнаруживают при световой иммерсионной микроскопии после окраски стекол с монослоем по Романовскому-Гимзе, или при люминесцентной микроскопии после обработки акридиновым оранжевым. При окраске по Романовскому-Гимзе вирусные включения приобретают розовый или розово-сиреневый цвет. При окраске акридиновым оранжевым ДНК-структуры дают зеленое свечение, а РНК-структуры – красновато-оранжевое. В настоящее время выявление внутриклеточных включений проводят при диагностике бешенства (тельца Бабеша-Негри) (рис. 6). Ранее при натуральной оспе проводилось выявление телец Гварнери.
Образование бляшек. Бляшки – это очаги разрушенных первично инфицированных вирусом клеток монослоя, находящегося под агаровым покрытием. Бляшки выявляются путём окрашивания культуры нейтральным красным, который либо включают в состав агарового покрытия, либо добавляют непосредственно перед учётом результатов. Поскольку бляшки состоят из погибших клеток, не воспринимающих краситель, поэтому они видны в виде светлых пятен на фоне розово-красного монослоя живых клеток. Учёт бляшкообразования проводят для количественного анализа инфекционной активности клеток.
Цветная проба. Среды 199 и Игла, в которых культивируют культуры клеток, имеют малиновый цвет, рН=7,2-7,4 и содержат индикатор, меняющий окраску среды при изменении рН. При культивировании в этих средах клеточных культур, не инфицированных вирусом, вследствие выделения клетками кислых продуктов метаболизма цвет среды изменяется на оранжевый. Вирусинфицированные клетки в результате подавления метаболизма вирусной репродукцией, а также в результате ЦПД вирусов, разрушаются, щелочная цитоплазма клеток попадает в среду, не изменяя её цвета (среда остаётся красной).
Реакция гемагглютинации (РГА) основана на способности некоторых вирусов, содержащих на своей внешней оболочке агглютинин, склеивать (агглютинировать) эритроциты определенных видов животных. Для проведения РГА используют бесклеточный вируссодержащий материал (аллантоисную или амниотическую жидкость, супернатант тканевых культур). Вируссодержащую жидкость смешивают с 0,5 мл изотонического раствора натрия хлорида и 0,5 мл 1 % взвеси отмытых эритроцитов, после чего инкубируют при 37˚, 20˚ или 4˚С в течение 30-60 минут. При отрицательном контроле развитие агглютинации в опыте свидетельствует о присутствии вируса в исследуемой жидкости. Контролем служит смесь 0,5 мл эритроцитов с равным объемом изотонического раствора натрия хлорида, не содержащего вирус.
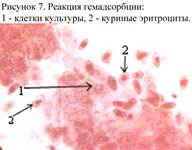 Реакция гемадсорбции (РГадс) позволяет обнаружить гемагглютининсодержащие вирусы в клеточных культурах до развития ЦПД (рис. 7). Гемадсорбция наблюдается только в том случае, если гемагглютинин вируса присутствует на цитоплазматической мембране клеток культуры. Ргадс проводится путём внесения в клеточную культуру 0,2 мл 0,5 % взвеси эритроцитов, после чего клетки выдерживают 15-20 минут при 37˚, 20˚ или 4˚С (в зависимости от свойств вируса). Затем пробирки встряхивают для удаления неадсорбированных эритроцитов и учитывают под малым увеличением микроскопа скопление их на отдельных клетках или на всем монослое. На неинфицированных вирусами клетках адсорбции эритроцитов не наблюдается.
Реакция гемадсорбции (РГадс) позволяет обнаружить гемагглютининсодержащие вирусы в клеточных культурах до развития ЦПД (рис. 7). Гемадсорбция наблюдается только в том случае, если гемагглютинин вируса присутствует на цитоплазматической мембране клеток культуры. Ргадс проводится путём внесения в клеточную культуру 0,2 мл 0,5 % взвеси эритроцитов, после чего клетки выдерживают 15-20 минут при 37˚, 20˚ или 4˚С (в зависимости от свойств вируса). Затем пробирки встряхивают для удаления неадсорбированных эритроцитов и учитывают под малым увеличением микроскопа скопление их на отдельных клетках или на всем монослое. На неинфицированных вирусами клетках адсорбции эритроцитов не наблюдается.
5. Титрование выделенных вирусов -это обязательный этап вирусологического метода диагностики, целью которого является количественное определение содержания вирусных частиц в единице объема исследуемого материала.
Методы титрования вирусов, выделенных на лабораторных животных предусматривают определение дозы (титра), при которой возбудитель вызывает гибель 50 % инфицированных животных или характерные симптомы заболевания. Титр вирусов выражают в ЛД50 – летальная доза или в ИД50 – инфицирующая доза.
Титрование вирусов, выделенных на куриных эмбрионах и обладающих гемагглютинирующей активностью проводят в реакции гемагглютинации. РГА проводят в пробирках или в специальных планшетах. Из вируссодержащего материала готовят двукратные разведения в 0,5 мл изотонического раствора натрия хлорид. Во все пробирки добавляют 0,5 мл взвеси эритроцитов. Контролем служит смесь 0,5 мл эритроцитов с таким же объемом изотонического раствора натрия хлорида, не содержащего вирусов. В зависимости от свойств изучаемого вируса инкубацию смеси проводят в термостате при 37˚, 20˚ и 4˚С. Результаты реакции учитывают через 30-60 минут после полного оседания эритроцитов в контроле: (++++) – интенсивная и быстрая агглютинация эритроцитов, осадок имеет звездчатую форму с фестончатыми краями («зонтик»); (+++) – осадок эритроцитов имеет просветы; (++) – менее выраженный осадок; (+) – хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов и (-) – резко очерченный осадок эритроцитов («монетный столбик»), такой же, как в контроле. Титром вируса при проведении РГА называется наибольшее его разведение, при котором еще наблюдается агглютинация эритроцитов. Это разведение считают содержащим одну гемагглютинирующую единицу вируса (1 ГАЕ). Разведения, которые предшествуют 1 ГАЕ, будут содержать в 2 раза больше ГАЕ по сравнению с последующим от них разведением. Например, если 1 ГАЕ соответствует разведению 1:64, то разведение 1:32 будет соответствовать 2 ГАЕ, а разведения 1:16 и 1:8 – 4 и 8 ГАЕ соответственно. Для идентификации вирусов, как правило, используется титр вируса, равный 4 ГАЕ.
Титрование вирусов в культурах клеток проводят по ЦПД, бляшкообразованию и цветной пробе.
Титром вируса при его определении в культурах клеток по ЦПД называется то наибольшее разведение вируссодержащего материала, в котором вирус способен вызвать ЦПД у 50 % инфицированных культур клеток. Эта величина называется 50 % тканевой цитопатической дозой (ТЦД50). Титрование вируса по ЦПД включает следующие этапы: 1) посев, выращивание и отбор пробирочных культур клеток, имеющих сформировавшийся монослой; 2) получение 10-кратных разведений вируссодержащего материала; 3) инфицирование культур клеток разными разведениями вируса; 4) выдерживание –культур клеток в термостате при 37˚; 5) учет результатов на 5-7 сутки по системе плюсов (++++) и статистическую обработку результатов. Для получения статистически достоверных результатов необходимо соблюдение ряда правил: а) использование не менее 4 пробирочных культур клеток для заражения 1 разведением вируса; б) включение в титровальный ряд 2 разведений вируса – ниже и выше ЦПД50.
Титрование вирусов в культурах клеток по бляшкообразованию является одним из наиболее чувствительных и точных методов количественного определения вирусов. Вместе с тем, метод технически сложен и, в основном, используется при проведении научных исследований.
Титрование вирусов в культурах клеток методом цветной пробы призвано определить наибольшее разведение вируссодержащего материала, при котором происходит изменение цвета среды, содержащей суспензию клеток в концентрации 200 тысяч клеток в 1 мл. После установления титра вируса готовят рабочую дозу – 100 ТЦД50, которую используют при идентификации вирусов.
6. Идентификация вирусов в иммунных реакциях. Идентификация, или титрование вирусов – это установление их вариантной, видовой, родовой и семейственной принадлежности. Идентификация вирусов проводится по принципу: определение неизвестного по известному. Известным компонентом при идентификации вирусов являются специфические противовирусные сыворотки (противогриппозные, противокоревые и др.), которые используют в серологических реакциях нейтрализации (РН), торможения гемадсорбции (РТГадс), торможения гемагглютинации (РТГА), РПГА, РСК, а также при ИФА и РИА. Эти сыворотки содержат специфические противовирусные антитела и называются диагностическими.
Реакция нейтрализации (РН) может быть проведена на культуре клеток, куриных эмбрионах и животных. В пробирках готовят нейтрализационные смеси, состоящие из равных объемов вируссодержащего материала (обычно 100 ТЦД50 вируса в 1,0 мл) и диагностической сыворотки (1,0 мл). После тщательного встряхивания приготовленные смеси выдерживают для взаимодействия в течение 3 ч при 37˚С. Затем нейтрализационные смеси вносят в чувствительную клеточную культуру, которую инкубируют при 37˚С 5-7 суток, после чего учитывают результаты по ЦПД и цветной пробе (табл. 1).
Таблица 1
