Аллостерический контроль активности ферментов
При многих строго биосинтетических реакциях основным типом регуляции скорости многоступенчатого ферментативного процесса является ингибирование по принципу обратной связи (ретроингибирование). Это означает, что конечный продукт биосинтетической цепи подавляет активность фермента, катализирующего первую стадию синтеза, которая является ключевой для данной цепи реакции. Поскольку конечный продукт структурно отличается от субстрата, он связывается с аллостерическим (некаталитическим) центром молекулы фермента, вызывая ингибирование всей цепи синтетической реакции.
Предположим, что в клетках осуществляется многоступенчатый биосинтетический процесс, каждая стадия которого катализируется собственным ферментом:
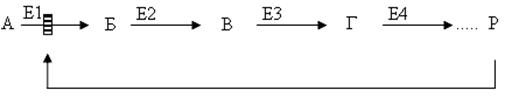
Скорость подобной суммарной последовательности реакций в значительной степени определяется концентрацией конечного продукта Р, при сверхдопустимом уровне которого отмечается мощное ингибирующее действие на первую стадию процесса и соответственно на фермент E1.
Существование такого типа ингибирования доказано во всех живых организмах. В настоящее время он рассматривается как один из ведущих типов регуляции активности ферментов и клеточного метаболизма в целом.
С другой стороны, в амфиболических процессах, выполняющих одновременно биосинтетические и биодеградативные функции, доказано существование регуляции как по типу ретроингибирования, так и макроэрги-ческими соединениями – индикаторами энергетического состояния клетки. Для амфиболических процессов уникальным типом регуляции, свойственным только им, является, кроме того, активация предшественником, когда первый метаболит в многоступенчатом пути активирует фермент, катализирующий последнюю стадию. Так, доказано активирующее влияние глюкозо-6-фосфата, являющегося предшественником гликогена, на фермент гликогенсинтазу.
Подобные типы ингибирования конечным продуктом и активирования первым продуктом свойственны аллостерическим (регуляторным) ферментам, когда эффектор, модулятор, структурно отличаясь от субстрата, связывается в особом (аллостерическом) центре молекулы фермента, пространственно удаленном от активного центра. Следует, однако, иметь в виду, что модуляторами аллостерических ферментов могут быть как активаторы, так и ингибиторы. Часто оказывается, что сам субстрат оказывает активирующий эффект. Ферменты, для которых и субстрат, и модулятор представлены идентичными структурами, носят название гомотропных в отличие от гетеротропных ферментов, для которых модулятор имеет отличную от субстрата структуру.
Взаимопревращение активного и неактивного аллостерических ферментов в упрощенной форме, а также конформационные изменения, наблюдаемые при присоединении субстрата и эффекторов, представлены на рис. 15.6. Присоединение отрицательного эффектора к аллостерическому центру вызывает значительные изменения конфигурации активного центра молекулы фермента, в результате чего фермент теряет сродство к своему субстрату (образование неактивного комплекса).
а б
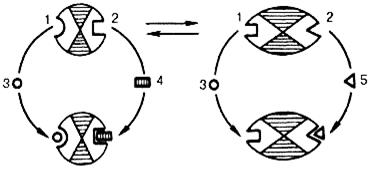
Рис.15.6.Взаимодействие аллостерического фермента с субстратом и эффекторами: а – активный комплекс; б – неактивный комплекс; 1 – активный центр; 2 – аллостерический центр; 3 – субстрат; 4 – положительный эффектор; 5 – отрицательный эффектор
Аллостерические взаимодействия проявляются в характере кривых зависимости начальной скорости реакции от концентрации субстрата или эффектора, в частности в S-образности этих кривых (отклонение от гиперболической кривой Михаэлиса-Ментен). S-образный характер зависимости v от [S] в присутствии модулятора обусловлен эффектом кооперативности. Это означает то, что связывание одной молекулы субстрата облегчает связывание второй в активном центре, тем самым способствуя увеличению скорости реакции. Кроме того, для аллостерических регуляторных ферментов характерна нелинейная зависимость скорости реакции от концентрации субстрата.
