Бiологiчна роль d-елементiв та їx сполук
Ферум (Fe). Йони Феруму(ІІ) та Феруму(ІІІ) мають важливе значення для життєдiяльностi органiзму людини. Вони необхiднi для процесiв кровотворення, нормальної дiяльностi багатьох ферментів, перенесения кисню вiд легень до тканин, електронiв у ланцюзi дихання.
Загальний вмiст Феруму в органiзмi становить близько 5 г; багато його в печiнцi (500 − 600 мг), мʼязах (400 − 450 мг), кiстковому мозку (250 − 300 мг), проте 60−70 % вiд його загальної маси мiститься в еритроцитах та нервових клiтинах.
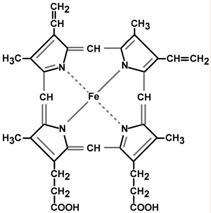
Ферум, що входить до складу бiологiчних систем, подiляють на гемовий i негемовий (''гемове та негемове залiзо"). Ферум у виглядi двовалентних йонiв Fe(II), що входить до складу порфiринових комплексів − гемоглобiну, метгемоглобiну, цитохромiв, називають гемовим, а в складi всiх iнших бiологiчно активних сполук − феритину, гемосидерину, лактоферину, ферумсульфуровмiсних бiлкiв тощо називаютъ негемовим.
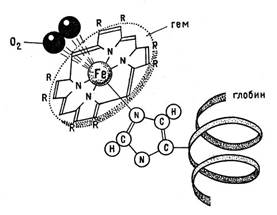
 Серед бiлкiв, що мiстятъ йони Феруму (ІІ) в гемах, найбiльше значения мають гемоглобiн i міоглобiн. Гемоглобiн (НВ), дуже важливий компонент еритроцитiв кровi, забезпечуе звʼязування i перенесення кисню вiд легень до всiх органiв, а мiоглобiн − збереження запасiв кисню в мʼязах. Склад i структура цих бiлкiв детально вивчена.
Серед бiлкiв, що мiстятъ йони Феруму (ІІ) в гемах, найбiльше значения мають гемоглобiн i міоглобiн. Гемоглобiн (НВ), дуже важливий компонент еритроцитiв кровi, забезпечуе звʼязування i перенесення кисню вiд легень до всiх органiв, а мiоглобiн − збереження запасiв кисню в мʼязах. Склад i структура цих бiлкiв детально вивчена.
Встановлено, що йон Феруму(ІІ) звʼязаний з чотирма атомами Нiтрогену пiрольного кiльця протопорфiрину IX та з пʼятим атомом iмiдазольного циклу гiстидину, що входить до складу бiлковоi частини молекули – глобiну.
 Шостий вiльний координацiйний звʼязок йона Феруму використовується для звʼязування кисню або iнших лiгандiв: Н2О, СО, CN−.
Шостий вiльний координацiйний звʼязок йона Феруму використовується для звʼязування кисню або iнших лiгандiв: Н2О, СО, CN−.
Бiлкова частина макромолекули (глобiн) складається з 574 амiнокислот і необхiдна для забезпечення оборотного процесу звʼязування кисню. Молекулярна маса цього бiлка становить ~ 65000. На одну таку макромолекулу припадає чотири атоми Феруму в гемах. Кожний гем оточений чотирма бiлковими ланцюжками.
В одному лiтрi кровi людини мiститься в середньому 4,5·1012 еритро цитiв i в кожному з них с близько 400 млн молекул гемоглобiну. Тому 1 дм3 кровi за температури 20 °С i нормального тиску вбирає ~200 см3 кисню, а вода за таких самих умов − всього 6,6 см3. В органiзмi людини масою 70 кг мiститься в середньому 5,0…5,5 л кровi, отже кров переносить одночасно ~ 1 л кисню.
Дослiдження показали, що на поверхнi гемоглобiну та мiоглобiну є невеликi заглиблення, в яких мiстяться йони Феруму(ІІ). В них йони металу оточені вуглеводневими залишками амінокислот, які мають гідрофобнi властивостi. Цi впадини не можуть заповнюватися полярними молекулами води, на них містяться неполярні молекули кисню, якi приєднуються до Феруму, утворюючи оксигемоглобiн. В атмосферi чадного газу СО, їx займають малополярнi молекули карбон (II) оксиду. При цьому утворюсться iнший комплекс − карбоксигемоглобiн, який характеризуеться бiльшою стiйкiстю, нiж оксигемоглобiн. Вiн не лабiльний, важко руйнується i не виконує функцiю транспорування кисню, оскільки шостикоординацний звʼязок іона Fe(IІ) заблокований молекулою СО. Тому в атмосферi чадного газу виникають смертельнi отруєння органiзму. Гранично допустима концентрацiя СО в повiтрi населених пунктiв не повинна перевищувати 0,075 мг/м3.
Ферум входить до складу iнших бiологiчно активних сполук, зокрема цитохромiв, якi є носiями електронiв у ланцюгу дихання. За своєю структурою вони нагадують гем, рiзниця полягає в будовi бiчних ланцюгiв порфiринового циклу та бiлковоi частини макромолекул.
Функцiї цитохромiв i гемоглобiну суттево вiдрiзняються, оскiльки фізiологiчна дiя цитохромiв побудована на принципi змiни с.о. Феруму, причому перетворення Fe3+ + ē ↔ Fe2+ створюють можливість переміщення електронів від одного цитохрому до iншого. 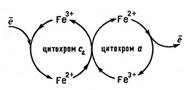 Йон Феруму змiнює свiй ступiнь окиснення, пере даючи електрони.
Йон Феруму змiнює свiй ступiнь окиснення, пере даючи електрони.
Крiм цитохромiв, у процесах перенесения електронiв беруть участь i ферум-сульфуровмiснi бiлки якi умовно позначають n-Fе-S-бiлки (де n − число атомiв Феруму в складi бiлка). В активному центрi вони мiстять йони Fe(III), якi ковалентно звʼязанi з S-H-групами цистеїну та з неорганiчним Сульфуром, який називають "лабiльною сiркою" (у формулах іі позначаютъ зiрочкою). Ферум-сульфуровмiснi бiлки виконують функцiю транспортування електронiв у процесах синтезу АТФ, фотосинтезу, фiксуваннi атмосферного азоту i вуглекислого газу, беруть участь в окисно-вiдновних процесах рiзних форм життя.
Наприклад, бiлок типу 2-Fe-S*, який називають ферредоксином хлоропластiв, мiститься в рослинах i бере участь у процесi фотосинтезу, а адренодоксин − у перенесеннi електронiв при гiдроксилюваннi стероїдiв. До бiлкiв типу 8-Fe-S* належать такi: ферредоксин бактерiй (забезпечус передавання електронiв, виступає вiдновником у процесах фiксації атмосферного азоту), ксантиноксидаза (фермент, який бере участь в реакцiї окиснення пуринiв), альдегiдоксидаза (фермент, що прискорює реакцiю окиснення альдегідів та ін.
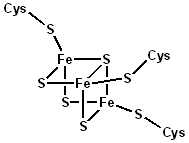 Особливiстю будови Fе-S*-бiлкiв є свосрiдна структура атомiв Феруму i Сульфуру у виглядi кубічної гратки, яку називають "клiткою". Вона звʼязана з залишками цистеїну Cys полiпептидноrо ланцюга, як показано на схемi.
Особливiстю будови Fе-S*-бiлкiв є свосрiдна структура атомiв Феруму i Сульфуру у виглядi кубічної гратки, яку називають "клiткою". Вона звʼязана з залишками цистеїну Cys полiпептидноrо ланцюга, як показано на схемi.
Необхiдно зазначити, що еритроцити кровi через певний час (80…120 днiв) руйнуються i замiнюються новими, але пiсля їх розкладання Ферум не виводиться з органiзму, а сполучається з iншими бiлками, утворюючи бiокомплекс феритин, який регенерується кровотворними органами i знову перетворюється на гемоглобiн.
У кровi ще мiстяться iншi бiлковi молекули − трансферини, якi виконують функцiю перенесения йонiв Fe3+. Вони звʼязують їx i доставляють у клiтини, в яких вiдбуваєтъся синтез гемоглобiну. Із трансферином йони Fe(III) утворюють доволi стiйкi комплекси (Kнест = 1030). Якщо концентрацiя йонiв Fe(III) перевищить необхiдну для звʼязування з трансферином, то надлишковi йони Fe(III) осаджуються у виглядi основних солей Fe(OH)X2 або Fe(OH)2Х (де Х одновалентний анiон). Реакцiї гiдролiзу сполук Феруму знижують рН середовища, що сприяє утворенню малорозчинних колоїдних частинок i може стати причиною утворення тромбiв.
Йони Феруму(ПI) входять до складу i таких важливих ферментiв, як каталаза та пероксидаза. Каталаза захищае клiтини вiд токсичної дii гідроген пероксиду, а пероксидаза каталізує процеси окиснення різних органiчних субстратiв гiдроген пероксидом.
Пероксидаза складається з однiєї субодиницi (бiлок з молекулярною масою близько 40 тис.) i гем-групи, до якої входить йон Феруму(ІІI). Каталаза (М = 240 000) мiстить чотири однаковi субодиницi, до кожної з них входить один гем, що мiстить йон Fe(III) у ролi комплексоутворювача.
Ферум має велике значения для органiзму людини, добова потреба в ньому становить 20...30 мг. Цей бiоелемент у достатнiй кiлькостi мiститься в рiзноманiтних продуктах харчування (у мг на 1 кг маси тіла) − легенях (92), печінці (84), яйцях (22), крупах.
Найчастiше дефiцит Феруму в органiзмi виникає не внаслiдок недостатнього надходження його з продуктами харчування, а як результат порушення функцiї всмоктування та засвоення його органiзмом. При нестачi в органiзмi сполук Феруму розвиваються рiзнi хвороби кровi − залiзодефiцитнi анемiї, внаслідок яких зменшується загальна кількість еритроцитів та вміст у них гемоглобiну.
Для лiкування цих захворювань у медицинi використовують рiзнi препарати, що мiстять Ферум − фероплекс, фероплект, фероцерон, феронат, ферумградумет, гемофер, актиферин, хеферол, аскофер та iн. Вони мiстять у своему складi рiзнi солi Феруму(ІІ) − сульфат, хлорид, rлюконат або фумарат.
У надмiрних дозах Ферум викликае дезактивацiю ферментiв циклу Кребса, що призводить до нагромадження органiчних кислот у кровi, а при хронiчнiй iнтоксикацiї − сидероз.
Купрум (Cu). Вiдомо бiльше 30 рiзних бiлкiв i ферментiв, у складi яких виявлено йони Cu(I) або Cu(ІІ), якi, подiбно до Fe, виконують функцiю перенесения кисню та електронiв в окисно-вiдновних процесах. Так, у кровi безхребетних мiститься спецiальний бiлок гемоцiанiн, який за бiологiчною функцiею є аналогом гемоглобiну, проте в ньому йони Fe(ІІ) замiщенi на йони Cu(I). Вони сполученi з полiпептидними ланцюrами i звʼязують молекули кисню за такими схемами:
Cu+ − О2 − Сu+ або Cu2+− О2 − Cu+.
До складу деяких ферментiв iз групи оксидаз, що каталiзують перебiг в органiзмi окремих ОВР, також входить Купрум. Наприклад, у сироватцi кровi виявлений бiлок церулоплазмiн (з вмiстом до 0,3 % Cu), що каталiзує процес окиснення йонiв Fe2+ до Fe3+ та сприяє перенесению електронiв. Фермент цитохром-С-оксидаза, крiм йонiв Феруму, мiстить також йони Купруму(I). Це один iз важливих ферментiв у ланцюзi дихання, де спiльно дiють обидва d-елементи.
Крiм того, видiлено металофермент супероксиддисмутазу, що мiстить по 2 моль йонiв Cu i Zn на один моль бiлка. Вiн виконує важливу захисну функцiю, прискорюючи розкладання побiчних продуктiв кисневого дихання, зокрема реакцiю диспропорцiонування дуже токсичного супероксид анiон-радикала на O2 i H2O2:
О2− + 2Н+ → Н2О2 + О2.
Дiя йонiв Cu в окисно-вiдновних реакцiях повʼязана з ОВР, що вiдбувається за схемою: Cu2+ + ē ↔ Сu+.
Йони Cu беруть участь у процесах дихання тканин, росту та кровотворення, сприяють синтезу гемоглобiну в органiзмi, посилюють дiю iнсулiну та гормонiв гiпофiза, впливаючи на обмiн цукрiв та жирів. Крiм того, вони регулюють водно-електролiтний обмiн, оскiльки сприяютъ виведенню з органiзму води, затримують Кальцiй та фосфати, але не впливають на виведення хлоридiв.
Дефiцит цього бiоелемента може викликати анемiю, патологiчний рiст кiсток, дефекти сполучно1тканини, захворювання шкiри.
У незначних кiлькостях Купрум мiститься у клiтинах майже всiх органів людини, проте переважно концентрусться в печінці та головному млзку. Рiвень цього мiкроелемента змiнюється при iнфекцiйних захворюваннях мозку (зокрема енцефалiтi) та внаслiдок деяких iнших порушень функцiй головного мозку, зокрема шизофренiї та епiлепсii. 3 мозкових тканин тварин видiлено бiлки, що мiстять Купрум − альбокупреїни та нейрокупреїни, якi сприяють нормальному функцiонуванню головного мозку. Тому сполуки Купруму використовують для зниження збудження ЦНС при психiчних захворюваннях.
Загальна потреба дорослої людини в цьому бiоелементi становить 2-3 мг на добу. Вмiст Купруму поповнюєтъся за рахунок харчових продуктів, особливо круп, гороху, хліба, грибів, журавлини, мʼяса та ін.
При надлишку Купруму в органiзмi вiн нагромаджуеться в тканинах i викликае токсикоз (хворобу Вiльямса). У тварин спостерiгають переродження клітин печінки, виникнення цирозів та панкреатитів.
Цинк (Zn) − один з найпоширенiших мiкроелементiв органiзму. За своїми фiзико-хiмiчними характеристиками Цинк значно вiдрiзняється вiд перехiдних бiометалiв, оскiльки в сполуках виявляє постiйне значения с.о., мае менший йонний радiус i бiльший потенцiал йонiзацii. Вiн характеризуеться великою здатнiстю до координацiї з амiнними та сульфгiдрильними групами, що й реалiзується при утвореннi металоферментiв. Нинi вiдомо бiльше 40 рiзноманiтних ферментїв, які містять в структурах активних цeнтрів цей хімічнии елемент.
Найкраще вивченим ферментом, що вмiщує Цинк, є карбоксипептидаза − гiдролiтичний ензим, що каталiзує реакцiю розкладання білкiв до амiнокислот. Специфiчнiсть його дiї полягае у здатності відщеплювати амінокислотні залишки від кінця поліпептидного ланцюга, на якому знаходиться карбоксильна група.
Важливим ферментом є карбоангiдраза – металофермент, що мiстить в молекулi один йон Цинку (М ~ 30 000). Фiзiолологiчна роль його повʼязана з процесом дихання, оскiльки цей фермент каталiзує реакцiю гiдратацiї вуглекислого газу як продукту метаболiзму. Хiмiзм процесу полягає у взаємодiї карбон (IV) оксиду з водою з утворенням гiдрогенкарбонат-iона НСО3− (в клiтинах) та розкладання його на вуглекислий газ i гiдроксид-анiон в альвеолах легень:
СО2 + НОН ↔ Н2СО3 ↔ НСО3− + Н+;
НСО3− ↔ СО2 + ОН−.
До металоферментiв, що мiстять Цинк, належать алкогольдегiдрогеназа (дiє в печiнцi, забезпечуючи окиснення i метаболiзм етиловоrо спирту) та iнсулiн, що мiститься в пiдшлунковiй залозi i прискорює процес метаболiзму глюкози.
Iз бактерiй видiлений бiлок термолiзин, що містить по два йони Цинку i Кальцію. Такий бiлок може існувати за високих температур, що зумовлено наявнiстю в молекулi чотирьох йонiв металу, якi гальмують процес його денатурацiї.
Слiд зазначити, що однi ферменти Цинк активує, наприклад пероксидазу, амiнопептидазу, енолазу та ангiдразу, а iнщi (сукциноксидазу, протеазу, лужну фосфатазу) − iнгiбyє. Бiологiчна роль цого елемента повʼязана з залозами внутрiшньої секрецiї, в яких вiн i концентрується.
Вважають, що простата добре функцiонуе за достатньої кiлькостi Цинку.
Цинк вiдiграє важливу роль у функцiонуваннi клїтин головного мозку, тому його використовують для лікування псиіхiчних захворювань. Оскiльки вiн сприяє загоєнню ран, то цинковi мазi здавна застосовують у дерматологiї.
Здатнiсть Цинку пiдвищувати загальний енергетичний рiвень бiохімічних процесiв та посилювати захиснi реакцiї органiзму вiдкриває новi перспективи застосування його як стимулятора багатьох фiзiолоriчних процесiв. Проте зазначимо, що деякi дослiдження вказують на взаємозвʼязок мiж пiдвищеним рiвнем Цинку в органiзмi та ймовiрнiстю виникнення злоякісних пухлин.
Хронiчне отруєння сполуками Цинку призводитъ до гiпертонii, атеросклерозу, захворювання судии.
Манган (Mn) − важливий мiкроелемент для житгедiяльностi органiзму. Вiн впливає на рiст людини, необхiдний для утворення кiсток, збреження репродуктивної функцii органiзму, метаболiзму глюкози та лiпiдiв. Переважно вiн входить до складу ферментних систем, якi прискорюють окисно-вiдновнi реакцiї, внутрiшньоклiтинного обмiну речовин, наnриклад амiнопептидази. Вiн виявлений також у складi пiруваткарбоксилази, що каталiзує реакцiю утворення пiровиноградної кислоти СН3−СО−СООН. Особливо цей мiкроелемент необхiдний для активування ферментiв, зокрема, аргiнази, фосфатаз та iн.
Отже, ферменти, що мiстять Манган, каталiзують складнi процеси клiтинного дихания, посилюють обмiн вуглеводiв та жирiв, сприяють синтезу вiтамiну С та обмiну вiтамiнiв групи В та Е.
Манган знаходитъся в органiзмi у виглядi катiонних форм Mn2+, Mn3+, Мn4+, якi в ОВ процесах переходять з одного с.о. на інші за схемою:
Mn3+, Mn4+
 Вiдновлений субстрат Окиснений субстрат
Вiдновлений субстрат Окиснений субстрат
Мn2+
В органiзмi людини мiститься приблизно 20 мг Мангану, причому в кiстках − 43 %, а решта − в тканинах i мозку. Biн входить до складу продуктiв харчування − найбiльше його в крупах, борошнi (8-12 мг/кг), малині, смородинi, журавлинi (4-6 мг/кг), капустi, гopoci, шпинатi (2,6-2,3 мг/кг).
При дефiцитi цього мiкроелемента порушусться фосфорно-кальцiєвий обмiн, що призводить до виникнення paxiтy, як i при нестачi в органiзмi вiтамiну D. Манган прискорює процес утворення антитiл, якi знешкоджують чужi для органiзму бiлки (вiруси, бактерiї), посилює синтез гормонiв щитоподiбної залози (тироксину, трийодгиронiну), позитивно впливає на засвоєння йоду, тому рiвень Мангану в кровi повʼязують з виникненням ендемiчного зобу.
Враховуючи багатогранну фiзіологiчну дiю Мангану, його сполуки використовують у медичнiй практицi при невритах (у комплексi з полiвiтамiнами) i в разi захворювання кровотворних органiв (разом зi сполуками Кобальту та Купруму).
Кобальт (Со). Вмiст йонiв Кобальту в органiзмi становить 4·10−6 % мас. (3 мг/70 кг маси тiла), його добова потреба 0,3 мг. Як незамiнний мiкроелемент вiн входить до складу еритроцитiв та мегалопротеїнiв, що є компонентами тканин внутрiшнiх органiв − печiнки, нирок, пiдшлункової залози.
Йога бiологiчна роль тiсно повʼязана з функцiонуванням ряду ферментiв та гормонiв, зокрема Кобальт бере участь у синтезi гормонiв щитоподiбної залози − тироксину i трийодтиронiну, активує такi ферменти, як карбоангiдразу та карбоксипептидазу.
Встановлено позитивний вплив йонiв Кобальту на бiлковий, вуглеводний, лiпiдний та мiнеральний обмiни, а також на обмiн аскорбiнової кислоти та синтез вiтамiну РР (нiацину).
Залежно вiд вмiсту в бiосистемах, Кобальт може виступати як активатор так i iнгiбiтор тих ферментних систем, в основi функцiонування яких лежать окисно-відновні процеси.
Ион Кобальту(ІІ) утворює складний хелатний бiокомплекс цiанокобаламiн, або вiтамiном В12, який є ефективним протианемiчним засобом, оскiльки вiн iстотно впливає на утворення еритроцитiв та синтез гемоглобiну кровi (гемопоез). У достатнiй кiлькостi цей вiтамiн надходить до органiзму з мʼясними та молочними продуктами (добова потреба 2 мкг). Внаслiдок порушения його всмоктування виникає. мегалобластична (В12-дефiцитна) анемiя. Ознаки цього захворювання звʼязанi з недокрiвʼям, ураженням нервової системи та травного каналу.
Надлишок Кобальту в органiзмi теж шкiдливий, оскiльки йони Кобальту сповiльнюють адсорбцiю йонiв Fe(II), блокуючи йога транспортнi системи. Внаслiдок цього виникає полiцитемiя − захворювання кровi, що характеризуеться збiльшенням кiлькостi еритроцитiв та гемоглобiну.
Кобальт ефекивно дiє на бiосистеми за наявносri в органiзмi достатнiх запасiв Феруму та Купруму. Пiд впливом Кобальту пiдвищусrься всмоктування Феруму i використання його в процесах утворення гемоглобiну.
Молiбден(Мо) є одним iз важких металiв (атомна маса 95,9 а.о.м.), виявлених в органiзмi людини. Вiдповiдно до електронної конфiгурацiї [Kr]4d55s1, у бiосистемах мiститься у виглядi йонiв Мо+5 , Мо+6 i рiдше Мо+4 та Мо+3.
Основна бiологiчна функцiя, яку виконує цей мiкроелемент, полягає у звʼязуваннi неорганiчного азоту. Звʼязаний азот використовується в процесах бiосинтезу бiлкiв, нуклеїнових кислот, ферментiв та iн.
Вищi тварини не здатнi синтезувати деякi амiнокислоти, так званi незамiннi амiнокислоти (лейцин, iзолейцин, лiзин, валiн, гiстидин, фенiлаланiн та iн.). Вони також не можуть використовувати азот iз природних джерел, зокрема повiтря (78 % об. N2) та грунтiв, що мiстять нiтрат-iони NО3−. Цю функцiю виконують рослини та деякi мiкроорганiзми. Процес засвосння азоту (його називають бiологiчною асимiляцiєю) здiйснюється у двi стадії: вiдновлення нiтрат-iона до нiтриту за участю ферменту нiтраторедуктази (реакцiя 1) i вiдновлення останнього до амоніаку за наявностi нiтрогенази (реакцiя 2):
NО3− + Н2О + 2ē → NО2− + 2ОН− (1)
NО2− + 5Н+ + 6ē → NН3 + 2ОН− (2).
Обидва ферменти, що беруть участь у цих процесах, мiстять у складi молекул Молiбден.
Нiтрогеназа iз Azotobacter – це перший металофермент, в якому було виявлений Молiбден. Вона складасrься з двох рiзних бiлкiв: Мо-Fе-бiлка з молекулярною масою близько 30 000 i Fе-бiлка з молекулярною масою близько 40 000. Перший бiлок мiститъ Молiбден, Ферум, цистеїн i лабiльну сiрку у спiввiдношеннi 1:20:20:15. Його акивний центр має структуру "клiтки" та побудований аналоriчно до "клiтки" ферредоксину, в якiй один атом Феруму замiщений на Молiбден.
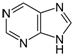 один з пуринів
один з пуринів
Молiбден входить до складу ксантиноксидази та деяких ензимiв флавонової групи. Вони беруть участь у метаболiзмi пуринiв та засвоеннi азоту. Слiд зазначити, що в малих дозах Молiбден позитивно впливає на синтез гемоглобiну та сприяє накопиченню в органiзмi вiтамiнiв С i В12.
Дуже важливим чинником є баланс Молiбдену в органiзмi. У мiкродозах його сполуки, пiдсилюючи фагоцитарну активнiсть кровi, впливають на iмунний захист органiзму. При пiдвищеннi рiвня Молiбдену порушується пуриновий обмiн i розвивається ендемiчна подагра, яка звʼязана з утворенням і відкладенням солей сечової кислоти в тканинах, що призводить до деформування суглобiв.
Добова потреба органiзму в Молiбденi менша порiвняно з iншими бiометалами i становить приблизно 0,1-0,3 мг.
Доведено, що бiологiчна роль Молiбдену тiсно повʼязана з вмiстом в органiзмi Купруму. Цi елементи є антагонiстами, оскiльки надлишок Молiбдену викликає зменшення концентрацiї Купруму. Антагонізм мiкроелементiв, зокрема Mo-Cu, використовують у терапевтичнiй практицi. Для зменшення токсичної дiї Молiбдену в органiзм вводять розчиннi солi Купруму, що призводить до утворення малорозчинної солi купрум молiбдату CuMoO4 i виведення останнього з органiзму.
Хром (Cr). Цей бiоелемент, що за вмiстом в органiзмi належить до мiкроелементiв, вiдiграє важливу роль у функцiонуваннi бiосистем. Вiн впливає на обмiн вуглеводiв, лiпiдiв та нуклеїнових кислот, активує дiю iнсулiну, входить до складу ферментiв трипсину i трансферину.
Доведено, що вмiст Хрому у кровi знижується при старiннi або виснаженнi органiзму. Полiпшуючи загальний обмiн речовин, його сполуки сповiльнюють процес старiння органiзму. Це було доведено дослiдами на тваринах. Тварини, яким до кормів додавали сполуки тривалентного Хрому, жили довше, нiж тварини контрольних груп.
У медичнiй практицi для лiкування дiабету використовують хрому пiколiнат, який додають до комплексних препаратiв з мiкроелементами та вітамінами.
Серед вiдомих сполук Хрому у малих дозах найменш токсичними є сполуки Cr(ІІІ), сполуки Cr(VI) − хромати Me2CrО4 та дихромати Me2Cr2О7 (Ме-елемент І групи перiодичної системи) є токсичними. Добова потреба Хрому становить 0,05-2,5 мг. Багатi на Хром чай, шпинат, оселедець, вівсяна крупа, печінка, яловичина. Надлишок цього елемента в органiзмi викликає пошкодження легеневої тканини та розвиток злоякiсних пухлин.
Нiкель (Ni). Найбiльший вмiст цього бiоелемента виявлено у пiдшлунковiй залозi, печiнцi, шкiрi та рогiвцi ока. Загальний вмiст Нiкелю в органiзмi становить приблизно 2×10−6 % мас.
Бiологiчна роль цъого мiкроелемента була встановлена нещодавно, коли його вперше виявили у складi ферменту уреази, що каталiзує розкладання сечовини на амонiак i вуглекислий газ. Крiм того, Нiкель виступає активатором таких ферментiв, як ангiдраза, карбоксилаза, трипсин. Вiн прискорює регенерацiю бiлкiв, полiпшує процес пiгментацiї ·шкiри, впливає на обмiн вуглеводiв та морфологiю кровi, оскiльки нормалiзує в нiй вмiст гемоглобiну.
Вмiст Нiкелю у кровi людини зменшуеться з вiком i при анемiях. Проте його рiвень майже вдвоє пiдвищується при iнфарктi мiокарда, що може бути додатковим дiагностичним критерiєм цього захворювання.
Ванадiй (V) − ще недостатньо вивчений елемент. В органiзмi дорослої людини мiститься приблизно 10-25 мг Ванадiю, що вiдповiдае масовiй частцi 5·l0−5 мас.%. Бiльша частина Ванадiю входить до складу кiсток, зубiв та жирової тканини. Видiлений металопротеїн − гемованадин, який складається з однiєї субодиницi i мiстить цей хiмiчний елемент. Вважають, що гемованадин може виконувати функцiю звʼязування кисню, причому в ролi групп, що приєднує кисень, виступає йон Ванадiю.
Титан (Ti) постiйно мiститься у тканинах (загальний вмiст в органiзмi 10−6 мас.%) i концентрується переважно в печiнцi та залозах внутрiшньої секрецiї (щитоподiбна залоза, наднирники). Цей мiкроелемент, як i Ванадiй, бере участь у формуваннi кiсток, впливає на збiльшення кiлькостi еритроцитiв у кровi, активує процес синтезу гемоглобiну, проте його бiологiчна роль до кiнця ще не зʼясована.
Кадмiй (Cd) мiститься в органiзмi у малих кiлькостях, переважно концентрується в нирках та печiнцi. Вiн входить до складу деяких ферментiв, зокрема iмiдодипептидази, активує такi ферменти, як аргiназа та амiлаза. Проте дiю бiльшостi ферментних систем Кадмiй гальмує, особливо редуктази. У бiльших дозах Кадмiй отруйний, оскiльки пошкоджус клiтини нирок та печiнки, виклає утворення злоякiсних пухлин. Вiднесення його до бiогенних елементiв є сумнiвним.
При нестачі мікроелемекнтів необхідно приймати медичні препарати, якi здавна використовують у медичнiй практицi, або комплексні лiкарськи засоби, що мiстять вiтамiни з мiкроелементами. Ними є, наприклад, суміш «Мінерал», Прегнавіт, "Мульти-табс" , що мiстить 7 мiкроелементiв (Fe, Zn, Cu, Mn, Cr, I, Se) та 11 рiзних вiтамiнiв, краплi "Береш-Плюс'', у складi яких 5 макроелементiв i 9 мiкроелементiв,, "Дуовiт" − мiстить Магнiй, Кальцiй, Ферум, Цинк, Купрум, Манган, Молiбден i 11 вiтамiнiв.
Найповнiший асортимент,необхiдних для органiзму макро- i мiкроелементiв та вiтамiнiв, мiстить препарат "Вiтрум" (фiрми Uniphaпn, США), оскiльки у формi рiзних хiмiчних сполук що засвоюються органiзмом, вiн мiстить йони таких металiв: Са, Mg, К, Fe, Zn, Cu, Mn, Мо, Cr, Ni, V, Sn та неметалiв: Р, Cl, I, Se, В, Si, а також препарати "Активан'' − вiтамiно-мiнеральний комплекс (мiстить 31 компонент) та 'Церавiта'' (18 мiкро- i макроелементiв).
Контрольнi запитання та завдання
1. Електронні структури атомів та стійких йонів біоактивних d-металів. Основні ступені окиснення для елементів IVперіоду та Мо. Записати електроннi структури йонiв: Cr3+, Mn2+, Мо6+.
2. Особливості будови атому Цинку.
3. Основні типи реакцій, характерні для d-металів.
4. Розчинність та біологічне значення розчинності сполук d-металів у воді.
5. Кислотно-основні властивості d-металів у нижчих с.о. Властивості оксидів та відповідних їм гідратів. Приклади.
1. Кислотно-основні властивості d-металів у вищих с.о. Властивості оксидів та відповідних їм гідратів. Приклади.
2. Протолітичні реакції d-металів.
3. Амфотерні властивості сполук Цинку, Хрому, Феруму. Записати характерні реакції.
4. Реакції гідролізу солей d-металів за катіоном, за катіоном та аніоном. Біологічне значення гідролізу.
5. Скласти йоннi рiвняння реакцiй гiдролiзу солей: FеС13, CuSO4, Zn(NО3)2, Cr2S3.
6. Роль окисно-відновних реакцiй у бiологiчних процесах.
7. Відновні властивості d-металів у нижчих ступенях окиснення.
8. Окисні властивості d-металів у вищих ступенях окиснення.
9. Знаходження коефіцієнтів в окисно-відновних реакціях методом електронного балансу.
10. Характеристика окисно-відновної здатності біометалів за допомогою стандартних потенціалів. Термодинамічна можливість ОРВ, розрахунок ЕРС.
11. Реакції комплексоутворення сполук d-металів у воді. Пояснити на основi електронних та електронографічних фіормул величину координацiйного числа йонiв d-металів.
12. Аквакомплекси, неорганічні та біоорганічні комплекси d-металів.
13. Біоорганічні комплекси Феруму. Будова та властивості гемоглобіну, міоглобіну, їх біологічна функція. Механiзм звʼязування кисню гемоглобiном. Наслiдки зниження рiвня Феруму в кровi людини. Використання лiкарських мiстять Ферум та критерiї їх ефективностi.
14. Схематична будова та біологічні функції цитохромів.
15. Ферум-сульфуровмiснi бiлки. Особливiсті будови Fе-S*-бiлкiв.
16. Біологічна функція феритину та трансферрину.
17. Значения сполук Ферум для органiзму людини.
18. Бiологiчна роль Купруму, основні бiокомплекси та їх функції, що мiстять цей елемент. Захворювання при дефiциті i надлишку у органiзмi Cu.
19. Бiологiчна роль Цинку, основні бiокомплекси та їх функції, що мiстять цей елемент.
20. Бiогенні сполуки та функції Мангану, Молiбдену, Хрому. Добовi потреби цих елементiв.
21. Приклади ферментів, що мiстять у своему складi по два мiкроелементи. Назвати цi елементи i вказати їx бiологiчну роль.
22. Процеси в органiзмi, повʼязані з бiологiчною роллю Кобальту. Як вiн впливає на засвоєння органiзмом Феруму та у виглядi яких сполук застосовується в медицинi?
23. Склад молекула та функції, біологічна роль вiтамiну В12. Наслiдки зменшення необхiдноrо рiвня його у органiзмi.
24. Синергiзм мiкроелементiв. З якими хiмiчними елементами повʼязане це явище?
25. Як змiнюється вмiст Хрому в кровi при старiннi i виснаженнi органiзму та рiвень Нiкелю при iнфарктi мiокарда?
26. Чому баланс макро- i мiкроелементi в в органiзмi є важливим чинником його нормального функцiонування? За рахунок чого цей баланс має постiйно пiдтримуватись?
27. Для яких мiкроелементiв iснує найменша межа мiж позитивним i негативним впливом на живi системи? Чи використовують сполуки таких хiмiчних елементiв у медицинi?
28. Назвiть найважливiшi неорганiчнi лiкарськi препарати з родини d-елементiв, вкажiть їx хiмiчний склад.
29. Якi мiкроелементи повиннi входити до складу харчових добавок з метою профiлактики рiзних захворювань?
