Роль вільнорадикального окиснення і ліпідної пероксидації у патогенезі захворювань мозку та онкологічних захворювань
Мета:з’ясувати особливості протікання вільнорадикальних процесів та перекисного окиснення ліпідів в патогенезі захворювань мозку та на злоякісні утворення. Опанувати методику визначення вмісту глютатіону.
Основні поняття:патогенез, окислювальний стрес, гострий ішемічний інсульт головного мозку, онкологічні захворювання
Питання для теоретичної підготовки:
- Особливості процесів перекисного окиснення ліпідів в патогенезі канцерогенезу
- Антиоксидантні ферменти і ракові пухлини
- Особливості процесів перекисного окиснення ліпідів в патогенезі захворювань мозку
- Окислювальний стрес і головний мозок
Хід роботи:
Принцип методу: глютатіон відновлений взаємодіє з 5,5’-дитіо-біс-(2-нітробензойної) кислотою (ДТНБК) при рН 8,0, утворюючи продукт та тіонітрофенильний аніон. Останній має жовто-помаранчеве забарвлення та коефіцієнт молярної екстинкції при 412 нм 11400 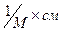 , а кількість його молей дорівнює числу молей сульфгідрильних груп, які прореагували.
, а кількість його молей дорівнює числу молей сульфгідрильних груп, які прореагували.
Хід визначення: у штативі розміщали центрифужні пробірки, кількість пробірок відповідає кількості проб, що підлягають аналізу. У пробірки вносили гомогенат серця (0,1 г органу + 2,4 мл 30% трихлороцтової кислоти). Добре перемішували скляною паличкою. Через 10 хв. центрифугували впродовж 15 хв. при 3000 об/хв. У чисті сухі, пронумеровані центрифужні пробірки відбирали 0,2 мл надосадової рідини (для визначення відновленої форми глютатіону). До об’єму, який залишився додавали цинкового порошку на кінчику скальпеля (для переходу окисненої форми у відновлену). Перемішували скляною паличкою. Через 10 хв. фільтрували у чисті пробірки та відбирали 0,2 мл фільтрату (для визначення загальної форми глютатіону). До 0,2 мл відібраних проб відновленої та загальної форми глютатіону додавали 0,05 мл 20% розчину гідроксиду натрію та 5,0 мл трис-буферного розчину (рН 8,05), ретельно перемішували скляною паличкою. Перевіряли рН проби, якщо було потрібно, доводили рН до 8,05 слабим розчином соляної кислоти або гідроксидом натрію (якщо рН<8,0 реакція не відбувається, якщо рН>8,1 проходить лужний гідроліз ДТНБК до тіонітрофенільного аніона, що завищує результати). У пробірки додавали 0,1 мл реактиву Елмана (99 мг ДТНБК у 25 мл 96% етанолу). Перемішували, витримували 20 хв. при температурі 37ºС. Вимірювали оптичну густину розчинів у кюветі з довжиною оптичного шляху 10 мм при довжині хвилі 412 нм проти контролю на реактиви. Розрахунок проводили за стандартним графіком. Для побудови графіка готували розчин глютатіону, відновленого концентрацією 10 ммоль/л. У пронумеровані пробірки вносили розчин глютатіону – 0 мл (0 ммоль/л), 0,05 мл (5 ммоль/л), 0,1 мл (10 ммоль/л), 0,2 мл (20 ммоль/л), добавляли 5,2 мл трис-буферного розчину (рН 8,05) та 0,1 мл реактиву Елмана. При цьому враховували хід визначення глютатіону та внесення розчинів при визначенні рН проби. Якщо показники екстинкції були великі, то проби розбавляли трис-буферним розчином та вимірювали екстинкцію.
Контрольні питання:
1. Роль глютатіону в окислювальному стресі
2. Особливості процесів перекисного окислення ліпідів в патогенезі захворювань головного мозку
3. Перифокальне запалення.
1. Некроз і апоптоз клітин
2. Сутність онкологічних захворювань і роль в їхньому патогенезі АФК
3. Антиоксидантні ферменти і головний мозок
Тестові питання:
1. Дефіцит кисневого та субстратного забезпечення в тканинах головного мозку і корі викликає:
А) зменшення рівня цАМФ
б) накопичення НАДН
в) різке збільшення рівня цАМФ
г) синтез АТФ
2. В результаті зменшення кількості потрапляння кисню до мозкової тканини при ішемії відбуваються наступні зміни:
