Пептидазалар (пептидгидролазалар) 7 страница
2) субстратқа бір атом оттегін
3) аралық субстратқа тек электрондарды
4) аралық субстратқа протондарды (электрондарды)
5) протондарды (электрондарды) тікелей оттекке
8. МОНООКСИГЕНАЗАЛАР МЕН ДИОКСИГЕНАЗАЛАРДЫҢ ЖАТАТЫН КЛАСЫ
1) лиазалар
2) лигазалар
3) гидролазалар
4) изомеразалар
5) трансферазалар
6) оксидоредуктазалар
9. ЦИТОХРОМДАР ТАСЫМАЛДАЙДЫ
1) электрондарды
2) протеиндерді
3) сутек атомдарын
4) оттек атомдарын
10. КАТАЛАЗА КАТАЛИЗДЕЙТІН РЕАКЦИЯЛАР
1) тотығу-тотықсыздану
2) фенилаланиннің гидроксилденуі
3) сутек пероксидімен сутек пероксидін тотықтыру
4) сутек пероксидін молекулалық оттекпен тотықтыру
5) сутек пероксидін молекулалық оттек пен суға ыдырату
11. СУТЕК ПЕРОКСИДІНІҢ КӨМЕГІМЕН ӘРТҮРЛІ ЗАТТАРДЫ ТОТЫҚТЫРАТЫН ФЕРМЕНТТЕР
1) каталаза
2) оксидазалар
3) цитохромдар
4) пероксидазалар
5) дегидрогеназалар
12. ОКСИДОРЕДУКТАЗА КЛАСЫНА ЖАТПАЙДЫ
1) оксидазалар
2) цитохромдар
3) изомеразалар
4) карбоксилазалар
5) дегидрогеназалар
13. ФЕРМЕНТТЕРДІҢ КЛАСЫ ХАЛЫҚАРАЛЫҚ КЛАССИФИКАЦИЯ БОЙЫНША
ТӘРТІППЕН ОРНАЛАСАДЫ:
1) Оксидоредуктазалар, гидролазалар, лигазалар, лиазалар, трансферазалар, изомеразалар
2) Трансферазалар, гидролазалар, оксидоредуктазалар, изомеразалар, лиазыалар, лигазалар
3) Гидролазалар, оксидоредуктазалар, трансферазалар, лиазалар, изомеразалар,л игазалар
4) Оксидоредуктазалар, трансферазалар, гидролазалар, изомеразалар, лигазалар, лиазалар
5) Оксидоредуктазалар, трансферазалар, гидролазалар, лиазалар, изомеразалар, лигазалар
№ 12 Текст
Дегидрогеназалар
Пиридиндік ферменттер (ПФ)
Пиридиндік ферменттердің құрылысы
Пиридиндік ферменттер (ПФ)– апофермент (белок) пен коферменттен тұратын екі компонентті ферменттер.
Пиридиндік ферменттердің коферменттері
Пиридиндік ферменттердің коферменттерінің құрамына НАД+(никотинамид-адениндинуклеотид) немесе НАДФ+ (никотинамидадениндинуклеотидфосфат) кіреді.
Ал коферменттердің құрамында РРвитамині болады (никотинамид немесе ниацин деп аталады). Апофермент пен коферменттің арасындағы байланыс әлсіз, олар мырыш арқылы байланысады. Ерітіндіде әрқашан қайтымды ПФ ↔ апофермент + кофермент (НАД+, НАДФ+) тепе-теңдік болады:
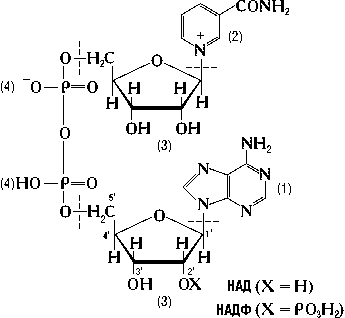
НАД+ тың құрамына аденин (1), никотин қышқылының амиді (2), рибозаның екі қалдығы (3) және фосфор қышқылының екі қалдығы (4) кіреді. Екінші маңызды кофермент – никотинамидадениндинуклеотидфосфаттың ( НАДФ+), молекуласында рибозаның (3) 21 –көміртек атомына байланысқан фосфор қышқылының тағы да бір қалдығы болады.
Пиридиндік ферменттердің әсер ету механизмі
НАД қа тәуелді дегидрогеназалар заттардың (субстраттың) тотығу реакцияларын дегидрлеу арқылы катализдейді, тотығатын зат сутектің доноры болады, ал НАД+ сутектің акцепторы болады, яғни ол тотықсызданады. Тотығу-тотықсыздану реакцияларына пиридиннуклеотидтік коферменттің тек никотинамидтік сақинасы ғана қатысады (РР).
Тотыққан жағдайда сақина ароматты болады және оң зарядқа ие болады. Осы себептен коферменттерді НАД+ немесе НАДФ+ деп белгілейді, зарядтары арқылы олар апоферментті байланыстырады.
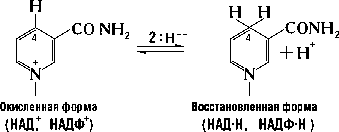
Субстрат-Н2(SH2)+ НАД(Ф)+ ↔ Субстрат(S)+ НАД(Ф)Н + Н+
Пиридиндік ферменттердің коферменттері НАД+ и НАДФ+ тотығатын субстраттардан сутекті тікелей бөліп алу арқылы катализдейдейтін болғандықтан оларды біріншілік дегидрогеназаларға жатқызады. Тотығу кезінде НАД+ субстраттан (SH2) екі атом сутекті бөліп алады[яғни екі электрон мен екі протонды ]. Бірақ НАД+қа тек гидрид- ион барады (H-, екі электрон мен бір протон). Никотин қышқылы амидінің 4-ші жағдайындағы көиіртек атомы гидрид-ионның акцепторы болады. Бұл жерде СН2 –алифатты топ пайда болады да сақинадағы қос байланыстардың орны өзгереді, оң заряд жоғалады. Екінші протон сулы ортаға шығады, сондықтан тотықсызданған кофермент НADH2 емес НADH + H+ деп белгіленеді. НАД+ тотықсызданғанда оның апоферментпен байланысы үзіледі. Апофермент басқа тотыққан НАД+ пен байланысады. НАД қа тәуелді дегидрогеназалар митохондрия-ларда болады. Тотықсызданған ПФның дегидрогеназалары сутекті флавиндік ферменттерге береді. Ферменттің субстраттық арнайылығы оның белоктық бөлігіне тәуелді болады.
ПФ(НАД) ның биологиялық рөлі
НАД-қа тәуелді дегидрогеназалар негізінен мынандай процестерге қатысады:
1) Жасушалық тынысалу (биологиялық тотығу);
2) Гликолиз (аэробты, анаэробты);
3) α-кетоқышқылдарының тотығудан декарбоксилденуі;
4) Үшкарбон қышқылдарының циклі (ҮКЦ).
ПФ(НАД) ның өкілі - ЛДГ
Лактатдегидрогеназа (ЛДГ) сүт қышқылының қайтымды пирожүзім қышқылына дейін тотығуын катализдейді:
ЛДГ
СН3-СНОН – СООН + НАД+ ↔ СН3- СО-СООН + НАДН + Н+
Сүт қышқылы Пирожүзім қышқылы
ЛДГнің диагностикалық маңызы
Анаэробты зат алмасу процестерінде (бауыр, қаңқа бұлшық еттерінде) негізінен ЛДГ4,5 болады, онда ол сүт қышқылының және екі молекула АТФтің түзілуін катализдейді. Қанның сарысуында аурудың диагнозын ЛДГнің белсенділік деңгейін анықтау арқылы білуге болады. Мысалы, ЛДГ1,2 белсенділігінің артуы миокард инфарктысында байқалады; ЛДГ4,5 артуы– бауыр ауруында (гепатит, цирроз) байқалады ( теорияның 2.11 тарауын қараңыз).
НАДФ+тің биологиялық рөлі
НАДФ-ке тәуелді дегидрогеназалар биологиялық тотықсыздану синтетикалық реакцияларына қатысады: 1)ксенобиотиктердің гидроксилденуі; 2) пентозофосфаттық циклде; 3) май қышқылдарының β- тотығуы мен синтезіне; 4)холестерин мен стероидтардың синтезі мен гидроксилденуіне. НАДФН2– жасушалардағы энергияны сақтаудың екінші түрі, усыздандыру процестеріне қатысады. НАДФ-ке тәуелді дегидрогеназалар цитоплазмаларда болады.
ПФ(НАДФ)ның өкілдері
Митохондрияда ҮКЦда түзілген малат жасушаның цитозоліне ауысуы мүмкін. Цитозольде. NADP-ке тәуелді дегидрогеназа (малик фермент)бар, ол малаттың тотығудан декарбоксилдену реакциясын катализдейді:
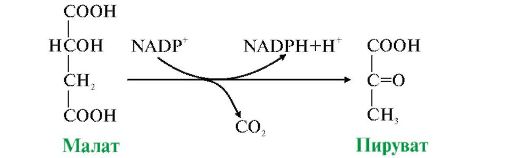
Бұл реакция NADPH тың түзілуінің маңызды көздерінің біріне жатады, одан басқа ол глюкозаның пентозофосфаттық жолмен тотығуында түзіледі.
НАДР-ке тәуелді дегидрогеназаларға изоцитратдегидрогеназа, глюкозо-6-фосфатдегидрогеназа, 6-фосфоглюконатдегидрогеназа, еноилредуктаза және басқалары жатады. Изоцитратдегидрогеназа - ҮКЦдегі ең баяу фермент. Фермент АДФ пен Са2+ дің көмегі арқылы аллостерикалық жолмен белсендіріледі. Және де изоцитрат-дегидрогеназаның белсенділігі NADH-NAD+ тың қатынасына тәуелді болады:
Изоцитрат + NAD+ → α-Кетоглутарат + СО2 + NADH + Н+
«Сіздің назарыңызға бір, екі, үш және одан да көп дұрыс жауаптары бар тапсырмалар ұсынылады. Дұрыс жауаптарды түгел дөңгелектеңіздер.
1.ПИРИДИНДІК ДЕГИДРОГЕНАЗАЛАРДЫҢ ҚҰРАМЫНА КІРЕДІ
1) кофермент
2) апофермент
3) мырыш ионы
4) РР витамині
5) В2 витамині
2. ПИРИДИНДІК ФЕРМЕНТ ТЕРДІҢ КОФЕРМЕНТТЕРІ БОЛА АЛАДЫ
1) Mg2+
2) НАД+
3) ФМН
4) НАДФ+
3.АПОФЕРМЕНТ ПЕН КОФЕРМЕНТ БІР – БІРІМЕН БАЙЛАНЫСАДЫ
1) мырыш ионы
2) РР витамині
3) НАД+
4) Mg2+ арқылы
4.НАД+ ТЫҢ ҚҰРАМЫНА КІРЕДІ
1) цитозин
2) никотин қышқылының амиді
3) көмірсу- рибозаның екі қалдығы
4) фосфор қышқылының екі қалдығы
5) көмірсу- рибозаның бір қалдығы
5. ЖАСУШАДАҒЫ АНАЭРОБТЫ ЗАТ АЛМАСУЫНДА ТОТЫҒУ ПРОЦЕСІ МЫНАНДАЙ ШАРТТАРДЫҢ ОРЫНДАЛУЫ АРҚЫЛЫ ЖҮРЕДІ
1) гидроксилазалардың қатысы
2) субстраттың дегидрленуі
3) оттекті субстратқа байланыстыру
4) диокситуындыларының түзілуі арқылы әрекеттесу
6. БІРІНШІЛІК ДЕГИДРОГЕНАЗАЛАР
1) субстратқа бір атом сутекті байланыстырады
2) субстратқа екі атом сутекті байланыстырады
3) флавиндік дегидрогеназалардан электрондарды алады
4) субстраттан тікелей сутек атомдарын үзіп алады
7. ГИДРИД-ИОННЫҢ АКЦЕПТОРЫ
1) аденин
2) рибоза
3) фосфодиэфирлік байланыс
4) никотин қышқылы амидінің көміртек атомы
8. НАД+ТЫҢ ТОТЫҚСЫЗДАНУЫНАН
1) апоферментпен байланыс үзіледі
2) бір протон ерітіндіге ауысады
3) никотинамидтің оң заряды жоғалады
4) апофермент тотыққан НАД+тың басқа молекуласымен байланыспайды
9. ТОТЫҚСЫЗДАНҒАН ПФ ДЕГИДРОГЕНАЗАЛАР БЕРЕДІ
1) электрондарды оттекке
2) электрондарды убихинонға
3) электрондарды цитохромдарға
4) сутек атомдарын флавиндік ферменттерге
10. ПИРИДИНГЕ ТӘУЕЛДІ ДЕГИДРОГЕНАЗАЛАР ОРНАЛАСАДЫ
1) цитозольде
2) лизосомаларда
3) митохондрияларда
4) цитозоль мен митохондрияларда
11. ПФ ФЕРМЕНТІНІҢ СУБСТРАТТЫҚ АРНАЙЫЛЫҒЫ ТӘУЕЛДІ
1) коферментке
2) апоферментке
3) кофермент пен апоферменттің байланыстылығына
12. НАД-ҚА ТӘУЕЛДІ ДЕГИДРОГЕНАЗАЛАР ҚАТЫСАТЫН ПРОЦЕСТЕР
1) ҮКЦ
2) гликолиз
3) β- тотығу
4) жасушалық тынысалу
5) май қышқылдарының гидролизі
13. ПИРУВАТТЫҢ ӨЗГЕРІСІНЕ НАДH2 ҚАТЫСҚАНДА ТҮЗІЛЕДІ
1) лактат
2) ацетил-КоА
3) оксалацетат
4) фосфоенолпируват
14. НАДФ-КЕ ТӘУЕЛДІ ДЕГИДРОГЕНАЗАЛАР ҚАТЫСАДЫ
1) усыздану реакцияларына
2) пентозофосфаттық циклге
3) тотықсыздану реакцияларына
4) ксенобиотиктердің гидроксилденуінде
15. ТІЗБЕКТІ ТАПСЫРМАНЫ ОРЫНДАҢЫЗ:
МИОКАРД ИНФАРКТІСІН АНЫҚТАУДАҒЫ ЭНЗИМОДИАГНОСТИКАДА АНЫҚТАЛАТЫН ФЕРМЕНТТІҢ БІРІ
1) қышқылдық фосфатаза
2) лактатдегидрогеназа
3) амилаза
БҰЛ ФЕРМЕНТТІҢ ЖАТАТЫН КЛАСЫ
1) гидролаза
2) лигаза
3) оксидоредуктаза
ОСЫ КЛАСТЫҢ КОФЕРМЕНТТЕРІНІҢ БІРІ
1) пиридоксальфосфат
2) биотин
3) NAD+
БҰЛ КОФЕРМЕНТТІҢ ВИТАМИНІНЕ ЖАТАДЫ
1) никотин қышқылы
2) пиридоксин
3) биотин
№ 13 Текст
Флавиндік ферменттер (ФП)
Флавиндік ферменттердің құрамы
Флавиндік (флавопротеиндер – ФП) деп аталатын екі компонентті ферменттер.
Коферменттерінің құылысы
Простетикалық тобы (коферменті) - рибофлавин (В2 витамині) апоферментпен мықты байланысқан. Бұл фермент тобының екі түрлі коферменті болады:флавинмононуклеотид (ФМН) және флавинадениндинуклеотид (ФАД). ФМН (рибофлавин-5-фосфат) құрамында гетероциклді азотты негіз – диметилизоаллоксазин, рибитол (рибозаның туындысы) спирті және фосфат болады:
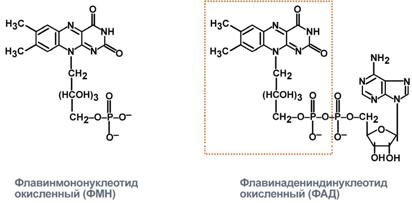
ФАД тың құрамында ФМНнен басқа тағы бір нуклеотид — аденозинмонофосфат (АМФ)болады:
Дегидрогеназалардың әсер ету механизмі
ФМН мен ФАД субстраттардан екі протонды үзіп алып, электрондарды анаэробты дегидрогеназалардан әртүрлі акцепторларға (К0Q, цитохромдарға),сонымен қатар тікелей оттекке беруді катализдейді. Тотықсызданған сутекті тасымалдаушылармен, мысалы НАДH пен реакциясы төмендегідей жүреді:
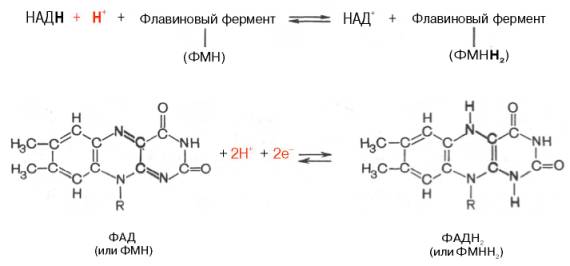
Изоаллоксазин сақинасы ФМН мен ФАД тағы электрондар мен протондарды қосып алатын немесе беретін белсенді топқа жатады. Изоаллоксазин сақинасының тотықсыздануы нәтижесінде 2 протон мен 2 электронның бірдей қосылуы жиі байқалады. Изоаллоксазин сақинасындағы қатарлас қос байланыс үзіліп бір байланысқа айнаалады, 1 мен 10 (N1 және N10) дағы азоттың валенттілігі босайды да, соларға сутек атомдары байланысады.
Флавиндік коферменттер тотыққан күйде қанық сары түсті болады, ал тотықсызданған күйде түссізденеді. ФМН мен ФАД белоктық апоферменттермен мықты байланыста болады.
Биологиялық рөлі
ФМН екіншілік дегидрогеназаларға жатады, себебі тотыққан субстраттың рөлін органикалық қышқылдар емес, тотықсызданған НАДН орындайды. ФАД қа тәуелді ФП біріншілік дегидрогеназаларға жатады, себебі олар субстраттан тікелей сутек атомдарын үзіп алады. Аэробты дегидрогеназалардың электрондарының донорлары – анаэробты дегидрогеназалар, ал акцепторлары -хинондар, цитохромдар , оттек болып табылады.
ФП(ФАД)тың өкілдері
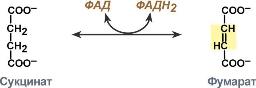
1) Сукцинатдегидрогеназа (СДГ) –сукцинаттан(янтар қышқылы) сутек атомдарын үзіп алып фумараттың (фумар қышқылы)түзілуін катализдейді:
2) Ксантиноксидаза–молибдені бар оксидоредуктаза, гипоксантинді ксантинге дейін және ары қарай ксантинді зәр қышқылына дейін тотықтыруды тездетеді, нәтижесінде қосымша сутек пероксиді түзіледі:
гипоксантин + O2 + H2O <-> ксантин + H2O2
ксантин + O2 + H2O <-> зәр қышқылы + H2O2
Сутек флавопротеиндерден бірден оттекке берілуі мүмкін, сол кезде сутек пероксиді түзіледі. Сутек пероксиді каталазаның әсерінен су мен оттекке дейін ыдырайды. Сондықтан мұндай флавин ферменттерін аэробты дегидрогеназаларға жатқызады және оксидазалар деп атайды. Бұл топтың ферменттеріне полифенолоксидаза, аскорбинатоксидаза, глюкозоксидазаларды жатқызады. Биогендік аминдердің оксидазалары: моноаминооксидаза (МАО), диаминооксидаза (ДАО), полиаминооксидазалар да осы топқа жатады.
«Сіздің назарыңызға бір, екі, үш және одан да көп дұрыс жауаптары бар тапсырмалар ұсынылады. Дұрыс жауаптардың нөмірлерін түгел қоршаңыздар»
1.ФЛАВИНДІК ДЕГИДРОГЕНАЗАЛАР
1) бір компонентті
2) екі компонентті
2. ФЛАВИНГЕ ТӘУЕЛДІ ДЕГИДРОГЕНАЗАЛАРДЫҢ ҚҰРАМЫНА КІРЕДІ
| 1) 1) В1 – тиамин 2) 2) В2 – рибофлавин 3) 3) РР – никотин қышқылы 4) 4) С – аскорбин қышқылы 5) |
3. АЭРОБТЫ ДЕГИДРОГЕНАЗАЛАРДЫҢ ЖАТАТЫН КЛАСЫ
1) лиазалар
2) гидролазалар
3) трансферазалар
4) оксидоредуктазалар
4. ФЛАВИНМОНОНУКЛЕОТИД ДЕГЕН
1) В2 витамині құрамында болады
2) НАДқа электрондарын береді
3) НАДНтан сутекті алудың акцепторы
4) малатдегидрогеназалардың коферменті
5. СУТЕК АТОМДАРЫНЫҢ ТІКЕЛЕЙ АКЦЕПТОРЫ БОЛАТЫН ФАД ТЫҢ КОМПОНЕНТІ
1) рибоза
2) аденин
3) фосфат
4) рибофлавин
5) изоаллоксазин сақинасы
6. АКЦЕПТОР РЕТІНДЕ ОТТЕКТІ ПАЙДАЛАНАТЫН ДЕГИДРОГЕНАЗАЛАРДЫҢ КОФЕРМЕНТІ
1) пиридоксальфосфат
2) флавинадениндинуклеотид
3) тетрагидрофоль қышқылы
4) никотинамидадениндинуклеотид
5) никотинамидадениндинуклеотидфосфат
7. ЭЛЕКТРОНДАР МЕН ПРОТОНДАРДЫ ТАСЫМАЛДАУҒА ҚАТЫСАТЫН КОФЕРМЕНТ
1) гем.
2) ФАД.
3) ФМН
4) гем + Сu2+
8. ҚҰРАМЫНДА ФАД БАР ТЫНЫСАЛУ ТІЗБЕГІНЕ ҚАТЫСАТЫН ФЕРМЕНТ
1) цитохромоксидаза
2) малатдегидрогеназа
3) К0QH2-дегидрогеназа
4) сукцинатдегидрогеназа
9. АЭРОБТЫ ДЕГИДРОГЕНАЗЫАЛАР
1) НАД+ және ФАД
2) ФАД және ФМН
3) НSКоА және ФАД
4) НАД+ және НАДФ+
10. ТЫНЫСАЛУ ТІЗБЕГІНДЕ ЭЛЕКТРОНДАРДЫҢ БІРІНШІЛІК АКЦЕПТОРЫ БОЛЫП ТАБЫЛАДЫ
1) НАД
2) ФАД
3) ФМН
4) убихинон
5) цитохром В
11.ЗӘР ҚЫШҚЫЛЫНЫҢ ТҮЗІЛУІН КАТАЛИЗДЕЙДІ
1) уреаза
2) уриказа
3) ксантиноксидаза
4) адениндезаминаза
12. КСАНТИНОКСИДАЗАЛАР
1) субстраттардың гидролизін катализдейді
2) оттектің қатысымен тотығу-тотықсыздану реакцияларын тездетеді
3) аэробты ортада тотығу-тотықсыздану реакцияларын тездетеді
4) электрондардың тасымалдануын ғана тездетеді
5) аралық тотықтырғышқа субстраттан сутектің және электрондардың үзілу реакцияларын тездетеді
№ 14 Текст
Убихинон – коферментQ (KoQ10)
Убихинонның құрылысы
Убихинон(KoQ10) химиялық табиғаты жағынан 6-жағдайында изопреннің қалдығы бар (10 молекуласы) 2,3-диметокси-5-метил-1,4-бензохинонға жатады. KoQ дың апоферменті жоқ.
Убихинонның таралуы
KoQ кеңінен таралған кофермент, сондықтан оның екінші аты «убихинон» («бәр жерде жүретін хинон дегенді білдіреді»). Убихинон суда ерімейді, майда ериді, яғни липофильдік қасиет көрсетеді.
Әсер ету механизмі
К0Q қайтымды тотыға және тотықсыздана алатын болғандықтан флавопротеидтерден цитохромдарға электрондарды тасымалдайтын тізбектегі байланыстырушы бөлік болып табылады. KoQ флавиндік дегидрогеназаларды тотықтырады да өзі тотықсызданады. Тотыққан коферменттің (К0Q) екі оттегісіне екі сутек атомдары қосылғанда , ол тотықсызданған күйге, яғни гидрохинондық К0QH2ге айналады.
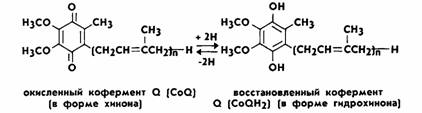
Тотықсызданған убихинондағы сутек атомдары 2 протон мен 2 электронға ыдырайды:
KoQ + ФПН2 → KoQН2 + ФП
тотыққан тотықсызданған
KoQН2 → KoQ + 2Н+ + 2е-
KoQдың биологиялық рөлі
KoQ антиоксидантқа жатады , басқа антиоксиданттардан айырмашылығы, ағзада қайта түзіле алады. Сонымен қатар KoQ Е витамині α –токоферолдың антиоксиданттық белсенділігін арттырады.
KoQ дың антиоксиданттық әсері оның тотықсызданған (КoQH2) күйімен сипатталады. KoQ дың тотықсызданған түрінің белсенділігі тотыққан түріне қарағанда үш есе жоғары. Тотықсызданған КoQмен бос радикалдарды бейтараптаудағы реакцияны былай көрсетуге болады:
2LOO• + Кo QH2 → 2LООН + Кo Q
«Сіздің назарыңызға бір, екі, үш және одан да көп дұрыс жауаптары бар тапсырмалар ұсынылады. Дұрыс жауаптардың нөмірлерін түгел қоршаңыздар»
1.УБИХИНОННЫҢ ҚҰРАМЫНА КІРЕДІ
1) бензохинон
2) изопренді тізбек
3) апофермент
4) диметокси-радикалдары
5) метил- радикалы
2. СУДА ЕРІМЕЙДІ
1) никотинамид
2) рибофлавин
3) С витамині
4) убихинон
3. УБИХИНОН ТУЫНДЫСЫ
1) бензолдың
2) хинонның
3) изопреннің
4) нафтохинонның
5) бензохинонның
4. ФМН-ДГ НЫҢ ЭЛЕКТРОНДЫҚ АКЦЕПТОРЫ
1) убихинон
2) оттек
3) цитохромВ
4) цитохромС
5. KоQ ТОТЫҚТЫРАДЫ
1) цитохромдарды
2) монооксигеназаларды
3) пиридиндік дегидрогеназаларды
4) флавиндік дегидрогеназаларды
6. ТЫНЫСАЛУ ТІЗБЕГІНДЕ УБИХИНОННЫҢ ТОТЫҒУЫН КАТАЛИЗДЕЙТІН ФЕРМЕНТ
1) Цитохром В
2) К0QH2-дегидрогеназа.
3) НАДH- дегидрогеназа.
4) Сукцинатдегидрогеназа
7.К0 QН2 ТАН ЭЛЕКТРОНДАРДЫ АЛАТЫН АКЦЕПТОР
1) убихинон
2) оттек
3) цитохромВ
4) цитохромС
8. ЭЛЕКТРОНДАРДЫ ТАСЫМАЛДАУҒА ҚАТЫСАДЫ
1) KoQ
2) ФП
3) Цха
4) монооксигеназалар
9. KOQ ДЫҢ АНТИОКСИДАНТТЫҚ ӘСЕРІ
1) Е витаминінің белсенділігін қалпына келтіруге
2) оттектің активті формасын жоюға
3) КoQH2дың тотықсызданған формасы арқылы
4) радикалдарды бейтараптауға
СЕБЕПШІ
10. ТІЗБЕКТІ ТАПСЫРМАНЫ ОРЫНДАҢЫЗ
АНТИОКСИДАНТТЫҚ ӘСЕР КӨРСЕТЕТІН ФЕРМЕНТТЕРДІҢ БІРІ
1) амилаза
2) пепсин
3) убихинон
БҰЛ ФЕРМЕНТТІҢ ЖАТАТЫН КЛАСЫ
1) лигаза
2)трансфераза
3) оксидоредуктаза
ОСЫ КЛАСТЫҢ КОФЕРМЕНТТЕРІНІҢ БІРІ
1) К0 Q
2) биотин
3) пиридоксальфат
БҰЛ КОФЕРМЕНТТЕРДІҢ БІРІНІҢ АПОФЕРМЕНТІ ЖОҚ
1) гем
2) убихинон
3) НАД+
№ 15 Текст
Цитохромдық жүйенің ферменттері
Цитохромдардың құрылысы
Цитохромдар – коферментері әртүрлі құрылыстағы гем болатын екі компонентті ферменттер. Гем құрамындағы темірдің валенттілігінің қайтымды өзгеруі арқылы тотығу-тотықсыздану реакцияларына қатысады:

Сондықтан цитохромдар тотыққан ферри[Fе (III)] және тотықсызданған ферро [Fе (II)] түрінде болу арқылы биологиялық тотығу тізбегінде электрондарды тасымалдайды.
Цитохромдардың жіктелуі
Гемнің табиғатына қарай цитохромдар төрт топқа бөлінеді: А, В, С және Д. Адам ағзасында Д тобына жататын цитохромдар жоқ. Әрбір цитохром тобының әртүрлі топша-лары болады, олар бас әріптермен белгіленеді. Мысалы: В→в, в5; С→с, с1; А→а, а3 Цитохромдардың топтарының апоферменттері мен коферменттері әртүрлі , ал топшала-рында коферменттері бірдей апоферменттерінде айырмашылық болады.
Биологиялық рөлі
Цитохромдар көптеген тіндердің тыныс алуына қатысады. Цитохромдар электрондарды тасымалдау ретіне қарай төмендегідей орналасады:
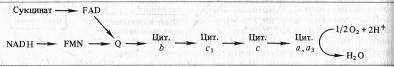
Цитохром В, өкілдері
Өкілдері: Цхв және Цхв5. Цхв5 ксенобиотиктердің метаболизміне қатысады, ал Цхв тікелей биологиялық тотығу (БТ) тізбегіне қатысады.
Цитохром(в)ның құрылысы –коферментінің гемі гемоглобиндікі сияқты екі компонентті фермент, рационалды аты- 1,3,5,8-тетраметил-2,4-дивинил-6,7-дипропион қышқылының темір(11)порфині.
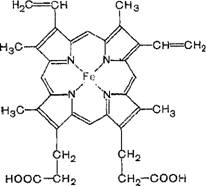
цитохром в ның гемі
Биологиялық рөлі
Цитохром в тіндік тынысалу процесінде электрондарды тотықсызданған К0QН2 ден алып өзі тотықсызданады:
2ē↓
K0QH2 + 2Цхв(Fe3+ ) ↔ K0Q + 2H+ + 2Цхв(Fe2+ )
ЦитохромС, өкілдері
Өкілдері: Цхс және Цхс1, биологиялық тотығуға (БТ) тікелей қатысады.
ЦитохромСның құрылысы
Коферменттері- гемдері бірдей, апоферменттері әртүрлі екі компонентті ферменттер. Гемнің рационалды аталуы: 1,3,5,8-тетраметил-2,4-диэтил-6,7- дипропион қышқылының темір порфині.
