Семинар 2. ТЕРМОДИНАМИКА РАСТВОРОВ
Классификация растворов. Способы выражения состава раствора. Идеальные растворы. Давление насыщенного пара над растворами. Закон Рауля.
Коллигативные свойства растворов: понижение давления насыщенного пара над раствором по сравнению с чистым растворителем, повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем, зависимость их от концентрации растворов. Эбулиоскопическая и криоскопическая постоянные, их физический смысл. Практическое использование этих свойств. Осмос и осмотическое давление. Уравнение Вант-Гоффа. Практическое значение осмоса, изо-, гипо-, и гипертонические растворы. Явления плазмолиза, тургора. Коллигативные свойства растворов электролитов. Изотонический коэффициент.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Растворами называют гомогенные системы, состоящие из двух или большего числа компонентов, состав и свойства которых меняются в довольно широких пределах. По агрегатному состоянию растворы могут быть твердыми, жидкими и газообразными. Особое значение имеют водные растворы, так как подавляющее число процессов в природе происходит в водной среде. Природные воды (морская, речная, вода минеральных источников), биологические жидкости (плазма крови, лимфа, соки растительных организмов) представляют собой водные растворы различных органических и неорганических веществ.
Жидкие растворы состоят из растворителя (А) и растворенного вещества (В). При растворении необходимо рассматривать взаимодействие между компонентами вида А-А, В-В, А-В. В случае идеальных растворов все перечисленные виды взаимодействия оказываются одинаковыми по характеру и по силе. Для реальных растворов эти силы взаимодействия различаются. Наиболее близкими по свойствам к идеальным растворам являются разбавленные растворы. В них частицы растворенного вещества взаимодействуют между собой слабо и свойства таких растворов определяются не составом частиц растворенного вещества, а их количеством в единице объема, т. е. концентрацией. Свойства растворов, зависящие от концентрации, называются коллигативными свойствами. К ним относятся понижение давления насыщенного пара растворителя над раствором, повышение температуры кипения и понижение температуры замерзания раствора по сравнению с чистым растворителем, осмос.
Рассмотрим понижение давления насыщенного пара растворителя над раствором по сравнению с чистым растворителем. Если в закрытом сосуде мы имеем чистый растворитель (А), то часть молекул растворителя выходит в газовую фазу, часть из них снова возвращается в жидкость. С течением времени установится равновесие, когда число этих молекул между собой становится равным. Пар, находящийся в равновесии с жидкостью, называется насыщенным, а давление, которое он при этом оказывает, является давлением насыщенного пара над чистым растворителем ( 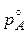 ). Если в этот растворитель добавляют нелетучие вещества, то в полученном растворе содержание молекул растворителя будет меньше, в пар выходит меньшее их количество и равновесие установится при меньшем давлении. Поэтому давление насыщенного пара растворителя над раствором pA будет меньше, чем над чистым растворителем (pA <
). Если в этот растворитель добавляют нелетучие вещества, то в полученном растворе содержание молекул растворителя будет меньше, в пар выходит меньшее их количество и равновесие установится при меньшем давлении. Поэтому давление насыщенного пара растворителя над раствором pA будет меньше, чем над чистым растворителем (pA < 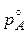 ). Французский ученый Рауль (1884 год) показал, что давление насыщенного пара растворителя над раствором зависит от концентрации раствора и дал две формулировки.
). Французский ученый Рауль (1884 год) показал, что давление насыщенного пара растворителя над раствором зависит от концентрации раствора и дал две формулировки.
Первая формулировка закона Рауля:
давление насыщенного пара растворителя над раствором прямо пропорционально молярной доле растворителя (NA):
pA = 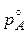 × NА × NА | (2.1) |
где 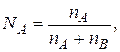 nA и nB - число моль растворителя и растворенного вещества.
nA и nB - число моль растворителя и растворенного вещества.
При замене NA на молярную долю растворенного вещества (NA = 1 - NB), уравнение Рауля примет вид:
 | (2.2) |
Из данного уравнения можно представить вторую формулировку закона Рауля:
относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества.
Закон Рауля справедлив для сильно разбавленных растворов. При растворении в данном растворителе (А) летучего вещества (В), которое также способно переходить в паровую фазу, каждый компонент будет иметь определенное давление паров в соответствии с законом Рауля:
pA = 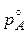 × NА × NА | (2.3) | |
pB = 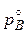 × NB, × NB, | (2.4) |
где pA и pB - парциальное давление компонентов А и В над раствором, NA и NB - молярные доли компонентов А и В в растворе, 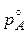 ,
, 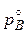 - давление пара над чистыми компонентами А и В.
- давление пара над чистыми компонентами А и В.
Общее давление паров над раствором в этом случае будет равно по закону Дальтона сумме парциальных давлений
P = pA + pB = 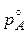 × NА + × NА + 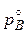 × NB. × NB. | (2.5) |
Давление насыщенного пара оказывает существенное влияние на два других коллигативных свойства - повышение температуры кипения и понижение температуры замерзания растворов.
Температура кипения - это та температура, при которой давление насыщенного пара растворителя над раствором становится равным внешнему давлению.
При давлении равном 1 атм вода как растворитель кипит при 100 °C. При растворении в ней нелетучих веществ, являющихся неэлектролитами, давление паров воды в этом растворе, согласно закону Рауля, будет ниже и достичь давления 1 атм можно только при более высокой температуре. Поэтому температура кипения растворов всегда выше, чем чистого растворителя и возрастает с увеличением концентрации раствора. Повышение температуры кипения (Dtкип), равное разности температур кипения раствора и растворителя, прямо пропорционально моляльной концентрации раствора:
| Dtкип = tкип раствора - tкип растворителя; | (2.6) | |
| Dtкип = E × Cm, | (2.7) |
где Cm - моляльная концентрация, моль/кг, Е - эбулиоскопическая постоянная, К × кг/моль.
Эбулиоскопическая постоянная зависит от природы растворителя и для воды она равна 0,51 К × кг/моль. Величину Е можно рассчитать по формуле:
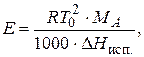 | (2.8) |
где Т0 - температура кипения растворителя, МА - молярная масса растворителя, DНисп - молярная энтальпия испарения растворителя, Дж/моль.
Физический смысл эбулиоскопической постоянной: Е характеризует то повышение температуры кипения, которое наблюдалось бы для раствора с моляльностью равной 1 моль/кг.
Линейная зависимость между повышением температуры кипения и моляльностью раствора имеет место только в случае разбавленных растворов, при Cm = 1 моль/кг может наблюдаться на практике отклонение от линейности.
Температура замерзания - это температура, при которой давление насыщенного пара растворителя над раствором становится равным давлению насыщенного пара надо льдом.
Если чистая вода при давлении 1 атм замерзает при 0 °C, то растворы, содержащие нелетучие растворимые неэлектролиты, будут замерзать при более низкой температуре. Понижение температуры замерзания (Dtзам), равное разности температур замерзания растворителя и раствора, прямо пропорционально моляльной концентрации раствора:
| Dtзам = tзам растворителя - Dtзам раствора; | (2.9) | |||||
| Dtзам = K × Cm, | (2.10) | |||||
где Cm - моляльная концентрация, моль/кг;
K - криоскопическая постоянная, K × кг/моль.
Криоскопическая постоянная также зависит от природы растворителя и для воды она равна 1,86 К × кг/моль. Величина K характеризует то понижение температуры замерзания, которое наблюдалось бы для раствора с концентрацией равной 1 моль/кг. Свойство растворов замерзать при более низкой температуре, чем чистый растворитель используется на практике для приготовления охлаждающих смесей, в том числе антифризов, в борьбе с гололедицей, для определения молярной массы растворенного вещества (криометрический метод). В этом методе определяют температуры замерзания чистого растворителя и раствора, используя определенные навески растворителя и растворенного вещества. Молярную массу растворенного вещества рассчитывают по формуле:
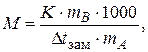 | (2.11) |
где K - криоскопическая постоянная;
mB - масса растворенного вещества, г;
mA - масса растворителя, г.
При изучении коллигативных свойств растворов электролитов было замечено, что их изменение превышает значения, рассчитанные по формулам для растворов неэлектролитов той же концентрации. В связи с этим в формулы, определяющие коллигативные свойства растворов электролитов, был введен поправочный коэффициент - изотонический коэффициент (i)
| Dtкип = i × E × Cm, | (2.12) | |
| Dtзам = i × K × Cm, | (2.13) | |
| p = i × CM × RT, | (2.14) | |
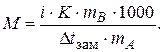 | (2.15) |
Величина изотонического коэффициента показывает во сколько раз число частиц в растворе электролита в результате диссоциации больше числа частиц в растворе неэлектролита. Ее рассчитывают по формуле:
| i = 1 + a (n - 1), | (2.16) |
где a - степень диссоциации,
n - число частиц, на которые диссоциирует электролит.
Весьма важным в биологическом отношении свойством растворов является осмос, который представляет одностороннюю самопроизвольную диффузиюмолекул растворителя через полупроницаемую мембрану из раствора с меньшей в раствор с большей концентрацией.
Схема простейшего осмометра представлена на рис.
 | Рис. 1. Схема осмометра. 1 - сосуд с водой, 2 - осмометрическая ячейка с полупроницаемой мембраной (3). |
В сосуд (1), заполненный водой, опускают осмометрическую ячейку (2), снизу закрытую полупроницаемой мембраной (3), в которой находится раствор сахарозы. Полупроницаемая мембрана (например, целлофан) способна пропускать молекулы воды и не пропускает молекулы сахарозы. В связи с тем, что воды в сосуде (1) больше, чем в ячейке, то молекулы воды проникают внутрь ячейки и повышают в ней гидростатическое давление. При этом может происходить переход молекул воды в обратном направлении. С течением времени количество молекул растворителя, перемещающихся в обоих направлениях, уравняется и устанавливается осмометрическое равновесие. Уровень жидкости в осмометрической ячейке поднимается на определенную высоту h. Гидростатическое давление столбика жидкости высотой h, которое создается при установлении осмометрического равновесия, называется осмотическим давлением.
Величина осмотического давления по Вант-Гоффу прямо пропорциональна молярной концентрации раствора (Cм, моль/м3) и абсолютной температуре (T, K):
| p = CмRT, | (2.17) |
где R = 8,314 Дж/моль × K, p - осмотическое давление, Па = н/м2.
Растворы, обладающие при одинаковых условиях равным осмотическим давлением, называются изотоническими. Изотоническими по отношению к клеткам крови являются 0,9 % (0,15 М) раствор NaCl и 5 % раствор глюкозы.
Если давление внешнего раствора больше, чем внутри клетки, то такой раствор называется гипертоническим. В нем наблюдается перемещение воды из клетки во внешний раствор, клетка при этом сморщивается (явление плазмолиза клетки). Если давление внешнего раствора меньше, чем в клетке, такой раствор называется гипотоническим. Вода из этого раствора перемещается внутрь клетки, которая при этом набухает (явление тургора для растительных клеток и гемолиза - для клеток крови).
Осмос имеет большое значение для растительных клеток, обусловливает их тургор, что является необходимым условием для их роста, поддерживает упругость и эластичность тканей, форму растений. Высокоорганизованные животные и человек способны поддерживать постоянное осмотическое давление крови (изоосмия). Важная роль в этом принадлежит почкам.
Таблица 1.Значения криоскопической и эбулиоскопической констант
| Растворитель | Темпера-тура кипения, К | Эбулиоско-пическая константа, К ∙кг∙ моль-1 | Температура замерзания, К | Криоскопи-ческая константа, К ∙кг∙ моль-1 |
| Вода | 373,2 | 0,52 | 273,2 | 1,86 |
| Бензол | 2,57 | 278,9 | 5,10 | |
| Нитробензол | 278,8 | 6,90 | ||
| Камфора | 6,09 |
