Моноцистронная и полицистронная мрнк
мРНК называют моноцистронной, если она содержит информацию, необходимую для трансляции только одного белка (один цистрон). Полицистронная мРНК кодирует несколько белков. Гены (цистроны) в такой мРНК разделены интергенными, некодирующими последовательностями. Полицистронные мРНК характерны для прокариот и вирусов, у эукариот большая часть мРНК является моноцистронной[23][24][25]. Полицистронные мРНК встречаются у эукариот и в митохондриях.
Нетранслируемые области
Основная статья: Нетранслируемые области
Нетранслируемые области — участки РНК, расположенные до старт-кодона и после стоп-кодона, которые не кодируют белок. Они называются 5'-нетранслируемая область и 3'-нетранслируемая область, соответственно. Эти области транскрибируются в составе того же самого транскрипта, что и кодирующий участок. Нетранслируемые области имеют несколько функций в жизненном цикле мРНК, включая регуляцию стабильности мРНК, локализации мРНК и эффективности трансляции. Стабильность мРНК может контролироваться 5'- и/или 3'-областью из-за различной чувствительности к ферментам, которые отвечают за деградацию РНК — РНКазам и регуляторным белкам, которые убыстряют или замедляют деградацию[26].
Полиадениновый хвост
Длинная (часто несколько сотен нуклеотидов) последовательность адениновых оснований, которая присутствует на 3'-«хвосте» мРНК эукариот, синтезируется ферментом полиаденилатполимеразой. У высших эукариот поли(А)-хвост добавляется к транскрибированной РНК, которая содержит специфическую последовательность, AAUAAA. Важность этой последовательности можно увидеть на примере мутации в гене человеческого 2-глобина, которая изменяет AAUAAA на AAUAAG, что приводит к недостаточному количеству глобина в организме[27].
тРНК
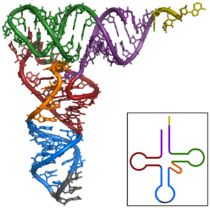
Структура транспортной РНК
Транспортная РНК, тРНК[1] — рибонуклеиновая кислота, функцией которой является транспортировка аминокислот к месту синтеза белка. Имеет типичную длину от 73 до 93 нуклеотидов и размеры около 5 нм. тРНК также принимают непосредственное участие в наращивании полипептидной цепи, присоединяясь — будучи в комплексе с аминокислотой — к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса.
Для каждой аминокислоты существует своя тРНК.
тРНК является одноцепочечной РНК, однако в функциональной форме имеет конформацию «клеверного листа». В ней выделяют 4 части, выполняющие различные функции. Первая часть-акцепторный "стебель", образованный 2-мя комплементарно соединёнными концевыми частями. Он состоит из 7 пар оснований. 3'-конец этого стебля несколько длиннее. Он формирует одноцепочечный участок, который заканчивается последовательностью ЦЦА со свободной ОН-группой. К этому концу присоединяется транспортируемая аминокислота. 3 остальные части представляют собой комплементарно спаренные последовательности нуклеотидов, которые заканчиваются неспаренными участками, образующими петли. Средняя часть состоит из 5 пар нуклеотидов и содержит в центре своей петли антикодон.[2] Аминокислота ковалентно присоединяется к 3'-концу молекулы с помощью специфичного для каждого типа тРНК фермента аминоацил-тРНК-синтетазы. На участке C находится антикодон, соответствующий аминокислоте.
тРНК синтезируются обычной РНК-полимеразой в случае прокариот и РНК-полимеразой III в случае эукариот. Транскрипты генов тРНК подвергаются многостадийному процессингу, который в конце концов приводит к формированию типичной для тРНК пространственной структуры. Процессинг тРНК включает 5 ключевых этапов[3]:
· удаление 5'-лидерной нуклеотидной последовательности;
· удаление 3'-концевой последовательности;
· добавление последовательности CCA на 3'-конец;
· вырезание интронов (у эукариот и архей);
· модификации отдельных нуклеотидов.
По окончании созревания эукариотические тРНК должны быть перенесены в цитоплазму, где они участвуют в биосинтезе белка. Транспорт тРНК осуществляется по Ran-зависимому пути при участии транспортного фактора экспортина t (Los1 у дрожжей), который распознаёт характерную вторичную и третичную структуру зрелой тРНК: короткие двуспиральные участки и правильно процессированные 5'- и 3'-концы. Такой механизм обеспечивает экспорт из ядра только зрелых тРНК. Предположительно, экспортин 5 может быть вспомогательным белком, способным переносить тРНК через ядерные поры наряду с экспортином t[4].
Рибосомные рибонуклеиновые кислоты
Рибосо́мные рибонуклеи́новые кисло́ты (рРНК) — несколько молекул РНК, составляющих основу рибосомы. Основной функцией рРНК является осуществление процесса трансляции — считывания информации с мРНК при помощи адапторных молекул тРНК и катализ образования пептидных связеймежду присоединёнными к тРНК аминокислотами.
Синтез
Рибосомная РНК составляет большую долю (до 80 %) всей клеточной РНК, такое количество рРНК требует интенсивной транскрипции кодирующих её генов. Такая интенсивность обеспечивается большим количеством копий кодирующих рРНК генов: у эукариот насчитывается от нескольких сотен (~200 у дрожжей) до десятков тысяч (для различных линий хлопка сообщалось о 50 — 120 тыс. копий) генов, организованных в массивы тандемных повторов.
У человека гены, кодирующие рРНК, также организованы в группы тандемных повторов, расположенных в центральных областях короткого плеча 13, 14, 15, 21 и 22-й хромосом.
Синтезируются РНК-полимеразой I в виде длинной молекулы пред-рибосомальной РНК, которая разрезается на отдельные РНК, составляющие основу рибосом. У бактерий и архей начальный транскрипт обычно включает 16S, 23S и 5S рРНК, между которыми находятся удаляемые в процессе обработки пре-рРНК последовательности. Обычно между 16Sи 23S рРНК генами расположен один или несколько генов тРНК; так, у E. coli начальный транскрипт такой группы генов имеет следующую последовательность:
Такой транскрипт расщепляется на фрагменты пред-рРНК и тРНК ферментом рибонуклеазой III.
У эукариот 18S, 5.8S и 25/28 рРНК ко-транскрибируются РНК-полимеразой I, в то время как ген 5S рРНК транскибируется РНК-полимеразой III.
У эукариот места сосредоточения генов, кодирующих рРНК, обычно хорошо заметны в ядре клетки, благодаря скоплению вокруг них субъединиц рибосом, самосборка которых происходит тут же. Эти скопления хорошо прокрашиваются цитологическими красителями и известны под названием ядрышко. Соответственно, наличие ядрышек характерно не для всех фаз клеточного цикла: при делении клетки в профазе ядрышко диссоциирует, поскольку синтез рРНК приостанавливается и вновь образуется в конце телофазы при возобновлении синтеза рРНК.
Сравнительный анализ про- и эукариотических рРНК
Рибосомальные РНК (как и рибосомы) прокариот и эукариот отличаются друг от друга, хотя и обнаруживают значительное сходство участков последовательностей. 70S рибосома прокариот состоит из большой 50S субъединицы (построенной на основе двух молекул рРНК — 5S и 23S) и малой 30S субъединицы (построенной на основе 16S рРНК). 80S рибосома эукариот состоит из большой 60S субъединицы (построенной на основе трех молекул рРНК — 5S, 5,8S и 28S) и малой 40S субъединицы (построенной на основе 18S рРНК).
ОнкоРНомика
Как уже говорилось, одно из самых сенсационных открытий в молекулярной биологии, сделанных в конце XX века – обнаружение микроРНК (см. раздел «РНомика»). На данный момент у человека идентифицировано около 400 генов, кодирующих разные микроРНК. Скорее всего, их список будет возрастать. Интерес к ним крайне высокий. Как показали и продолжают показывать совершенно неожиданные результаты последних лет, изменения в синтезе микроРНК сильно связаны с возникновением, прогрессированием и метастазированием злокачественных опухолей. Часть микроРНК при этом сверхсинтезируются. Синтез других падает. Некоторые исследователи даже полагают, что именно нарушение регуляции синтеза микроРНК, которые в свою очередь, как отмечалось, являются регуляторами синтеза белков – если не первопричина онкогенеза, то, по крайней мере, одна из главных причин (37-41).
Более 50% генов, кодирующих известные микроРНК человека, расположены в областях хромосом, связанных с онкогенезом. Некоторые микроРНК могут индуцировать онкогенез. К этому приводит повышение их синтеза. Другие микроРНК проявляют себя как супрессоры опухолей – подавляют неконтролируемую пролиферацию.
Например, микроРНК mir-17-92 в случае сверхсинтеза проявляет себя как онкоген, подавляя активность гена, который, в свою очередь, должен обеспечивать синтез белка – супрессора опухолей или белка, стимулирующего апоптоз («запрограммированную смерть») раковых клеток. А сниженный синтез некоторых микроРНК, например, микроРНК let-7, проявляется как действие опухолевого супрессора, способного ингибировать онкогенез за счет инактивации белков, вызывающих деление клеток (42). Отсюда и название микроРНК, связанных с онкогенезом – oncomirs (oncogenic micro RNA) (43).
С помощью онкоРНомики идентифицирован, в частности, комплекс микроРНК. который позволяет однозначно дифференцировать рак поджелудочной железы и доброкачественные опухоли этого органа. В этот комплекс входят около 100 различных микроРНК. Их содержание в опухолях поджелудочной железы в 30-50 раз выше нормы. Ожидается, что открытие этих микроРНК не только повысит возможности ранней диагностики рака поджелудочной железы, но и, возможно, ляжет в основу создания препаратов, ингибирующих их активность и тем самым подавляющих развитие опухолей поджелудочной железы (44). В другом исследовании различные специфические профили около 100 микроРНК были обнаружены в нормальной поджелудочной железе, при панкреатите и при раке поджелудочной железы. Эти профили позволяют проводить четкую дифференциальную диагностику указанных патологий (45). Кроме того, в опухолях рака молочных желез идентифицированы 4 типа микроРНК с особо резко измененными концентрациями, что, в свою очередь, оказалось связанным повышенной пролиферацией и инвазивностью клеток опухоли (46).
Повышенные уровни микроРНК miR-103 и miR-107, сопровождающиеся исчезновением микроРНК miR-155, позволяют проводить дифференциальную диагностику опухолей эндокринных желез и ацинозных опухолей. Повышенный синтез микроРНК miR-204 связан с инсулиномами и коррелирует с повышенным уровнем инсулина, регистрируемым иммуногистохимическими методами. А сверхсинтез микроРНК miR-21 сильно связан с образованием метастазов в печени (47).
Давно известно, что хромосомы злокачественных клеток характеризуются высоким спектром структурных аномалий, которые располагаются не случайным образом, а в специфических точках хромосом и тем самым представляют собой маркеры для цитологической диагностики. Как оказалось, в таких «горячих точках» хромосом весьма часто располагаются гены, кодирующие микроРНК. Экспрессия этих генов в таких случаях сильно нарушена – повышена для одних микроРНК либо понижена для других. Работы по идентификации подобных РНК и по выяснению их связи с локализаций структурных аномалий хромосом и с различными типами злокачественных опухолей – одни из самых перспективных (48). Уже идентифицировано 7 микроРНК, гены которых расположены кластером в области хромосомы, которая амплифицирована (многократно повторена) в лимфомах и в некоторых солидных опухолях. Такая амплификация, как правило, ведет к повышенной экспрессии генов (49).
Вопросы о том, как именно и какие именно стрессогенные факторы вызывают онкогенез, обсуждаются очень давно. В модельных опытах с использованием культур клеток показано, что при стрессогенных воздействиях (арсенат натрия, дефицит фолата) происходит глобальное повышение синтеза микроРНК, приводящее к нарушению нормальной сбалансированности их синтезов. Не исключено, что подобные процессы могут происходить и in vivo (50).
Однако применение микроРНК перспективно не только для диагностики. Предполагается, что введение в раковые клетки синтетических или природных РНК, предназначенных для избирательного подавления патологических повышенных уровней онкомикроРНК – весьма перспективный метод молекулярной терапии злокачественных заболеваний. Работы в этом направлении ведутся весьма интенсивно (51). Ожидается, что в 2010 году мировой рынок терапевтических препаратов, созданных на основе микроРНК, составит 3,5 млрд долл, а в 2015 – 10,5 млрд долл. (52).
Особенности метаболизма влияют на то, будет ли пригодна определенная молекула для использования организмом в качестве источника энергии. Так, например, некоторые прокариоты используют сероводород в качестве источника энергии, однако этот газ ядовит для животных[1]. Скорость обмена веществ также влияет на количество пищи, необходимой для организма.
Основные метаболические пути и их компоненты одинаковы для многих видов, что свидетельствует о единстве происхождения всех живых существ[2]. Например, некоторые карбоновые кислоты, являющиеся интермедиатами цикла трикарбоновых кислот присутствуют во всех организмах, начиная отбактерий и заканчивая многоклеточными организмами эукариот. Сходства в обмене веществ, вероятно, связаны с высокой эффективностью метаболических путей, а также с их ранним появлением в истории эволюции
Нуклеозиды — продукты присоединения азотистых оснований к сахару рибозе. Примерами азотистых оснований являются гетероциклические азотсодержащие соединения — производные пуринов и пиримидинов. Некоторые нуклеотиды также выступают в качестве коферментов в реакциях переноса функциональных групп.[13]
