Факторы, определяющие активность ферментов
Концентрация субстрата и фермента имеют непосредственное отношение к скорости реакции. Концентрация субстрата имеет до определенного предела прямую зависимость: чем выше концентрация, тем больше продукта реакции. Содержание фермента имеет также прямую зависимость: чем выше концентрация, тем больше продукта. Такая прямая зависимость отмечается до полунасыщения субстрата и фермента.
Активирование и ингибирование ферментов
Активность фермента зависит от присутствия активаторов, в качестве которых могут выступать различные соединения, например, HCl – для пепсина; желчные кислоты – для панкреатической липазы; глутатион, цистеин, витамин С – для тканевых ферментов и папаина (растительный фермент); ионы металлов – для многих ферментов (табл.4.2.).
Обычно трудно провести грань между металлоферментами и ферментами, активируемыми ионами металлов (последние легко диссоциируют). Некоторые ферменты вообще неактивны в отсутствии металлов.
Например, при удалении ионов цинка угольная ангидраза практически лишена ферментативной активности, при этом Zn2+ не может быть заменен ионом другого металла. В ряде случаев ионы металлов выполняют роль простетических групп ферментов.
В других случаях они способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса.
Ингибиторы – полностью или частично подавляют активность ферментов. К таким факторам относятся, прежде всего агенты, вызывающие денатурацию белка: нагревание, кислоты, щелочи, соли тяжелых металлов.
Таблица 4.2.
Участие ионов металлов в активировании ферментов.
| Название фермента | Металл | Название фермента | Металл |
| Алкогольдегидрогеназа Карбоангидраза Карбоксипептидаза Фосфогидролазы Фосфотрансферазы Цитохромы Пероксидаза Каталаза Ферредоксин-НАДФ-оксидоредук- таза | Zn2+ Mg2+ Fe2+, Fe3+ | Аргиназа Фосфотрансферазы Тирозиназа Цитохромоксидаза Фосфопируваткиназа АТФазы Ксантиноксидаза Нитрогеназа Нитратредуктаза | Mn2+ Cu2+ K+, Mg2+, Na+, K+, Mg2+, Ca2+, Mo2+ |
Специфические ингибиторы – подавляют активность какого-либо одного фермента или группы ферментов. Изучение действия этих ингибиторов имеет важное значение, они могут дать ценную информацию о природе активного центра фермента, о механизме образования фермент-субстратного комплекса.
Известны вещества, специфически связывающие ту или иную группу в молекуле фермента, выключая ее из химической реакции. Например, JCH2 - COOH (йодацетат), его амид и ряд других
соединений легко входят в связь с SH-группами ферментов. Ряд ферментов блокируется фосфорорганическими соединениями.
Ингибиторы позволяют определить функции множественных форм ферментов (изоэнзимов). На ингибировании ферментов основан механизм действия многих токсинов и ядов на организм.
Например, при отравлениях синильной кислотой смерть наступает как результат торможения дыхательных ферментов. Влияние инсектицидов – результат блокирования фермента холинэстеразы. Нервно-паралитические яды (зоман, зарин, Vx) тоже блокируют ферменты.
Типы ингибирования
Различают обратимое, необратимое и конкурентное ингибирование.
Конкурентное ингибирование вызывается веществами, имеющими структуру, похожую на субстрат, но немного отличающуюся от структуры истинного субстрата. Примером является торможение активности сукцинатдегидрогеназы малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты в фумаровую (рис. 4.5).
Если в среду добавить малоновую кислоту (ингибитор), то в силу структурного сходства ее с истинным субстратом янтарной
кислотой (наличие двух ионизированных карбоксильных групп) она будет реагировать с активным центром с образованием фермент-ингибиторного комплекса. Однако при этом перенос водорода от малоната не происходит, т.к. структура субстрата янтарной кислоты и малоната несколько отличаются, они конкурируют за связывание с активным центром и степень ингибирования будет зависеть от соотношений количества янтарной и малоновой кислот.
Метод конкурентного торможения широко применяется в медицине и ветеринарии, в частности действие сульфаниламидных препаратов рассчитано на такое ингибирование.
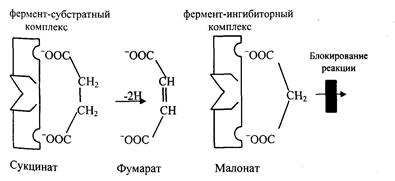
Рис.4.5. Схема конкурентного ингибирования фермента.
Так, бактерии используют парааминобензойную кислоту для синтеза фолиевой кислоты, необходимой для их роста.
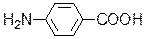
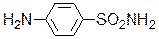
n-аминобензойная кислота сульфаниламид
Благодаря структурному сходству сульфаниламид блокирует действие фермента, в результате рост бактерий подавляется.
Некоторые аналоги витамина B6 и фолиевой кислоты, в частности, дезоксиптиридоксин и аминоптерин действуют как конкурентные ингибиторы (антивитамины), тормозящие многие биохимические процессы в организме.
Неконкурентное ингибирование вызывается веществами, не имеющими структурного сходства с субстратами и часто связывающимися не с активным центром, а в другом месте молекулы фермента. При этом образуется ковалентная связь и вследствие этого фермент инактивируется полностью, а торможение (ингибирование) бывает необратимым.
Например: действие йодоцетата, соляной кислоты и др.
На активность фермента влияют следующие факторы:
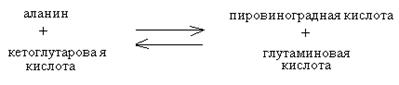
1. Влияние закона действия масс.Направление реакции зависит от концентрации компонентов реакции. Например, дезаминирование аланина с образованием пировиноградной кислоты зависит от концентрации компонентов и может идти в том или ином направлении:
2. Изменение количества фермента. На бактериях хорошо изучено индуцирование синтеза фермента, когда источником питания является один продукт, например, глюкоза. Когда глюкоза заменяется на лактозу, то появляется новый фермент – галактозидаза, расщепляющий лактозу на глюкозу и галактозу.
3. Активирование проферментов. Протеолитические ферменты желудочно-кишечного тракта и поджелудочной железы синтезируются в неактивной форме в виде проферментов (зимогенов). Активирование их происходит под действием специфических агентов. Например: трипсиноген (поджелудочная железа) в кишечнике превращается в трипсин под действием энтерокиназы (открыто в лаборатории И.П. Павлова).
4. Химическая модификация фермента: ключевые ферменты энергетического обмена – фосфорилаза, гликогеназа и др. контролируются путем химической модификации – фосфорилирования и дефосфорилирования.
5. Регуляция активности ферментов по принципу обратной связи – распространенная форма регуляции. Концентрация конечного продукта является мощным ингибирующим фактором. Например: в клетках E.coli изолейцин, являющийся конечным продуктом, избирательно подавляет активность треониндегидратазы (первую фазу превращения в изолейцин).
6. Другие типы регуляции: к ним могут быть отнесены конкуренция ферментов за общий субстрат, выключение одного из ферментов (изоферментов).
О количестве фермента судят по скорости катализируемой реакции при определенных условиях – или по убыли субстрата или по образованию продукта реакции.
За единицу (E) любого фермента принимается то его количество, которое в оптимальных условиях катализирует превращение 1 мкмоль субстрата в минуту (мкМоль/мин). Кроме того, активность фермента обозначают в каталах (kat) – 1 моль/сек. IE ферм.=16,67 нкатал. Для выражения активности фермента пользуются определением активности: удельной, молекулярной.
Удельная активность фермента – это единица ферментативной активности на 1 мг белка.
Молекулярная активность – это число молекул субстрата, подвергающаяся превращению одной молекулой фермента в минуту. Например: одна молекула каталазы эритроцитов способна расщепить в 1 мин 5-106 молекул H2O2.
