Спадкова мінливість. Мутації, їх різновиди. Мутагени фізичні, хімічні, біологічні. Генетичні рекомбінації: трансформація. Трансдукція, кон’югація
При генотипній мінливості м/о різноманітні ознаки бактерій успадковуються та передаються нащадкам. Вона може розвиватись внаслідок мутацій та рекомбінацій.
Мутації – зміни в генотипі, які проявляються фенотипово у вигляді зміненої ознаки.
Класифікація
1.За проявом
а) морфологічні (-зміна забарвлення)(-характер колонії бактерій)
б) фізіологічні (-мутації стійкості,після яких м/о набуває здатності, наприклад, переносити токсичні концентрації речовин,які пригнічують ріст диких штамів)
в) біохімічні(-прояви ауксотрофності(неможливість синтезу певної органічної сполуки,що потрібна м/о)
-прояви прототрофності(синтез усіх необхідних речовин)
2. За походженням
а) спонтанні
-без втручання експериментатора
-при дії якихось невстановлених навколишніх факторів
б) індуковані- при дії встановлених мутагенних факторів
3. За локалізацією
а) нуклеоїдні- в нуклеоїді клітини
б) цитоплазматичні- в позахромосомних елементах спадковості-плазмідах
4. За кількістю генів
а) генні
б) хромосомні

 5. За величиною
5. За величиною
|
|
 |  | ||
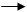
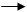 Інверсія Делеція
Інверсія Делеція
-випадіння частини хромосоми
-фрагмент ДНК в молекулі перевертається на 180*
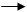 Інерція
Інерція
-вставка фрагментів ДНК
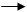 Дуплікація
Дуплікація
-подвоєння ділянки хромосоми
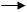 Делеція
Делеція
-випадіння частини хромосоми
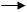 Дислокація
Дислокація
-зміна локалізації ділянки ДНК
Збільшувати частоту мутаційного процесу можуть особливі фактори – мутагени.
- Хімічні-найнебезпечніші з них – азотиста кислота, нітрозогуанін, етилметансульфанат,акридин.
- Біологічні- перекис водню, лікарські препарати,деякі антибіотики
- Фізичні – УФ-випромінювання, рентгенівські промені та гама-промені
Трансформація — це передача генетичного матеріалу від донора до реципієнта за допомогою ізольованої ДНК. Бактеріальні клітини, що здатні трансформуватися, називаються компетентними. Розрізняють наступні фази трансформації:
1.Адсорбція ДНК-фрагмснту.
2.Сприйняття бактеріями-реципіснтами фрагмента двониткової ДНК клігини-донора.
3.Екліпс-фаза (одна нитка ДНК руйнується, друга нитка приймає участь в наступних стадіях).
4.Інтеграція (включення) трансформуючої ДНК у хромосому донора.
5.Експресія (прояв) дії генів при розмноженні трансформованого клону клітин.
Таким чином, при трансформації відбувається заміна однієї генетичної ділянки іншою, внаслідок чого бактерія набуває нових властивостей: стійкості до антибіотиків, синтезу ферментів, утворення капсульного полісахариду тощо.
Трансдукція — перенесення генетичного матеріалу від клітини-донора до клітини-реципієнта за допомогою помірного бактеріофага. Механізм передачі аналогічний передачі вірулентних фагів. Форми трансдукції:
1. Генералізована форма (неспецифічна) відбувається тоді, коли фаг інтегрується в будь-якій ділянці матеріалу бактерії.
2.Специфічна форма (локалізонана), коли ген, що переноситься, локалізується на хромосомі бактерії реципієнта поряд з фагом (дефектні фаги).
3.Абортвна форма — коли не відбувається включення генетичного матеріалу в бактеріальну хромосому.
Кон'югація — передача генетичного матеріалу від одної клітини до іншої при безпосередньому контакті, таку взаємодію розглядають як варіант статевого процесу. Необхідною умовою кон'югації є наявність у донора специфічного фактору плодючості (фертильності) — F-плазміди, або F-фактора, який міститься в чоловічій клітині. Кон'югація здійснюється з участю спеціальних структур — F-пілей, що розміщені на поверхні F+ клітин. При кон'югації відбувається тільки частковий перенос генетичного матеріалу, тому її не слід ототожнювати повністю із статевим процесом у інших організмів.
Позахромосомні фактори спадковості бактерій. Плазміди, основні генетичні функції. Мігруючі елементи. Роль мутацій, рекомбінацій в селекції та еволюції мікробів. Основні фактори еволюції.
Плазміди - додаткові фактори спадковості, розташовані в клітинах поза хромосом і які становлять кільцеві (замкнуті) або лінійні молекули ДНК.
Використання. Плазміди широко використовуються в генної інженерії для перенесення генетичної інформації і генетичних маніпуляцій. Для цього створюються штучні плазміди - вектори, що складаються з частин, узятих з різних генетичних джерел, а також зі штучно створених фрагментів ДНК.
Функції в клітинах. Присутність плазмід в клітинах може бути пояснено перевагами, які дають плазмідні гени клітини-господаря (можливість рости в присутності антибіотика, використання більш широкого коласубстратів, захист від бактеріофагів, усунення конкурентів шляхом синтезу бактеріоцинів) або ж теорією егоїстичною ДНК, як у випадку кріптіческіе плазмід (тобто плазміда підтримується завдяки своїй пристосованості до умов всередині клітини).
Мігруючі генетичні елементи - Окремі ділянки ДНК, здатні здійснювати власний перенос (транспозицію) усередині генома. Транспозиція пов'язана зі здатністю мігруючих елементів кодувати специфічний фермент рекомбінації - транспозази.
Вставні (інсерційні) послідовності (IS-елементи) - Найпростіший тип мігруючих елементів. IS-елементи самостійно не реплікуються і не кодують розпізнаваних фенотипічних ознак. Вміщені в них гени забезпечують тільки їх переміщення з однієї ділянки в іншу.
Основні функції IS-послідовностей
-регуляція активності генів бактеріальної клітини (можуть інактивувати гени, в які включилися, чи, вбудовуючись в хромосому, виявляти ефект промотору, що включає або вимикає транскрипцію відповідних генів),
- індукція мутацій типу делецій чи інверсій (при переміщенні) і дуплікацій (при вбудовуванні в хромосому ),
- координація взаємодій плазмід і траспозонів (як між собою, так і бактеріальної хромосомою).
Транспозони (Tn-елементи) не здатні до самостійної реплікації і розмножуються тільки в складі бактеріальної хромосоми. Кожен транспозон містить гени, що визначають фенотипічно виражені ознаки (наприклад, стійкість до антибіотиків), то їх легше виявити, ніж IS-елементи. Загалом, для транспозонів характерні ті ж гени, що і для плазмід.
За допомогою генетичних методів добуто селекційні культури м/о, що використовується в технології виготовлення штучних продуктів, виробництві анатоксинів, вакцин, антибіотиків, вітамінів.
Метод генетичних рекомбінацій патогенних і непатогенних видів бактерій дає змогу виявити високо імуногенні вакцинні штами.
Особливої актуальності набуває селекція патогенних бактерій із зниженою вірулентністю,що відбувається під впливом величезної кількості лікарських засобів. Внаслідок слабкої вірулентності багато збудників захворювань втрачають властивість виробляти імунітет,що призводить до формування латентних (прихованих) форм інфекцій, які характеризуються хронічним перебігом,рецидивами, важко піддається клінічній і лабораторній діагностиці, специфічній терапії профілактиці.
Значення генетики у розвитку загальної і медичної мікробіології, вірусології,молекулярної біології. Мікробіологічні основи генної інженерії. Одержання спадково змінених організмів. Досягення генної інженерії, використання генно-інженерних препаратів у медицині.
Вивчення генетики бактерій та інших м/о має дуже важливе як теоретичне, так і практичне значення для спрямованої селекції високопродуктивних штамів, які останнім часом почали широко застосовуватися в різних галузях народного господарства. Використання в селекції м/о методів природного добору, індукованого мутагенезу, популяційної мінливості,клонування, гібридизації соматичних клітин дало можливість одержати високопродуктивні штами м/о. Останні знайшли широке застосування в мікробіологічній промисловості для виробництва кормового білка, амінокислот, ферментів , вітамінів, антибіотиків, бактеріальних добрив, засобів захисту рослин, анатоксинів, лікувально-профілактичних препаратів – вакцин, інтерферонів , гормонів, інтерлейкінів. Багатонадійні перспективи для сільського господарства, біології та медицини й інших галузей народного господарства відкриваються у зв’язку з розробкою і вдосконаленням методів генної і клітинної інженерії, за допомогою яких експериментально доведено можливість передачі не тільки природніх генів, а й штучно синтезованих, які кодують синтез різноманітних біологічно-активних сполук. Наприклад, ще в дослідах з генної інженерії, проведених у 1973 році, було введено за допомогою ага в геном E.coli ген LIG, який контролює синтез лігази. Внаслідок цього вміст лігази в клітинах-реципієнта збільшився в 500разів. Тепер у клітини кишкової палички клоновані і функціонують гени інтерферонів, гормону росту, інсуліну та ін.. За допомогою клонованих штамів E.coli одержують препарати інтерферону, інсуліну і соматотропну. Є також дані про те, що успішно функціонують клоновані бактерії гени вірусів грипу, гепатиту В, герпесу, ген білка оболонки вірусу ящуру, що в найближчий час дозволить розробити технологію виробництва молекулярних вакцин без баластних білків. Останнім часом інтенсивно вивчаються методи трансплантації генів за допомогою плазмід.
Хіміотерапія та хіміотерапевтичні препарати. Хіміотерпевтичний індекс. Механізм антибактеріальної дії сульфаніламідів. Роль П.Ерліха та Г.Догмагка у розвитку вчення про хіміотерапію.
Хіміотерапія-лікування інфекційних і паразитарних захворювань за допомогою хімічних речовин.
Хіміотерапевтичні препарати,які використовуються в клініці,повинні мати високу терапевтичну ефективність і низьку токсичність для організму. Для оцінки їх якості введено поняття хіміотерапевтичного індексу. Він виражається відношенням максимальної дози препарату, що переноситься хворим, до мінімальної лікувальної. Цей показник не повинен бути меншим 3.
Сульфаніламідні препарати — перші хіміотерапевтичні протибактеріальні засоби широкого спектру дії — є похідними аміду сульфанілової кислоти.
Механізм хіміотерапевтичної дії сульфаніламідних препаратів грунтується на спільній структурі їх з параамінобензойною кислотою ПАБК, завдяки чому вони, конкуруючи з нею, залучаються до метаболізму бактерій. Шляхом конкуренції з ПАБК сульфаніламіди перешкоджають використанню її мікроорганізмами для синтезу кислоти дигідрофолієвої.
На сьогодні синтезовано понад 15 000 похідних сульфанілової кислоти, з яких близько 40 впроваджено в медичну практику як антибактеріальні засоби.
Г. Домагк дослідив червону фарбу, що синтезували німецькі хіміки. Він показав, що червона фарба виявляє виражену протимікробну дію у мишей, заражених гемолітичним стрептококом. Фарба отримала назву Проптозил. Домагк нагороджений Нобелівською премією.
Ерліх встановив факт придбання мікроорганізмами стійкості до хіміотерапевтичних препаратів. Світову славу Ерліху приніс розроблений ним препарат 606 сальварсан, який виявився високоефективним при лікуванні сифілісу. Працював над проблемою злоякісних пухлин.
Явище антагонізму мікробів.Роль вітчизняних мікробіологів у розвитку вчення про антагонізм мікробів.Антибіотики ,характеристика,принципи одержання ,одиниці виміру.Класифікація за механізмом дії на мікроорганізми.
Антагонізм мікробів-придушення одних видів мікроорганізмів іншими. Вперше відмічений Л. Пастером (1877). Поширений в природі. У одних випадках під впливом антагоністів мікроби перестають зростати і розмножуватися, в інших — клітки їх лізируються, розчиняються, в третіх — гальмуються або зупиняються біохімічні процеси усередині кліток, наприклад дихання, синтез амінокислот. Найрізкіше Антагонізм виявляється в актиноміцетів, бактерій і грибів. Синьогнійна паличка активно пригнічує чумну паличку; актиноміцет, що виділяє ністатин, пригноблює зростання дріжджових організмів. Найчастіше антагоністи діють на конкурентів продуктами обміну речовин , у тому числі антибіотиками, або витісняють їх унаслідок інтенсивнішого розмноження або переважно вжитку їжі. Ще в 19 ст неодноразово намагалися використовувати явище Антагонізму для лікування хвороб, викликаних бактеріями (Ст А. Манассєїн, 1871; А. Р. Полотебнов, 1872; і ін.), але не мали успіху, оскільки працювали з неочищеними препаратами. Мікроби-антагоністи широко використовуються у виробництві антибіотиків .
Антибіотики (грец. αντι — проти, грец. βιοτικος — життєвий), органічні речовини, що синтезуються мікроорганізмами в природі для захисту від інтервенції інших видів мікроорганізмів, та володіють здатністю пригнічувати розвиток, або вбивати цих мікробів. Як правило, антибіотики виділяють з живих бактерій або грибів.Величезна різноманітність антибіотиків і видів їх впливу на організм людини стало причиною класифікування і поділу антибіотиків на групи. За характером впливу на бактеріальну клітину антибіотики можна розділити на три групи:
Бактеріостатичні (бактерії живі, але не здатні розмножуватися),
Бактерициди (бактерії гинуть, але фізично продовжують бути присутнім в середовищі),
Бактеріолітичні (бактерії гинуть, і руйнуються бактеріальні клітинні стінки).
Класифікація за хімічною структурою, яку широко використовують в медичному середовищі, складається з наступних груп:
Бета-лактамні антибіотики, що поділяються на дві підгрупи:
Пеніциліни — виробляються колоніями цвілевих грибів Penicillinum;
Цефалоспорини — мають схожу структуру з пеніцилінами. Використовуються для боротьби з бактеріями, що стійкі до пеніциліну.
Макроліди — антибіотики зі складною циклічною структурою. Мають бактеріостатичну дію.
Тетрацикліни — використовуються для лікування інфекцій дихальних і сечовивідних шляхів, лікування важких інфекцій типу сибірської виразки, туляремії, бруцельозу. Дія — бактеріостатична.
Аміноглікозиди — володіють високою токсичністю. Використовуються для лікування важких інфекцій типу зараження крові або перитоніт ів.
Левоміцетини- Використання обмежене через підвищеної небезпеки серйозних ускладнень — ураженні кісткового мозку, який виробляє клітини крові. Дія — бактеріостатичну.
Глікопептиди — антибіотики, що порушують синтез клітинної стінки бактерій. Надають бактерицидну дію, проте відносно ентерококів, деяких стрептококів і стафілококів діють бактеріостатично.
Лінкозаміди надають бактеріостатичну дію, що зумовлено пригніченням синтезу білку рибосомами. У високих концентраціях відносно високочутливих мікроорганізмів можуть проявляти бактерицидний ефект.
Протигрибкові — руйнують мембрану клітин грибків і викликають їх загибель. Дія — літична. Поступово витісняються високоефективними синтетичними протигрибковими препаратами.
Лікарська стійкість мікробів.механізм утворення стійких форм.Методи визначення чутливості мікробів до антибіотиків.Мінімальна пригнічувальна(МПК) та мінімальна бактерицидна(МБК) концентрації.Практичне значення.Принципи боротьби з лікарською стійкістю мікроорганізмів.
Стійкість до протимікробних препаратів - це здатність мікроорганізмів (таких як бактерії, віруси і деякі паразити) протистояти впливу на них протимікробних препаратів (таких як антибіотики, противірусні препарати та протималярійні засоби). Неналежне використання протимікробних препаратів сприяє розвитку лікарської стійкості. Проблему посилюють як надмірне, так і недостатнє і неналежне використання.
Існуючі протимікробні препарати втрачають свою ефективність. У той же час в розробці нових протимікробних препаратів спостерігається занепад. Наукові дослідження в області нових діагностичних засобів для виявлення стійких мікроорганізмів та вакцин для профілактики та боротьби з інфекціями також проводяться в недостатніх масштабах. При збереженні цієї тенденції арсенал засобів для боротьби зі стійкими мікроорганізмами скоро буде вичерпано. Найбільш перспективним напрямком в розробці нових засобів для подолання лікарської стійкості патологічних мікроорганізмів, є об'єднання в одному препараті двох компонентів, один з яких інактивує генетичну захист мікробної клітини, а інший - просто знищує її.
Інфекція.Фактори,що зумовлюють виникнення інфекційного процесу.Роль мікроорганізмів в інфекційному процесі.Патогенність,вірулентність,одиниці виміру,методи визначення.фактори патогенності мікроорганізмів,їх характеристика.
Інфекція або Заражування — стан, коли в організм потрапляє чужорідний агент (бактерія, грибок, найпростіші або вірус), який розмножується і здійснює хвороботворний ефект.
Інфекції виникають тільки при наявності в харчових продуктах живихклітин мікроорганізмів, які мають певний інкубаційний період і своїознаки. Вірулентність, або ступінь патогенності мікробів змінюється залежно від умов їхнього існування. Патогенні мікроби виробляють отруйні речовини – токсини. Вони бувають двох видів: екзотоксини і ендотоксини. Екзотоксини виділяються з клітин в навколишнє середовище в період життєдіяльності мікроорганізмів, а ендотоксини – лише після порушення цілісності клітинної стінки. Екзотоксини більш отруйні ніж ендотоксини.
Вірулентність (від лат. Virulentus — ступінь хвороботворності (патогенності) даного інфекційного агента (звичайно віруса, можливо, бактерії або іншого мікроба). Вірулентність залежить як від властивостей інфекційного агента, так і від сприйнятливості (чутливості) інфікованого організма. Про величину вірулентності судять за тяжкістю захворювань, що викликаються вірусом або мікробом захворювань, в експериментах на тваринах — за смертельною дозою інфекційного агента. Вірулентність визначається не тільки здатністю мікроорганізму упроваджуватися в організм сприйнятливої тварини, розмножуватися і розповсюджуватися в нім, але і тим, що вірус (або мікроб) виробляє отруйні продукти життєдіяльності — токсини.
Патогенність — потенційна здатність мікроорганізму викликати захворювання. Ця властивість характеризує видові генетичні особливості мікроорганізму, його взаємовідносини з певним видом або видами інших організмів. Патогенність характеризується вираженою специфічністю, тобто здатністю одного виду мікроорганізму викликати певні клінічні та патоморфологічні зміни. Це обумовлюється біологічними та генетичними факторами. Патогенність залежить як від агресивності мікроорганізму (здатності проникати у клітини та органи, а також продукувати токсини), так і від виду та фізіологічного стану організму хазяїна.
Токсини мікробів(екзо- та ендотоксини).Класифікація екзотоксинів за функціональними властивостями.Властивості та хімічний склад ,одержання ,вимірювання сили екзотоксинів.роль в патогенезі та імуногенезі інфекційних захворювань.
Екзотоксини — токсичні речовини білкової природи, що виробляються патогенними мікроорганізмами та виділяються ними в довкілля.
Дія екзотоксинів спостерігається через певний інкубаційний період. Дія цих речовин високоспецифічна, вони уражають певні тканини та органи, що обумовлює характерну клінічну картину відповідного захворювання, його патогенез та патоморфологію. Так токсин правця діє на нейрони спинного мозку, дифтерійний токсин уражає серцевий м'яз та наднирники.
Оскільки екзотоксини є білками, вони досить нестійкі до високої температури та дії хімічних речовин (зокрема більшість з них руйнуються ферментами травної системи).
Дуже важливою властивістю екзотоксинів є втрата токсичності. Після обробки їх формаліном або деякими іншими хімічними речовинами токсини втрачають свої отруйні властивості, але зберігають здатність при введенні в організм стимулювати утворення антитіл-антитоксинів. Такі знешкоджені препарати токсинів називають анатоксинами.
В лабораторії екзотоксини отримують шляхом вирощування мікроорганізмів у рідкому поживному середовищі протягом кількох діб. Після цього культуру мікроорганізмів фільтрують через фільтри, які не пропускають бактерій. Отриманий фільтрат містить токсин та інші продукти метаболізму мікроорганізмів. Для отримання очищених токсинів застосовують різноманітні методи — осаджування сірчанокислим амонієм, кислотами, спиртами, електродіалізом, ультрафільтрацією тощо.
Ендотоксини — токсичні речовини хвороботворних бактерій, які утворюються внаслідок загибелі та руйнуванні клітин мікроорганізмів в організмі хазяїна.
На відміну від екзотоксинів, дія ендотоксинів на організм не відрізняється специфічністю. Ендотоксини, отримані з різних видів мікроорганізмів при введенні в організм викликають більш-менш схожу клінічну картину. Потрапивши до організму, ці токсини починають діяти відразу, майже без інкубаційного періоду. У тварин після введення летальних доз ендотоксинів розвиваються слабкість, задишка, розлади кишечника (діарея), зниження температури. Загибель тварин спостерігається через кілька годин. Сироватка крові тварин, яким вводились ендотоксини не має високої антиендотоксичної активності та не повністю нейтралізує отруйні речовини ендотоксинів.
За хімічною природою ендотоксини є складними глюцидо-ліпідо-поліпептидними комплексами (ліпополісахариди). На відміну від екзотоксинів вони термостабільні. Найбільш вивчені ендотоксини грамнегативних бактерій — збудників черевного тифу, дизентерії, холери.
У лабораторії ендотоксини отримують руйнуванням клітин бактерій різноманітними способами. Серед них розтирання висушених клітин у розчинах кухонної солі, заморожування та відтаювання суспензії бактерій, руйнування ультразвуком, обробка трихлороцтовою кислотою тощо.
Фази розвитку інфекційного процесу.Механізми зараження патогенними мікроорганізмами.Шляхи розповсюдження мікробів в організмі людини.Бактеріємія,токсинемія,сепсис.Періоди інфекційної хвороби.
Інфекційний процес - є закономірно виникаючою в організмі сукупністю
реакцій (біохімічних, імунологічних і структурно-функціональних) на дію
інфекційних факторів патогенних мікроорганізмів. Виділяють такі шляхи передачі інфекції від людини:
Контактно-побутовий шлях, коли захворювання передається через предмети, що оточують хворого.
Повітряно-крапельний шлях, коли інфекція передається через крапельки слини, що потрапляють у повітря при розмові, чханні, кашлі. Так можуть передаватися туберкульоз, грип, коклюш, дифтерія, кір тощо.
Передача інфекції через воду, в яку потрапляють мікроби з виділеннями хворих (холера, черевний тиф, дизентерія та ін.).
Через укуси кровосисних членистоногих (наприклад, малярія).
Через заражені харчові продукти.
Через грунт: наприклад, кишкові захворювання, правець.
Виділяються такі періоди при розвитку інфекційного процесу:
Інкубаційний період (особливістю такого періоду є те, що ознаки захворювання проявляються не відразу після зараження, а через певний прихований, інкубаційний період. Такий період може тривати від кількох годин до кількох днів (дифтерія) і навіть тижнів (черевний тиф). Протягом інкубаційного періоду відбувається розмноження й нагромадження мікробів та їхніх отрут, підвищення реактивності організму до збудника),
Період провісників хвороби, або як ще його називають – продромальний період (характеризується наявністю деяких загальних ознак захворювання: невеликим підвищенням температури, загальним нездужанням тощо),
Період розпалу хвороби (у такий період, інфекційний процес досягає високої інтенсивності, тримається на цьому рівні певний час, що є неоднаковим при різних захворюваннях),
Період реконвалесценції, тобто одужання (при сприятливих умовах перебігу, така хвороба переходить у стадію одужання, першою ознакою чого є спадання температури, поліпшення загального самопочуття і т.п. При багатьох інфекційних захворюваннях клінічне одужування не збігається за часом зі звільненням інфікованого організму від збудника хвороби).
Бактеріємія — проникання збудника з місця локалізації в кров і поширення по всьому організму, при чому мікроорганізми в крові не розмножуються.
Се́псис — гостре або хронічне захворювання, що характеризується прогресуючим розповсюдженням в організмі бактеріальної, вірусної або грибкової флори.
Токсинемія-процес,що виникає внаслідок дії на мікроорганізм токсигенних бактерій.
31. Роль макроорганізму в інфекційному процесі. Вплив навколишнього середовища і соціальних умов на виникнення і розвиток інфекційного процесу у людини. Персистенція бактерій і вірусів. Форми і типи інфекції (реінфекція, суперінфекція, мікст-інфекція, поняття про рецидив)
Дуже важливе значення для виникнення інфек. проц. має стан макроорганізму. Ступінь його участі в інфекційному процесі може залежати від виду і генотипу, реактивності, розладу функції центральної нервової системи (ЦНС), білкового голодування, наявності вітамінів, гормонів та інших факторів. Залежно від стану, в якому перебуває макроорганізм, а також впливу зовнішнього середовища інфекційний процес може закінчитися загибеллю хвороботворного мікроорганізму, загибеллю макроорганізму або встановленням взаємної адаптації між ними. Реактивність макроорганізму, його імунобіологічна готовність знешкодити патогенні мікроби тісно пов'язані зі станом довкілля, умовами життя і побуту, характером праці й харчування, санітарно-гігієнічними умовами тощо. На сприйнятливість макроорганізму до інфекції певним чином впливають вік і стать у зв'язку з фізіологічними особливостями. Наприклад, до одних інфекційних хвороб діти більш сприйнятливі, до інших, навпаки, менш сприйнятливі, ніж дорослі.
Загальновизнаним є положення про те, що інфекційний процес - суть взаємодії збудника і макроорганізму в певних умовах навколишнього середовища. Однак, навколишнє середовище в цій тріаді посідає особливе місце і зазвичай лише побічно впливає на інфекційний процес. По-перше, вона надає попереднє опосередкований вплив шляхом впливу як на збудника (фізичні, хімічні, біологічні та інші фактори середовища), так і на макроорганізм (ті ж фактори плюс соціальні умови). По-друге, будь-які терапевтичні впливb також можна розцінювати як поточний вплив факторів зовнішнього середовища на інфекційний процес. І, по-третє, сам комплекс взаємних пристосувальних реакцій мікро-і макроорганізму можна розглядати як спрямований на відновлення порушеного гомеостазу та біологічної рівноваги з навколишнім середовищем. Також, на тлі дестабілізації соціально-економічних умов життя населення ускладнюється епідеміологічна ситуація і зростає значущість «класичних» інфекцій. Наочним прикладом може служити стрімке зростання захворюваності на туберкульоз. Небувалого розмаху досягла захворюваність сифілісом та іншими інфекціями, що передаються статевим шляхом. Не можна не згадати пов'язаний з ослабленням імунопрофілактики зростання захворюваності на дифтерію в кінці 80-х - початку 90-х років; спалах поліомієліту в Чеченській Республіці в 1995 р.; епідемію холери в Дагестані в 1994 р. (2435 хворих і носіїв вібріона), що виникла в результаті завезення збудника з Саудівської Аравії.
Персистенція— тривале збереження збудника в організмі.При гострій інфекційній хворобі час перебування вірусу в організмі визначається тривалістю інкубаційного періоду і періоду неускладненого клінічного перебігу хвороби. Збереження вірусу довше цього терміну — П.; у ряді випадків П. вірусів триває місяцями і роками, іноді все життя. Персистуючий бактеріофаг існує в бактеріях у вигляді неінфекційного профага, активація якого викликає лізис бактерій.. П. вірусів, є безсимптомними чи з маловираженими ознаками ушкодження, називають також вірусоносійством. П. вірусів залежить від ступеня резистентності організму: чим менш сприйнятливий організм до даного вірусу, тим частіше спостерігаються приховані форми інфекції
Інфекція може розвиватися у різних напрямках та приймати різні форми:ЛОКАЛЬНА ІНФЕКЦІЯ — місцеве пошкодження організму під дією патогенних факторів мікроорганізму. Локальні інфекції представлені ангінами, фурункулами, дифтерією, рожею. ЗАГАЛЬНА ІНФЕКЦІЯ — проникнення мікрогормонів в кров і розповсюдження по всьому організму. характернa для грипу, сальмонельозу, всипного тифу, сифілісу, деяких форм туберкульозу та вірусних гепатитів. ЛАТЕНТНА ІНФЕКЦІЯ— стан при якому мікроорганізм, що живе і розмножується у тканинах організму, не викликає ніяких симптомів (хронічна форма гонореї, хронічний сальмонельоз та інші)……*Реінфекція — повторне зараження тим же інфекційним агентом із зовнішнього середовища, що й первинний.*Суперінфекція - процес, в результаті якого клітина, спочатку заражена одним вірусом, коінфікується через якийсь час іншим штамом вірусу або іншим вірусом. Вірусні суперінфекції можуть призвести до появи резистентних штамів вірусів, для лікування яких потрібні інші препарати.*Мікст-інфекція-*Рецедив — відновлення хвороби після удаваного повного одужання ( ремісії). Рецидив пояснюється тією обставиною, що патоген у ході лікування не повністю зникає з організму і, за певних умов, знову викликає поява симптомів захворювання. Клінічна картина рецидиву, як правило, повторює клінічну картину первинного захворювання, нерідко у поглибленій формі.
32. Вчення про імунітет. Етапи розвитку імунології. Види і форми цього прояву.
Імунітет - це комплекс реакцій організму, спрямованих на збереження гомеостазу при дії на організм генетично чжих біологічних факторів Органи імунної системи: центральні: кістковий мозок і тимус. Периферичні: селезінка, лімфатичні вузли, лімфоїдна тканина асоційована зі слизовими. У центральних органах майбутні захисники організму - так звані імунні клітини - попередники перетворюються в зрілі імунокомпетентні лімфоцити. Потім вони відправляються на наступний ступень.В периферичних органах лімфоцити проходять останні етапи цілеспрямованого розвитку, щоб донести імуноглобулінові рецептори до місцевих відділів організму людини.
Стан імунної системи забезпечують як спадкові (природний імунітет), так і спеціально сформовані механізми (штучний імунітет). Природний імунітет поділяється на вроджений і набутий.Уроджений імунітет до певних хвороб передається спадково. Набутий формується протягом усього життя людини. Він з’являється після перенесеного захворювання й може бути активним і пасивним. Активний імунітет розвивається через 1-2 тижні після одужання. Він може зберігатися тривалий час, іноді все життя або бути нестійким . Пасивний імунітет має немовля, яке отримало антитіла від матері через плаценту під час внутрішньоутробного розвитку або із грудним молоком. Такий імунітет зберігається протягом перших тижнів життя, а потім поступово зникає. Штучний імунітет створюють введенням в організм лікувальної сироватки — готових антитіл проти певного збудника (наприклад, протитуберкульозне щеплення) або вакцини.
Імунна система розділена на дві частини - систему гуморального імунітету та систему клітинного імунітету. У разі гуморального імунітету, захисні функції виконують молекули, що знаходяться в плазмі крові(фагоцитоз), але не клітинні елементи. У той час як у випадку клітинного імунітету захисна функція пов'язана саме з клітинами імунної системи. Система клітинного імунітету виконує захисні функції наступними способами:*шляхом активації антиген-специфічних цитотоксичнихТ-лімфоцитів, які можуть викликати апоптоз соматичних клітин, *шляхом активації макрофагів і натуральних кілерів, які руйнують внутрішньоклітинні патогени;*шляхом стимулювання секреції цитокінів, які впливають на інші клітини імунної системи, що беруть участь в адаптивному імунній відповіді і природженому імунній відповіді.
Розрізняють 2 основні етапи розвитку імунології:
*Перший етап розвитку імунології подарував світу можливість профілактики інфекційних захворювань - вакцини (початок інфекційної імунології ). Вчення про імунітет одержало бурхливий розвиток після того, як учені довідалися про фагоцитарну активність лейкоцитів і про утворення в організмі антитіл різних класів проти антигенів. Було встановлено, що поряд з ендокринною, серцево-судинною, травною й іншою системами в організмі тварин і людини існує і самостійна імунна система.
* З відкриття в крові антитіл - захисних гуморальних речовин почався другий етап розвитку імунології (гуморальної імунології). На початку 20 століття Ерліх розробив гуморальну теорію імунітету, відповідно до якої головним захисним фактором є антитіла. Після цих етапів почалося бурхливе вивчення і дослідження імунної системи організму, що на сьогоднішній день сягнуло значних відкриттів в імунології.
Взагальному,імунологію поділяють на інфекційну (таку що вивчає механізми захисту від патогенних мікіроорганізмів) та неінфекційну (не пов’язана з агентами що заражують).Предметом вивченням її є: *Будова імунної системи;*Закономірності та механізми розвитку імунних реакцій;*Механізми контролю і регуляції імунних реакцій;*Хвороби імунної системи та її дисфункції;*Умови та закономірності розвитку імунопатологічних реакцій та способи їх корекції;*Можливість використання резервів і механізмів імунної системи в боротьбі з інфекційними та неінфекційними захворюваннями;*Імунологічні проблеми репродукції;*Імунологічні проблеми трансплантації органів і тканин.
33. Неспецифічні фактори захисту організму від патогенних мікробів. Комплемент, його властивості, шляхи активації.Фагоцитоз, види фагоцитуючих клітин.Стадії фагоцитозу.Завершений та незавершений фагоцитоз.
До неспецифічних факторів можна віднести шкіру і слизові оболонки, що є бар'єром, який затримує сторонні предмети і не допускає їх у внутрішнє середовище організму. Також слиз носа, сеча, слина, сльози містять бактерицидні реовини несп. ЗахистуДо неспецифічних гуморальних факторів імунітету відносяться:
— циркулюючі в крові інтерферони — вони підвищують стійкість кліток до дії вірусів, перешкоджають з розмноженню в клітках;
— З-реактивний білок крові — утворить комплекси зі збудниками інфекції, викликаючи тим самим активізацію системи комплементу, а також деякі клітки імунної системи (фагоцити й ін.);
— білки системи комплементу — звичайно неактивні, але здобувають імунологічну активність під впливом інших факторів імунітету;
— лізоцим — фермент, що розчиняє клітинні стінки інфекційних мікроорганізмів;
— трансферін — перешкоджає розмноженню мікроорганізмі.
Комплемент- складний комплекс білків крові, що складається з 9 основних фракцій С1-С9, всього до цієї системи входить більше 30 білків.
Класичний шлях- система компл. Активується комплексом антиген-антитіло, якщо антигеном є клітина, яка в результаті руйнується.
Альтернативний шлях-активація здійснюється ліпополісахаридами грамнегативних бактерій з участю білків пропердинової системи.
Фагоцитоз-процес поглинання та перетравлення чужих для імунної системи організму факторів.До фагоцитів належать клітини мієлопоетичного ряду(базофіли, еозинофіли, нейтрофіли) та макрофагально-моноцитарної системи(моноцити і тканинні макрофаги)
Стадії фагоцитозу:
*хемотаксис
*адгезія бактерій на поверхні фагоцита
*активація мембрани фагоцита і поглинання м.о.
*злиття фагосоми з лізосомою і ферментне розщеплення м.о.
*видалення продуктів розпаду за межі клітини
-фагоцитоз завершений - при якім відбувається внутрішньоклітинне переварювання поглинених мікроорганізмів і частинок
-фагоцитоз незавершений -при якім поглинені мікроорганізми не зазнають внутрішньоклітинному переварюванню, а зберігаються або розмножуються у фагоцитах.
34. Імунна система організму, її органи. Роль вилочкової залози в імунній відповіді.Клітини імунної системи, їх різновиди(Т,В-лімфоцити і макрофаги). Їх роль в клітинному і гуморальному імунітеті.
Відповіддю на введення генетично чужорідних субстанцій(антигенів) є продукція антитіл-імуноглобулінів, що виробляються клітинами лімфоїдних органів.
Лімфоїдні органи поділяються на:
*Первинні(центральні)- тимус, черв.кістковий мозок, фабрицієва сумка(у птахів)
*Вторинні(переферичні)-селезінка, лімф.вузли, одиночні лімф. Фолікули слиз.оболонки.
Головним компонентом імунної системи організму є лімфоїдна стовбурова клітина, що генерує утворення клітин-попередників Т-лімфоцитів і Б-лімф.
Т-клітини-55-60% загальної к-сті лімф.периферичної крові.
Б-клітини-25-30%
Тривалість життя у Т-лімф.- місяці, роки; у Б-кілька тижнів
Субпопуляції Т-лімф: Т-хелпери, Т-супресори, Т-кіллери.
У розвитку імунної відповіді на антиген беруть участь Т,Б-лімф., макрофаги
Макрофаги виробляють лізоцим, цитотоксини, інтерферон, фактори комплементу.
Макрофаги захопивши і переробивши антиген, вступають у контакт з Т і Б-лімф., передаюси їм інформацію, потрібну для здійснення імуногенезу.
Т-лімфоцити- забезпечують клітинний імунітет при більшості вірусних інфекцій.У розвитку імунних реакцій беруть участь інтерлейкіни і фактори, що активують макрофаги.
Б-лімфоцити- гуморальний імунітет, проти бактеріальної інфекції.Антитілотворні інфекції виникають із Б-лімф.
Центральним органом клітинного імунітету є тимус.
Фази:
1)звязування антигену Т-лімфоцитом;
2)проліферація Т-лімф.
3)синтез медіаторів
4)цитотоксичний ефект
Система Б-лімфоцитів складається з:
1)Б-лімф. Попередників-виділення антитіл
2)Б-супресори-розвиток імунологічної толерантності(пригнічення розмноження
3)Б-кіллери, що взаємодіють з Іg(?), спричиняючи руйнування останніх.
35.Форми імунної відповіді організму.Імунологічна толерантність, причини її винекнення.Імунологічна пам”ять, її механізм.
Кількість і швидкість утворення антитіл на кожен антиген є генетично детермінована.Вона залежить, також, від дози антигена, шляхів його проникнення в організм.Перший контакт з антигеном зумовлює первинну імунну відповідь, при якій розрізняють 4 фази синтезу антитіл:
1)Індукції(лаг-фаза) - триває від моменту проникнення антигена в організм до початку зростання кількості антитіл (24-96 годин).
2)Логарифмічне збільшення титру антитіл - продовжується 2-7 днів.
3) Максимальної концентрації антитіл.
4)Зменшення продукції антитіл - декілька тижнів, місяців і навіть років.
Повторна імунізація через декілька тижнів або місяців призводить до вторинної імунної відповіді. При цьому тривалість кожної фази реакції інша:Спостерігається значне скорочення фази індукції. Потім наступає раптове збільшення антитіл у сироватці (одночасно з'являються IgG і IgM), які знаходяться там триваліший період, ніж при первинній імунній відповіді.
*Процес синтезу антитіл пояснила клонільно-селекційна теорія Ф.Бернета.
Завдяки цьому механізму антитіла можуть накопичуватися в достатньо високій концентрації, щоб ефективно боротися з інфекцією. Проліферуючому клону необхідний час для утворення достатньої кількості клітин. От чому проходить зазвичай декілька днів після контакту з антигеном, перш ніж в сироватці крові виявляються антитіла. Оскільки ці антитіла утворилися в результаті антигенної дії, ми говоримо про набуту імунну відповідь.Інтенсивність відповіді, що здійснюється популяцією лімфоцитів (ті що вже контактували із антигеном), зростає, головним чином, за рахунок збільшення клітин, здатних сприймати антигенний стимул. При цьому повинна існувати комбінація механізмів, що включають зберігання антигена, існування популяції лімфоцитів і постійну підтримку окремих клонів клітин, що і приводить до здатності імунної системи запам'ятовувати (набутого імунітету)Таким чином формується природна толерантність імунної системи до власних тканин і органів.
*.Імунна пам'ять — здатність імунної системи організму після першої взаємодії з антигеном специфічно відповідати на його повторне введення. Пам»ять зберігається довго, особливо у випадку імуноглобулінів класу G
Імунна пам'ять принципово відрізняється від нейронної пам'яті за способом її введення, рівнем зберігання та обсягом інформації. Осноновні носії імунної пам'яті - довгоживучі Т-і В-лімфоціти, які утворюються при первинній імунній відповіді і продовжують циркулювати з кров'ю та лімфою як специфічні попередники антиген-реактивних лімфоцитів. При вторинній відповіді ці клітини розмножуються, забезпечуючи швидке збільшення клону антиген-реактивних лімфоцитів даної специфічності. З інших механізмів імунної пам'яті важливе значення мають імунні комплекси, цитофільні антитіла, а також блокуючі антитіла.
