Нуклеозиды, нуклеотиды и нуклеиновые кислоты.
Нуклеозиды- частный случай молекул, состоящих из углеводной части и неса
харной части - агликонной и называемых гликозидами. Вообще в гликозидах агликонная
часть может быть остатком любой молекулы, способной реагировать с полуацетальным
гидроксилом углеводной части. Это, например, может быть спирт, дающий О-
алкилгликозид:
Получившийся в данном случае гликозид, является О-метилгликозидом.
О-гликозидами являются также ди-, три-, олиго- и полисахариды. Кроме них в природе имеются и другие О-гликозиды, например, красители антоцианы: комплексы металлов Ni, Cu, Fe, Мо с пигментной частью:
Наряду с О-гликозидами в природе существуют S-гликозиды и N-гликозиды. Среди N-гликозидов особенно важными являются нуклеозиды - производные пуриновых и пиримидиновьк оснований. Общая формула нуклеозидов следующая:
Имеются и другие нуклеозиды, мало отличающиеся по строению от названных в
таблице, расположенной ниже. Как правило в этих нуклеозидах в агликоновой части по
являются лишние метильные или оксиметильные группы. ,
Свободные нуклеозиды содержатся в небольших концентрациях в различных
тканях. Но основная их масса входит в виде фрагментов в молекулы нуклеиновых кислот
и нуклеотидов. . ■
Нуклеозиды - бесцветные кристаллические вещества с высокой температурой плавления. Например: у тимидина - 187°С, у аденозина - 229°С. Все нуклеозиды оптически активны, но не мутаротируют, т.к. у них нет свободного полуацетального гидроксила. У тимидина [a]D = +32.2°С. У аденозина [a]D = +60°С. Большинство нуклеозидов хорошо растворимы в горячей воде, хуже в холодной, гораздо лучше, чем в холодной воде, они растворимы в кислых и щелочных растворах. Пиримидинсодержащие нуклеозиды при прочих равных условиях растворимы лучше пуринсодержащих.
Химические свойства нуклеозидов определяются природой азотистых оснований, строением углеводной части и прочностью N-гликозидной связи.
Нуклеозиды имеющие в агликоне -ОН группу обладают свойствами слабых кислот (на уровне фенолов). Их 9 < рКа < 10. Нуклеозиды имеющие свободную аминогруппу обладают свойствами слабых оснований.
Наиболее важные N-гликозиды. Таблица.
| Название нуклеозида | Название пуриновых или пиримидиновьгх оснований (агликонов) | R | R’ (название моносахарида) |
| Аденозин (9-β-D-рибофуранозиладенин) | Аденин | 1. ОН D-рибоза Н 2' - D- дезоксирибоза | |
| Гуанозин (9-β-D-рибофуранозилгуанин) | гуанин | 1. ОН D-рибоза Н 2' - D- дезоксирибоза | |
| Цитидин (3-β-D-рибофуранозилцитозин, цитозинрибозид) | цитозин | 1. ОН D-рибоза 2. Н 2' - D- дезоксирибоза | |
| Уридин (3-β-D-рибофуранозил-урацил, урацилрибо-зид) | урацил | ОН D-рибоза | |
| тимидин [(3-β-D-2'-дезоксирибофу-ранозил)-2,4-диокси-5-метилпиримидин] | тимин | Н 2' - D- дезоксирибоза |
N-гликозидная связь пуринсодержащих нуклеозидов достаточно легко гидроли-зуется с получением моносахарида и азотистого основания. Например в 10% серной кислоте за 1час при t = 100°C. Пиримидиновые нуклеозиды гораздо устойчивее. Они не гид-ролизуются при кипячении в кислоте, однако гидролизируется в щелочах, при этом разрушается углеводная часть молекулы. Устойчивость к гидролизу теряется при гидрировании так называемой двойной связи в положении 4,5. Кроме того она теряется при броми-ровании производных пиримидина в положение 5.
Нуклеозиды могут быть проалкилированы и проацилированы по атомам азота кольца и аминогруппам. В пиримидиновых нуклеозидах водород в положении 5 может замещаться на галоген, нитро- и нитрозогруппу.
При действии нитрита натрия и соляной кислоты в аденозине, гуанозине и цити-дине NH2-группы «дезаминируются» по известной реакции:
и получаются другие нуклеозиды: инозин, ксантозин и уридин.
В отличие от нуклеозидов, содержащих 2-D-дезоксирибозу, нуклеозиды, содержащие рибозу, подвергаются периодатному окислению.
Получают нуклеозиды химическим или ферментативным гидролизом ДНК или
РНК.
Имеются и синтетические методы получения нуклеозидов, что используется для получения аналогов природных нуклеозидов для биологических исследований, в фармакологии и медицине. Например, для получения антибиотика – пуроницина:
Нуклеотиды- сложные эфиры нуклеозидов и фосфорной кислоты - природные
биологически активные соединения, широко распространенные в животных и раститель
ных тканях и микроорганизмах, как в свободном виде, так и в составе соединений: нук-
леиновых кислот, некоторых коферментов, и витаминов.
Мононуклеотидами, или собственно нуклеотидами называют соединения, образованные из одного фрагмента азотистого основания, одного фрагмента моносахарида и одного остатка фосфорной кислоты. Например, тимидинмонофосфорная кислота.
Такие нуклеотиды, содержащие остатки тимина, аденина, гуанина, цитозина и
урацила являются мономерами полимерных молекул дезоксирибонуклеиновых кислот
(ДНК) и рибонуклеиновых кислот (РНК), образованных путем поликонденсации с выде-
лением воды:
Мононуклеотиды, соединяясь друг с другом с выделением воды от фрагментов
фосфорных кислот, образуют динуклеотиды, например, никотинамидадениндинуклеотид НАД+:
По количеству остатков фосфорной кислоты различаютнуклеозидмонофосфор-ные (как выше представленная тимидинмонофосфорная кислота), нуклеозиддифосфорные и нуклеозидтрифосфорные кислоты.
В качестве примера можно привести аденозинтрифосфорную кислоту:
При кислотном гидролизе АТФ отщепляются γ и β-остатки фосфорной кислоты и разрывается N-гликозидная связь, а α-остаток остаётся связанным с рибозой. При мягком щелочном гидролизе разрывется β-связь и получается пирофосфат и аденозин-5'-монофосфат.
АТФ, как диамин, образует в воде медные комплексы и, как 1,2-диол, окисляется йодной кислотой. Действие нитрита натрия и соляной кислоты приводит к замене группы NH2 в остатке аденина на группу ОНи превращение АТФ в инозинтрифосфорную кислоту.
При отщеплении каждого из первых двух фосфатных остатков выделяется приблизительно 40 кДж/моль энергии, которая используется на энергетические нужды организма.
Нуклеиновые кислоты
Нуклеиновые кислоты- сложные полимеры биологического происхождения. Они разделяются на две группы: дезоксирибонуклеиновые кислоты (ДНК) и рибонуклеиновые кислоты (РНК). Различие между этими группами кислот заключается, в том что в состав ДНК входит в качестве фрагментов полимерной цепи 2-D-дезоксирибоза, а в РНК в качестве фрагментов цепи входит D-рибоза. В качестве фрагментов макромолекулы, являющихся ответвлениями от полимерной цепи выступают пуриновые и пиримидино-вые основания. В ДНК это аденин, гуанин, цитозин и тимин, а в РНК аденин, гуанин, ци-тозин и урацил. Следует отметить, что в состав ДНК микроорганизмов входят и другие азотистые основания, впрочем не сильно отличающиеся (на группы СН3-и -СН2ОН).
Полимерная цепь ДНК построена следующим образом: за счет отрыва протона от гидроксилов в положениях 5' и 3' дезоксирибозы и гидроксилов от фосфорной кислоты с выделением воды (т.е. это поликонденсация) образуется полимерная цепь. Азотистые основания (АО) в образовании полимерной цепи не участвуют. Ниже представлена схема образования фрагмента макромолекулы ДНК из нуклеотидов:
Прямоугольником выделено многократно повторяющееся элементарное звено, которым, как видно, является остаток нуклеотида. В нём в качестве азотистого основания может быть один из четырех остатков: аденина, гуанина, цитозина или тимина.
РНК построена аналогично. Ниже приведен участок полимерной цепи РНК. Элементарным звеном в этой цепи, то есть многократно повторяющимся участком является нуклеотид, включающий в себя остатки ортофосфорной кислоты, рибофуранозы и одного из следующих оснований: аденина, гуанина, цитозина или урацила:
Когда из биологических тканей были выделены нуклеиновые кислоты и проведены работы по изучению состава и строения нуклеиновых кислот, то обнаружились следующие закономерности:
1) Молярное содержание аденина равно молярному содержанию тимина.
2) Молярное содержание гуанина равно молярному содержанию цитозина.
3) Суммарное молярное содержание пуриновых нуклеотидов равно суммарному со
держанию пиримидиновых нуклеотидов.
4) Суммарное молярное содержание нуклеотидов, имеющих в положении 6 и 4 амино
группу, равно суммарному молярному содержанию нуклеотидов, имеющих в поло
жении 6 и 4 карбонильную группу.
С учётом установленных закономерностей и на основании данных рентгено-структурного анализа и спектральных данных Уотсон и Крик в 1953 году создали модель пространственной конфигурации ДНК. Эта модель совмещает простоту и удивительную стройность и до самого последнего времени согласуется с новыми экспериментальными данными. Согласно модели Уотсона и Крика молекула ДНК состоит из двух полинуклео-тидных цепей, имеющих в качестве первичной структуры цепь из чередующихся фрагментов молекул 2-D-дезоксирибозы и фосфорной кислоты. Две такие цепи обвиваются вокруг общего цилиндра с одинаковым шагом винтовой линии.
При этом одна ветвь отстаёт от другой на полшага. Получается как бы «двухзаходная резьба» (как на импортных шурупах). Гетероциклические основания при этом обращены внутрь цилиндра и могут поворачиваться вокруг C-N гликозидной связи (а возможно и вокруг связи О-С3 и О-С3' дезоксирибозного фрагмента) так, что азотистые основания оказываются в одной плоскости. Упомянутые выше экспериментальные данные (пункты а-г) позволили Уотсону и Крику предположить, что в одну плоскость могут попасть только соответствующие друг другу по расположению амино- и карбонильных групп пуриновое с одной стороны и пиримидиновое с другой стороны основания. Такие основания называются комплементарными, то есть взаимно дополняющими. Нетрудно догадаться, что каждый гуанин должен быть комплементарен цитозину, так как будучи в одной плоскости и расположившись определённым образом они образуют три водородных связи:
Аналогично для пары - аденин-тимин, но образуются только две водородные связи:
Получается две цепи сцепленные «тяжами» из азотистых оснований, связанных довольно прочно (Г-Ц=60-80 кДж/моль; А-Т=40-56 кДж/моль)
Небольшой фрагмент ДНК можно схематически изобразить так:
Фрагмент ДНК часто изображают в виде двух спиралей скреплённых тяжами из комплементарных азотистых оснований. Расстояние между плоскостями двух соседних слоев, состоящих из оснований составляет 3,4 Ả, что очень близко к расстоянию между слоями в графите - 3,35 Ả. Один виток - 34 Ả, в нем уложено десять слоев из комплементарных азотистых оснований. Угол поворота между линиями, соединяющими места прикрепления азотистых оснований к дезоксирибозе (атомы С3 рибозы одной и другой ветви) составляет 360°. Диаметр цилиндра около 20 Ả. Считается, что 11 Ả из них занимает
| 34А |
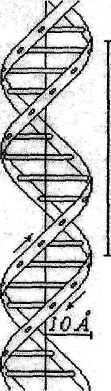 плоская система комплементарной пары А-Т или Г-Ц. Остальные
плоская система комплементарной пары А-Т или Г-Ц. Остальные
4,5 (20-11=9) Ả, по-видимому занимают остатки дезоксирибозы и
фосфорной кислоты, расположенные под углом как к оси цилиндра,
так и к воображаемым линиям, соединяющим атомы углерода (С1) в
остатках дезоксирибозы с двух сторон от комплементарных азотистых оснований. '
| 3,4А |
| Схема, двух- спиральной структуры ДНК (модель Уотсона и Крика Крика). |
Первый угол обеспечивает подъём по винтовой линии, а второй уменьшает размеры цилиндра. Не будь этого угла поворота, то есть, если бы оба фрагмента дезоксирибозы (их размер ~3 Ả) лежали в той же плоскости, что и азотистые основания, то диаметр цилиндра был бы на много больше: (3+5) *2=1б Ả 16+11=27 Ả. Тот и другой углы обеспечиваются валентным углом между плоскостью гетероцикла и плоскостью фуранозного кольца дезоксирибозы, а также поворотом этой плоскости вокруг связи N3(9)-C.
Число нуклеотидньгх единиц в цепи ДНК составляет от 3 000 до 10 000 000.Это означает, что молекулярная масса составит (аМА+ аМт + вМг + вМц) 2n, где n - число нуклеотидных единиц, МА, Мт, MГ и МЦ - молярные массы мононуклеотидов из аденина, тимина, гуанина и цитозина соответственно. Коофициенты а и b - доли (от единицы) тех или иных нуклеотидов. Доля заметно колеблется для различных ДНК. Так, например, соотношение (Г+Ц) / (А+Т) колеблется для разных видов, (см. Таблицу 1)
Молярная масса большинства известных ДНК составляет от 4 до 16 миллионов, а для некоторых фагов 150 миллионов г/моль.
ДНК хорошо растворяется в воде, в слабых и даже крепких солевых растворах, образуя вязкую бесцветную жидкость. Она осаждается 2-3 объёмами 96% этанола, образуя студнеобразный или волокнистый осадок. ДНК денатурируется при нагревании водных растворов до 100°С, при подкислении до рН = 1-2 или подщелачивании выше рН = 10-12. При кислотном гидролизе от ДНК отщепляются пуриновые основания: аденин и гуанин. При нагревании с гидразином, наоборот, разрушаются пиримидиновые основания: цитозин и тимин. При действии на ДНК фермента дезоксирибонуклеазы происходит гидролиз фосфорноэфирных связей ДНК и она разбивается на нуклеотиды (моно). При помоши ферментов поджелудочной железы удаётся получить смесь тетра-, три- и динук Роль ДНК в организме состоит (по меньшей мере) в следующем. С помощью определённого кода на каждой из ветвей ДНК записывается вся наследственная информация. Эта информация потом считывается с помощью построения РНК комплементарной , участкам каждой ветви ДНК. На РНК как на матрице строится белок. Установлено, например, что сочетанию в цепи РНК трёх последовательно расположенных урацилов в белке соответствует фенилаланин. То есть, если взять раствор смеси аминокислот и поместить в этот же сосуд полинуклеотид, состоящий только из уридинмонофосфатов, то быстро при комнатной температуре синтезируется белок, состоящий только из фенилала- нина, а все остальные аминокислоты, останутся в растворе свободными даже если их концентрации были больше, чем концентрация фенилаланина у каждой. Таким образом нуклеиновые кислоты абсолютно селективные катализаторы поликонденсации аминокислот. РНК является той матрицей, на которой идёт синтез белка.
ДНК в клетках живых организмов не распределена равномерно (диффузно), а организована в особые структуры, связанные с передачей наследственных свойств. Эти структуры составляют основу так называемого ядерного вещества клеток - хроматина. Они представлены в виде хромосом и у высших организмов локализованы в клеточном ядре, а у большинства бактерий и других низших организмов в протоплазме, в виде нук-леидов. Хромосома представляет собой единый комплекс, состоящий из ДНК и молекул белка.
Таблица 1
| Вид | Показатели специфичности | |||||||||||||||||
| В ДНК: Г + Ц / А + Т | В РНК: Г + Ц / А + У | |||||||||||||||||
| Животные: | ||||||||||||||||||
Высшие растения:
| ||||||||||||||||||
| Грибы: Шампиньон Аспергилл | 0,80 1,00 | 1,01 1,23 | ||||||||||||||||
| Бактерии:Туберкулёзная палочка Тифозная бактерия Стафилококк | 2,08 1,13 0,53 | 1,45 1,21 1,05 | ||||||||||||||||
| Вирусы: Табачной мозаики Желтой мозаики репы | 0,78 1,23 |
Генетическая роль ДНК (впервые доказана экспериментально ещё в 1944 году) связана с двумя процессами:
1) точным воспроизведением самой себя, то есть способностью к редупликации
(самоудвоению). Это необходимо для того, чтобы у потомков была точно такая же
ДНК, как у родительских клеток;
2) определяющим влиянием на обмен веществ в клетке и, следовательно, на её биоло-
гические свойства. Это влияние ДНК не является прямым и непосредственным, а
идёт различными путями через белковый синтез.
Рибонуклеиновая кислота (РНК)
Мономерной единицей РНК, как было показано на странице 38, является нуклеотид на основе D-рибозы, а в качестве одного из агликонов вместо тимина выступает урацил. Строение макромолекулы такое же как у ДНК. Полимерная цепь так же не разветвлена.
РНК хорошо растворяется в воде и слабых водно-солевых растворах (не крепких); высокополимерная РНК с молекулярной массой 0,5 - 2 миллиона медленно выпадает в растворах с концентрацией NaCl 1 - 1,5 моль/л, что используется для отделения от низкополимерных РНК. РНК может быть осаждена тремя объёмами этанола с добавлением ацетатного буфера (смесь СН3СООН и CH3COONa ) с рН = 5. Фосфорно-эфирные связи РНК легко гидролизуются в кислой (рН = 2) и щелочной среде (рН = 13). В результате образуется смесь нуклеотидов.
РНК из различных организмов не одинаковы как биологически, так и химически.
Представление об этом даёт таблица 1. В подавляющем большинстве случаев в РНК
(Г+Ц) > (А+У) в отличие от подобного неравенства у ДНК для (Г+Ц) и (А+Т), где знак
может быть и «>» и «<». .■
Установлено, что любая клетка содержит сложный набор различных макромолекул РНК с различной химической и биологической специфичностью. Имеется несколько функционально различных типов РНК: рибосомальная РНК, «растворимая» РНК, «информационная» РНК; нуклеотидный состав этих РНК различен.
Примерно 80% от всех РНК составляет рибосомальная РНК, входящая в состав клеточных рибонуклеопротеидов, или рибосом. Эта РНК имеет молекулярную массу от 0,5 до 1,5 миллионов, её нуклеотидный состав у разных организмов очень близок, что обуславливаег сравнительно малые вариации в составе суммарных РНК у разных видов: Другой тип клеточной РНК - РНК клеточного сока или так называемая «растворимая» или адапторная РНК - составляет обычно 10-15% от всей массы РНК клетки. Её молекулярная масса гораздо меньше – 20 - 30 тысяч. Она не связана в какие-либо фиксированные нуклеопротеидные комплексы. Около 1-10% массы всей клеточной РНК составляет информационная, или матричная РНК, молекулы которой по соотношению своих нуклеоти-дов и нуклеотидной последовательности являются копиями отдельных участков одной из двух цепей молекулы ДНК. По молекулярной массе молекулы информационной РНК очень различны, но большую часть составляют большие молекулы массой 2 миллиона г/моль и более. В клетке эта РНК может присутствовать во временной связи с ядерными компонентами: с рибосомами, а так же и в свободном виде.
Молекула РНК представляет собой гибкую неразветвленную нить, состоящую из одной полинуклеотидной цепи. В растворе или в клетке эта нить свернута в компактную частицу под влиянием сильного взаимодействия между основаниями разных участков: РНК. Часть из них являются комплементарными, и на этих участках происходит закручивание (как в ДНК), но всегда остаются петли на некомплементарных участках.
Биологическая функция РНК в живой клетке связана с синтезом белка. Процесс
биосинтеза белка начинается с образования связи аминокислот с аденинсодержащим нук-
леотидом. Биохимики называют это «активацией аминокислот»:
На самом деле это реакция АТФ с аминокислотой (АК) и освобождением пирофосфата:
На следующей стадии вступает в реакцию «растворимая» РНК. Она взаимодействует с молекулой I так, что аминокислотный остаток присоединяется своим карбоксилом к атому углерода в положении 2' или 3' концевого аденозина «растворимой» РНК, с образованием сложноэфирной связи. Для такого акцептирования аминокислоты необходима концевая группировка ЦЦА. В ферментативном взаимодействии «активированных аминокислот» с «растворимой» РНК каждому виду аминокислоты соответствуют определенные специфические для данного вида аминокислоты, молекулы «растворимой» РНК. Образовавшаяся молекула поступает в рибосомы и здесь происходит биосинтез белка: поликонденсация аминокислот в белковую цепь под влиянием специальных ферментных систем. В эти системы входит рибосомальная РНК, заключённая в рибосомы и информационная РНК, приходящая извне, после её образования на ДНК. Информационная РНК играет при этом роль основной матрицы для синтеза белковой цепи: специфическая нук-леотидная последовательность данной молекулы РНК определяет соответствующую последовательность аминокислотных остатков в белке.
По общепринятым теперь представлениям происходит это вследствие того, что в ДНК чередуются триплеты азотистых оснований, причём каждому триплету соответствует комплементарный триплет в «растворимой» РНК, поставившей на строительство белка одну аминокислоту. Получается определённая последовательность аминокислотных остатков, соответствующая триплетному коду в РHK. Например, триплету УУУ соответствует аминокислота - фенилаланин, АУГ - метионин, УГГ - триптофан.
Некоторые аминокислоты могут кодироваться не одним триплетом, а двумя, тремя, четырьмя и даже шестью различными триплетами. Например, цистеин - УГУ и УГЦ, лейцин - ЦУУ, ЦУЦ, ЦУА, ЦУГ, УУА и УУГ, аланин - ГЦУ, ГЦЦ, ГЦА, ГЦГ.
Таким образом молекулы «растворимой» РНК выступают в роли высокоспецифичных переносчиков аминокислот к месту синтеза белка, и. что самое главное, в роли расшифровщиков того кода, которым записана в цепи информационной РНК аминокислотная последовательность конструируемого белка. Специфичность белка, зависящая в конечном счёте от последовательности аминокислот в нём, определяется при синтезе последовательностью пуриновых и пиримидиновых оснований в информационной РНК. Молекулы информационной РНК - слепки с одного из участков цепи ДНК, то есть копии другого участка цепи ДНК. Точное воспроизведение ДНК на молекулярном уровне и последующая передача ДНК из поколения в поколение рассматриваются как основные факторы, обуславливающие у потомков синтез тех же белков, а следовательно, и проявление тех же специфических видовых биологических отличий и свойств, что и у родителей.
Содержание
| Пуриновые и пиримидиновые основания | |
| Строение пиримидина, имидазола и пурина | |
| Ароматичность пиримидина, имидазола и пурина | |
| Физические и химические свойства пурина и нахождение его в природе | |
| Физические свойства пурина | |
| Таутомерные формы пурина | |
| Амфотерность пурина | |
| Кислотно-основные свойства пурина | |
| Сравнение рКа пурина и имидазола с рКа других кислот | |
| Алкилирование пурина диметилсульфатом в щелочной среде | |
| Ацилирование пурина ангидридами кислот | |
| Хлорирование алкилированного в положение 9 пурина | |
| Реакция азосочетания производных пурина с солями диазония | |
| Способы получения пурина | |
| Строение алкалоидов – производных пурина: кофеина, теобромина и теофиллина | |
| Медико-биологическое значение кофеина, теобромина и теофиллина | |
| Лекарственные препараты, содержащие пуриновое ядро | |
| Строение кофермента ФАД, содержащего пуриновое ядро | |
| Строение кофермента А, содержащего пуриновое ядро | |
| Строение кофермента НАДФ, содержащего пуриновое ядро | |
| Строение и медико-биологическое значение противоопухолевых препаратов на основе пурина: 6-меркаптопурина и фопурина | |
| Противовирусные препараты на основе пурина | |
| Открытие и медико-биологическое значение мочевой кислоты | |
| Физические свойства и таутомерные формы мочевой кислоты | |
| Аденин | |
| Физические и кислотно-основные свойства аденина | |
| Таутомерные формы аденина | |
| Бромирование аденина | |
| Дезаминирование аденина | |
| Ацилирование аденина | |
| Образование перекрёстного комплекса аденина с гидроксидом меди(II) | |
| Реакция аденина с моносахаридами – образование N-гликозидов | |
| Строение аденозинтрифосфата (АТФ) | |
| Строение никотинамидадениндинуклетида (НАД+) | |
| Нахождение аденина в природе | |
| Синтез мочевой кислоты и 2,6,8-трихлорпурина по Траубе и Э. Фишеру | |
| Синтез гипоксантина из 2,6,8-трихлорпурина | |
| Синтез аденина из 2,6,8-трихлорпурина | |
| Синтез гуанина из 6-окси-2,8-дихлорпурина | |
| Гуанин | |
| Физические и кислотно-основные свойства гуанина | |
| Таутомерные формы гуанина | |
| Таутомерные формы моноанионов из гуанина | |
| Таутомерные формы монокатионов из гуанина | |
| Таутомерные формы дикатионов из гуанина | |
| Реакция гуанина с солями диазония – образование азокрасителей | |
| Строение гуаниловой кислоты и её частичный гидролиз | |
| Нахождение гуанина в природе и его биологическое значение | |
| Пиримидиновые основания | |
| Пиримидин | |
| Физические и кислотно-основные свойства пиримидина | |
| Соли пиримидина: сульфат, нитрат и перхлорат | |
| Алкилирование пиримидина – образование пиримидиниевых солей | |
| Окисление пиримидина пероксидом водорода – получение N-окиси пиримидина | |
| Реакции электрофильного замещения в пиримидине: хлорирование | |
| Распределение электронной плотности в молекуле пиримидина с позиции теории резонанса Лайнуса Полинга | |
| Реакции нуклеофильного замещения в пиримидине: реакции с литий и магнийорганическими соединениями | |
| Синтез пиримидина: а) получение барбитуровой кислоты из мочевины и малонового эфира | |
| Таутомерные формы барбитуровой кислоты | |
| Синтез пиримидина: б) получение его через 2,4,6-трихлор и 2,4,6-трийодпиримидин | |
| Цитозин | |
| Физические и кислотно-основные свойства цитозина | |
| Амфотерные свойства цитозина: реакции с кислотами и щелочами | |
| «Дезаминирование» цитозина действием нитрита натрия в соляной кислоте – превращение его в урацил | |
| Восстановление цитозина водородом на платине с одновременным «дезаминированием» | |
| «Дезаминирование» цитозина кипячением в кислотах и щелочах | |
| Реакция цитозина с солями диазония – образование азокрасителей | |
| Реакции электрофильного замещения в цитозине: бромирование | |
| Реакции электрофильного замещения в цитозине: нитрование и сульфирование | |
| Реакция цитозина с моносахаридами – образование N-гликозидов | |
| Способ получения цитозина из S-этилпсевдотиомочевины и натрового производного формилуксусной кислоты | |
| Способ получения цитозина через 2,4-димеркаптопиримидин с последующим аминированием и гидролизом | |
| Нахождение цитозина в природе и его биологическое значение | |
| Строение цитидиновых коферментов | |
| Получение цитидиновых коферментов и их биологическое значение | |
| Урацил | |
| Физические и кислотно-основные свойства урацила | |
| Замена оксигрупп в урациле на хлор действием пентахлорида фосфора | |
| Ацилирование урацила и гидролиз образовавшегося сложного эфира | |
| Реакция урацила с хлором | |
| Алкилирование урацила – получение N-алкильных производных | |
| Действие гидразина на урацил – получение пиразолона и мочевины | |
| Окисление урацила перманганатом калия в кислой среде | |
| Взаимодействие урацила с формальдегидом в отсутствии и в присутствии соляной кислоты | |
| Восстановление урацила водородом на палладии или платине | |
| Получение урацила из 2-этилмеркапто-6-оксипиримидина | |
| Синтез урацила по Баудишу | |
| Нахождение урацила в природе и его медико-биологическое значение | |
| Производные урацила | |
| 5-бромурацил и его медико-биологическое значение | |
| 5-фторурацил как противоопухолевое средство и как радиосенсибилизатор | |
| Тимин | |
| Физические и кислотно-основные свойства тимина | |
| Таутомерные формы тимина | |
| Алкилирование тимина – получение О-алкильных производных | |
| Реакция тимина с моносахаридами – образование N-гликозидов | |
| Получение тимидинфосфорных кислот | |
| Нуклеозиды, нуклеотиды и нуклеиновые кислоты | |
| Нуклеозиды. Примеры гликозидов | |
| Общая формула N-гликозидов | |
| Физические свойства N-гликозидов | |
| Химические свойства N-гликозидов | |
| Наиболее важные N-гликозиды. Таблица | |
| Химические свойства N-гликозидов. Продолжение. | |
| «Дезаминирование» аденозина, гуанозина и цитидина действием нитрита натрия в соляной кислоте – превращение их в инозин, ксантозин и уридин соответственно | |
| Периодатное окисление N-гликозидов, содержащих рибозу | |
| Получение нуклеозидов химическим или ферментативным гидролизом ДНК или РНК | |
| Строение антибиотика – пуроницина | |
| Нуклеотиды. Мононуклеотиды. Строение тимидинмонофосфорной кислоты | |
| Нуклеотиды как мономеры для синтеза полимерных молекул ДНК или РНК | |
| Строение никотинамидадениндинуклеотида – НАД+ | |
| Строение аденозинтрифосфорной кислоты | |
| Нуклеиновые кислоты. Их виды | |
| Структурные различия между ДНК и РНК | |
| Схема образования фрагмента макромолекулы ДНКиз нуклеотидов | |
| Строение участка полимерной цепи РНК | |
| Закономерности в соотношениях между пуриновыми и пиримидиновыми основаниями | |
| Описание модели строения макромолекулы ДНК по Уотсону и Крику | |
| Комплементарные пары гуанин-цитозин и аденин-тимин | |
| Энергия водородных связей гуанин-цитозин и аденин-тимин | |
| Схематическое изображение фрагмента молекулы ДНК | |
| Схема двухспиральной структуры ДНК | |
| Молярная масса и физико-химические свойства ДНК | |
| Роль ДНК в организме | |
| Таблица показателей специфичности отношений (А+Т) / (Г+Ц) для различных видов организмов | |
| Генетическая роль ДНК | |
| Рибонуклеиновая кислота | |
| Физико-химические свойства РНК | |
| Кислотный и щелочной гидролиз РНК | |
| Виды РНК: рибосомальная, растворимая или адапторная и информационная | |
| Частичное закручивание на комплеметарных участках РНК | |
| Петли на некомплементарных участках РНК | |
| Биологическая функция РНК в живой клетке | |
| Строение «активированной» для синтеза белка аминокислоты и её получение из аминокислоты и АТФ | |
| Роль различных видов РНК в биосинтезе белка | |
| Кодирование аминокислот триплетами азотистых оснований | |
| Роль ДНК и РНК в передаче наследственной информации | |
| Содержание | |
