Классификация гормонов по химическому строению 4 страница
Функционирование цитохрома Р450. Известно, что молекулярный кислород в триплетном состоянии инертен и не способен взаимодействовать с органическими соединениями. Чтобы сделать кислород реакционно-способным, необходимо его превратить в синглетный, используя ферментные системы его восстановления. К числу таковых принадлежит моноксигеназная сисгема, содержащая цитохром Р450. Связывание в активном центре цитохрома Р450 липофильного вещества RH и молекулы кислорода повышает окислительную активность фермента. Один атом кислорода принимает 2 е и переходит в форму О2-. Донором электронов служит NADPH, который окисляется NADPH-цитохром Р450 редуктазой. О2- взаимодействует с протонами: О2- + 2Н+→ Н2О, и образуется вода. Второй атом молекулы кислорода включается в субстрат RH, образуя гидроксильную группу вещества R-OH. Суммарное уравнение реакции гидроксилирования вещества RH ферментами микросомального окисления:
RH + О2 + NADPH + Н+ → ROH + Н2О + NADP+ .
Субстратами Р450 могут быть многие гидрофобные вещества как экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения. Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось.
Свойства системы микросомальногоокисления. Важнейшие свойства ферментов микросомального окисления: широкая субстратная специфичность, которая позволяет обезвреживать самые разнообразные по строению вещества, и регуляция активности по механизму индукции.
Участие трансферам в реакциях конъюгации.Все ферменты, функционирующие во второй фазе обезвреживания ксенобиотиков, относят к классу трансфераз. Они характеризуются широкой субстратной специфичностью.
УДФ-глюкуронилтрансферазы
Локализированные в основном в ЭР уридин-дифосфат (УДФ)-глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходе микросомального окисления.

В общем виде реакция с участием УДФ-глюкуронилтрансферазы записывается так:
ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ.
Сульфотрансферазы

Цитоплазматические cульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3H) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам Реакция с участием сульфотрансферазы в общем виде записывается так:
ROH + ФАФ-SO3H = RO-SO3H + ФАФ.
Ферменты сульфотрансферазы и УДФ-глюкуронилтрансферазы участвуют в обезвреживании ксенобиотиков, инактивации лекарств и эндогенных биологически активных соединений.
Глутатионтрансферазы
Особое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, простагландинов, билирубина, жёлчных кислот, продуктов ПОЛ. Известно множество изоформ ГТ с различной субстратной специфичностью. В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях. Для работы ГТ требуется глутатион (GSH).
Глутатион - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цис-теину карбоксильной группой радикала).

ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глугатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
- путём конъюгации субстрата R с глутатионом (GSH):
R + GSH → GSRH,
- в результате нуклеофильного замещения:
RX + GSH → GSR + НХ,
- восстановления органических пероксидов до спиртов:
R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O
Сисгема обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционно-способны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма. ГТ своими гидрофобными центрами могут нековалентно связывать огромное количество ли-пофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином. ГТ могут ковалентно связывать ксенобиотики, являющиеся сильными электролитами. Присоединение таких веществ - "самоубийство" для ГТ, но дополнительный защитный механизм для клетки.
132. Металлотионеин и обезвреживание ионов тяжелых металлов. Белки теплового шока.
Металлотионеин - небольшой, обогащенный цистеином белок, способный связывать двухвалентные металлы. Роль металлотионеина состоит в регуляции концентрации в клетке таких микроэлементов, как цинк и медь , а также в связывании ядовитых тяжелых металлов , например, кадмия и ртути благодаря способности образовывать хелатные соединения с ионами тяжелых металлов. Отравление клеток организма тяжелыми металлами сопровождается накоплением металлотионеина благодаря усилению транскрипции гена (в культурах клеток описаны случаи амплификации этого гена, определяющей их устойчивость к ядам). Геном млекопитаюших содержит несколько генов металлотионеина, различающихся особенностями регуляции.
Белки теплового шока — это класс функционально сходных белков, экспрессия которых усиливается при повышении температуры или при другихстрессирующих клетку условиях. Повышение экспрессии генов, кодирующих белки теплового шока, регулируется на этапе транскрипции. Чрезвычайное усиление экспрессии генов, кодирующих белки теплового шока является частью клеточного ответа на тепловой шок и вызывается в основном фактором теплового шока (HSF англ. heat shock factor). Белки теплового шока обнаружены в клетках практически всех живых организмов, от бактерий до человека. Высокие уровни белков теплового шока в клетке наблюдают после воздействия различных стрессирующих факторов — при инфекциях, воспалительных процессах, внешних воздействиях токсинов (этанол, мышьяк, тяжелые металлы), при ультрафиолетовом облучении, голодании, гипоксии, недостатке азота (у растений) или нехватке воды. Белки теплового шока называют белками стресса, так как повышение экспрессии соответствующих генов часто наблюдается при ответе на стресс.
Точный механизм, по которому тепловой шок активирует экспрессию генов белков теплового шока, не выяснен. Однако, некоторые исследования свидетельствуют о том, что активация белков теплового шока происходит неправильно сложенными или поврежденными белками.
Шапероны.Белки теплового шока действуют как внутриклеточные шапероны в отношении других белков. Белки теплового шока играют важную роль в белок-белковых взаимодействиях, например, при фолдинге и сборке сложных белков, препятствуют нежелательной агрегации белков. Белки теплового шока стабилизируют частично свернутые белки и облегчают их транспорт через мембраны внутри клетки. Некоторые белки теплового шока экспрессируются в малых или умеренных количествах во всех типах клеток всех живых организмов, так как играют ключевую роль в существовании белков.
Внутриклеточные функции.Белки теплового шока присутствуют в клетках и при нестрессовых условиях, как бы следят за белками в клетке. Белки теплового шока утилизируют старые белки в составепротеасомы и помогат корректно свернуться заново синтезированным белкам.
Сердечно-сосудистая система. По-видимому, белки теплового шока играют важную роль в сердечно-сосудистой системе. Для белков теплового шока hsp90, hsp84, hsp70, hsp27, hsp20, и альфа-B-кристаллин показана роль деятельности сердечно-сосудистой системы. Hsp90 связывает эндотелиальную синтетазу оксида азота и гуанилатциклазу, которые в свою очередь участвуют в расслаблении сосудов. В системе передачи сигнала при помощи оксида азота далее протеинкиназа G фосфорилирует малый белок теплового шока, hsp20, который принимает участие в расслаблении гладких мышц. Hsp20 по-видимому, играет важную роль в развитии гладких мышц и предотвращает агрегацию тромбоцитов, предотвращает апоптоз после ишемического инсульта, а также имеет значение в функционировании скелетных мышц и ответе мышц на инсулин. Hsp27 является главным фосфопротеином при мышечном сокращении.
Иммунитет. Внеклеточные и связанные с плазматической мембраной, белки теплового шока, и особенно Hsp70, участвуют в связывании и презентации антигенов.
133. Токсичность кислорода: образование активных форм кислорода (супероксид анион, перекись водорода, гидроксильный радикал).
Кислород, необходимый организму для функционирования ЦПЭ и многих других реакций, является одновременно и токсическим веществом, если из него образуются так называемые активные формы.
К активным формам кислорода относят:
· ОН• - гидроксильный радикал;
· 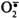 - супероксидный анион;
- супероксидный анион;
· Н2О2 - пероксид водорода.
Активные формы кислорода образуются во многих клетках в результате последовательного одноэлектронного присоединения 4 электронов к 1 молекуле кислорода. Конечный продукт этих реакций - вода, но по ходу реакций образуются химически активные формы кислорода. Наиболее активен гидроксильный радикал, взаимодействующий с большинством органических молекул. Он отнимает от них электрон и инициирует таким образом цепные реакции окисления. Эти свободнорадикальные реакции окисления могут выполнять полезные функции, например, когда клетки белой крови с участием активных форм кислорода разрушают фагоцитированные клетки бактерий. Но в остальных клетках свободнорадикальное окисление приводит к разрушению органических молекул, в первую очередь липидов, и, соответственно, мембранных структур клеток, что часто заканчивается их гибелью. Поэтому в организме функционирует эффективная система ингибирования перекисного окисления липидов.
ЦПЭ как источник активных форм кислорода
Утечка электронов из ЦПЭ и непосредственное их взаимодействие с кислородом - основной путь образования активных форм кислорода в большинстве клеток.
Кофермент Q в ЦПЭ принимает от доноров последовательно по одному электрону, превращаясь в форму семихинона - KoQH• Этот радикал может непосредственно взаимодействовать с кислородом, образуя супероксидный анион  , который, в свою очередь, может превращаться в другие активные формы кислорода:
, который, в свою очередь, может превращаться в другие активные формы кислорода:

Многие оксидазы - ферменты, непосредственно восстанавливающие кислород, образуют пероксид водорода - Н2О2. Оксидазы образуют пероксид водорода по схеме:
О2 + SH2 → S + Н2О2,
где SH2 - окисляемый субстрат.
Примеры таких оксидаз - оксидазы аминокислот, супероксид дисмугаза, оксидазы, локализованные в пероксисомах. Оксидазы пероксидом окисляют, в частности, жирные кислоты с очень длинной углеродной цепью (более 20 углеродных атомов) до более коротких, которые далее подвергаются β-окислению в митохондриях.
Монооксигеназы, например цитохром Р450, включающий один атом кислорода в окисляемую молекулу, и диоксигеназы, включающие оба атома кислорода, также служат источниками активных форм кислорода.
Пероксид водорода химически не очень активен, но способствует образованию наиболее токсичной формы кислорода - гидроксильного радикала (ОН•) по следующей реакции:
Fe2+ + Н2О2 → Fe3+ + ОН- + ОН•.
Наличие в клетках Fe2+ или ионов других переходных металлов увеличивает скорость образования гидроксильных радикалов и других активных форм кислорода. Например, в эритроцитах окисление иона железа гемоглобина способствует образованию супероксидного аниона.
134. Повреждение мембран в результате перекисного окисления липидов. Механизмы защиты от токсического действия кислорода: неферментативные (витамины Е, С, глутатион и др.) и ферментативные (супероксиддисмутаза, каталаза, глутатионпероксидаза).
