Выделение клеток методом проточной цитометрии
На основе параметров, измеряемых с помощью проточной цитометрии, можно проводить сепарацию клеток. Проанализированные клетки перемещаются в каплю, которой придается положительный/ отрицательный заряд, или в нейтральную каплю (процесс контро-
лируется компьютерной программой). Капли с флуоресцирующими клетками заряжаются положительно, а с нефлуоресцирующими - отрицательно. Капля проходит между противоположно заряженными электродами и отклоняется вправо или влево в зависимости от своего заряда. Уровень чистоты клеточных фракций, разделенных с помощью клеточного сортера, доходит до 99%.
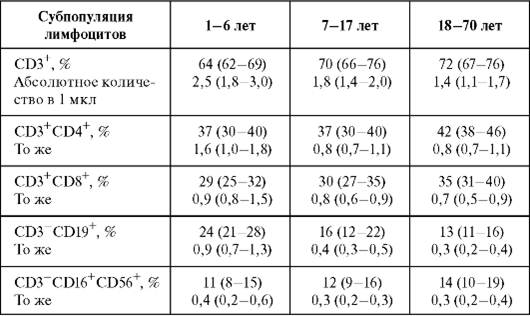
Таблица 2.2.Содержание основных субпопуляций лимфоцитов в периферической крови здоровых людей разного возраста
 2.6. ИММУНОМАГНИТНАЯ СЕПАРАЦИЯ КЛЕТОК
2.6. ИММУНОМАГНИТНАЯ СЕПАРАЦИЯ КЛЕТОК
Магнитная сепарация клеток становится стандартным и широко используемым методом, дающим надежные и воспроизводимые результаты, применяемым как для научных исследований, так и в клинической лабораторной практике.
Принцип метода.Магнитная сепарация клеток основана на использовании парамагнитных бус (микросфер), покрытых монАТ против поверхностного антигена, специфичного для интересующих клеток. Магнитные бусы имеют диаметр около 50 нм, невидимы при световой микроскопии, подвергаются биодеградации и не травмируют клетки. Поскольку размер микросфер чрезвычайно мал, то для удержания меченых клеток необходимо наличие высокоградиентного магнит-
ного поля. Для успешного разделения клеток чрезвычайно важно, чтобы микробусы после воздействия магнитного поля не проявляли остаточной намагниченности. Использование однородных по размеру и форме микробус обеспечивает: быстрое и эффективное связывание клеток; минимизацию неспецифического связывания; хорошо воспроизводимые результаты.
Метод позволяет осуществлять выделение интересующей популяции клеток из цельной крови, образцов клеток костного мозга или мононуклеарной суспензии, что обеспечивает быстрый и прямой доступ к максимальному числу целевых клеток. Частицы добавляют непосредственно к образцу биологической жидкости. После 10- 20-минутной инкубации пробирка с образцом помещается в магнитный сепаратор, где клетки интересующей популяции, связанные с магнитными частицами, улавливаются, а в супернатанте остаются не связавшиеся с микробусами клетки. При этом поддерживаются оптимальные условия жизнеспособности и функционирования клеток. Выделенные целевые клетки ресуспендируют в солевом буферном растворе и анализируют согласно протоколу исследования. При необходимости магнитные частицы впоследствии отделяются от исследуемых клеток (рис. 2.8, см. также цв. вклейку).
Метод магнитной сепарации предоставляет неограниченные возможности по выделению любой интересующей клеточной популяции. Иммуномагнитные микробусы позволяют осуществить либо положительную, либо отрицательную селекцию нужных клеток (как из клеточной суспензии, так и из цельной крови). При положительной селекции выделяемые клетки связываются с бусами, покрытыми монАТ, поверхностными маркерами данного типа клеток, а лишние клетки удаляются. При отрицательной селекции с магнитными микробусами, нагруженными монАТ, связываются клетки, которые нужно удалить. Выделяемая популяция клеток остается в клеточной суспензии. Оба типа селекции можно провести двумя способами.
1. Прямой метод - клетки инкубируют с микробусами, нагруженными моноклональными антителами к клеточным антигенам.
2. Непрямой метод - клетки на первом этапе инкубируют с первичными антителами к клеточным антигенам, которые бывают:
а) немечеными;
б) конъюгированы с биотином;
в) конъюгированы с флюорохромом.
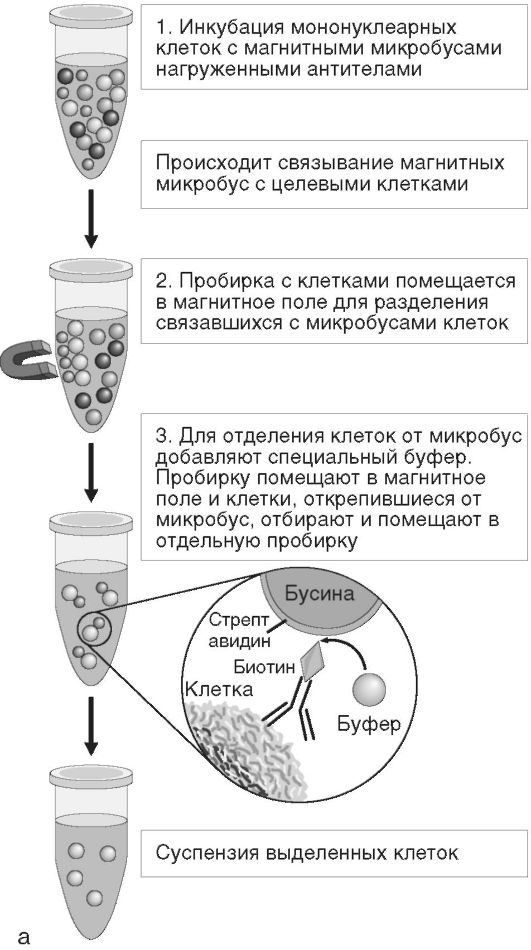
 Рис. 2.8.Иммуномагнитная сепарация: а - основные этапы; б - магнитные бусы; в - пример магнитного штатива
Рис. 2.8.Иммуномагнитная сепарация: а - основные этапы; б - магнитные бусы; в - пример магнитного штатива
• На втором этапе клетки инкубируют с вторичными антителами к иммуноглобулину (в случае использования неконъюгированных первичных антител), антителами к биотину или микробусами, конъюгированными со стрептавидином (в случае использования первичных антител, конъюгированных с биотином) или антителами к флюорохрому (в случае использования первичных антител, конъюгированных с флюорохромом). Существует несколько типов парамагнитных бус: частицы, конъюгированные с первичными антителами, - это готовые к использованию микробусы, связанные с моноклональными антителами, высокоспецифичными к определенным поверхностным маркерам клеток человека и мыши;
• частицы, конъюгированные с вторичными антителами, - это частицы, связанные с очищенными вторичными антителами, позволяющие использовать любые мышиные, крысиные или кроличьи первичные антитела для выделения целевой популяции клеток;
• неконъюгированные бусы - частицы для прямого ковалентного связывания специфических антител и лигандов.
Метод позволяет получить высокоочищенные фракции как меченых, так и немеченых клеток с гарантированным оптимальным выходом. При этом клетки по параметрам жизнеспособности готовы для последующих экспериментов. Очистка клеточной суспензии занимает сравнительно мало времени (30-40 мин). Полученные клетки можно исследовать с помощью микроскопии, метода проточной цитометрии, культивирования in vitro и использовать для других методов иммунного анализа.
Вопросы и задания
1. На каких свойствах основано разделение клеток периферической крови?
2. Приведите последовательность этапов получения мононуклеарных клеток.
3. Как можно выделить популяцию моноцитов из периферической крови человека?
4. Каким образом одновременно можно разделить мононуклеарные клетки, нейтрофилы, тромбоциты и эритроциты?
5. Представьте последовательность этапов выделения нейтрофилов из периферической крови и оценки их фагоцитарной активности.
Глава 3. Методы изучения функциональной активности клеток иммунной системы in vitro и in vivo
