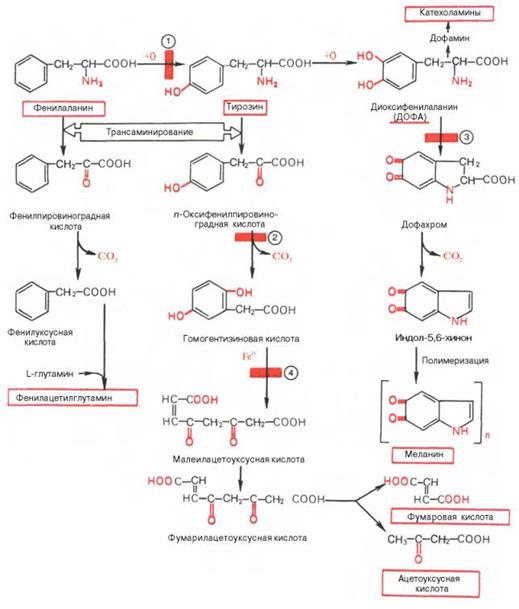
Специализированные пути метаболизма цикл. А,К- фенилаланина и тирозина.. Заболевания, связанные с нарушением обмена фенилаланина и тирозина
Фенилаланин относится к незаменимым аминокислотам, поскольку ткани животных не обладают способностью синтезировать его бензольное кольцо. В то же время тирозин полностью заменим при достаточном поступлении фенилаланина с пищей. Объясняется это тем, что основной путь превращения фенилаланина начинается с его окисления (точнее, гидрокси-лирования) в тирозин (рис. 12.6). Реакция гидроксилирования катализируется специфической фенилаланин-4-монооксигеназой, которая в качестве кофермента содержит, как все другие гидроксилазы, тетрагидро-биоптерин. Блокирование этой реакции, наблюдаемое при нарушении синтеза фенилаланин-4-монооксигеназы в печени, приводит к развитию тяжелой наследственной болезни – фенилкетонурии (фенилпировиноградная олигофрения). В процессе трансаминирования тирозин превращается в n-оксифенилпировиноградную кислоту, которая под действием специфической оксидазы подвергается окислению, декарбоксилированию, гидро-ксилированию и внутримолекулярному перемещению боковой цепи с образованием гомогентизиновой кислоты; эта реакция требует присутствия аскорбиновой кислоты, роль которой пока не выяснена. Дальнейшее превращении егомогентизиновой кислоты в малеилацетоуксусную кислоту катализируется оксидазой гомогентизиновой кислоты. Малеилацетоуксус-ная кислота под действием специфической изомеразы в присутствии глу-татиона превращается в фумарилацетоуксусную кислоту, подвергающуюся гидролизу с образованием фумаровой и ацетоуксусной кислот. Фенилаланин и тирозин являются также предшественниками меланинов. В этом важном биологическом процессе, обеспечивающем пигментацию кожи, глаз, волос, активное участие принимает фермент тирозиназа.
Фенилкетонурия (фенилпировиноградная олигофрения, болезнь Феллин-га) — одно из наиболее частых наследственных заболеваний, чаще обусловлено недостаточностью фенилаланин гидроксилазы (261600, 12q24.1); при отсутствии своевременного лечения приводит к тяжёлой умственной отсталости. Тип наследования аутосомно-рецессивный. Больные гомозиготны по гену фенилкетонурии, а их родители гетерозиготны.
Вследствие дефекта гена фенилаланин гидроксилазы (ФАГ-ген) развивается недостаточность фермента, и как следствие наступает блок в нормальном превращении фенилаланина в аминокислоту тирозин . Фенилаланин накапливается в организме и его концентрация в крови повышается в 10-100 раз. Далее он превращается в фенилпировиноградную кислоту, оказывающую токсическое влияние на нервную систему. Накопление фенилаланина в организме происходит постепенно, поэтому клиническая картина развивается медленно. В связи с этим очень важна ранняя диагностика фенилкетонурии
Алкаптонурия возникает вследствие мутации гена, кодирующего синтез оксидазы гомогентезиновой кислоты. Данная патология характеризуется аутосомно-рецессивным типом наследования. Алкаптонурией чаще болеют мужчины. Ген оксидазы гомогетинзиновой кислоты человека (HGD) локализован на длинном плече 3 хромосомы человека . В нормальных условиях гомогентезиновая кислота — промежуточный продукт распада тирозина и фенилаланина — переводится в малеилацетоуксусную кислоту, из которой в конечном счёте образуются фумаровая и ацетоуксусная кислоты, вступающие в другие биохимические циклы. Из-за дефекта фермента этот процесс тормозится, и остающаяся в избытке гомогентезиновая кислота превращается полифенолоксидазой в хиноновый полифенол (алкаптон или бензохинонацетат), который и выводится почками. Не полностью экскретируемый мочой алкаптон откладывается в хрящевой и другой соединительной ткани, обусловливая их потемнение и повышенную хрупкость. Чаще всего вперёд появляется пигментация склер и ушных хрящей.
. 
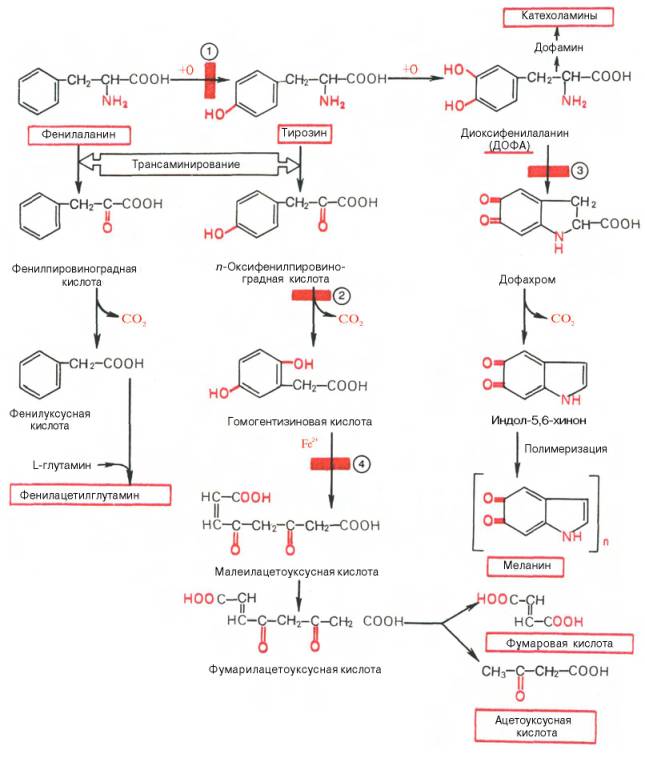
Биосинтез гема
Гем, железосодержащее тетрагидропиррольное красящее вещество, является составной частью О2-связывающих белков (см. с. 274) и различных коферментов оксидоредуктаз (см. сс. 108, 310). Почти на 85% биосинтез гема происходит в костном мозге и лишь небольшая часть — в печени. В синтезе гема участвуют митохондрии и цитоплазма.
А. Биосинтез гема
Синтез тетрагидропиррольных колец начинается в митохондриях. Из сукцинил-КоА (на схеме наверху), промежуточного продукта цитратного цикла, конденсацией с глицином получается продукт, декарбоксилирование которого приводит к 5-аминолевулинату (ALA). Отвечающая за эту стадию 5-аминолевулинат-синтаза (ALA-синтаза) [1] является ключевым ферментом всего пути. Экспрессия синтеза ALA-синтазы тормозится гемом, т. е. конечным продуктом, и имеющимся ферментом. Это типичный случай торможения конечным продуктом, или ингибирования по типу обратной связи.
После синтеза 5-аминолевулинат переходит из митохондрий в цитоплазму, где две молекулы конденсируются в порфобилиноген, который уже содержит пиррольное кольцо [2]. Порфобилиноген-синтаза [2] ингибируется ионами свинца. Поэтому при острых отравлениях свинцом в крови и моче обнаруживают повышенные концентрации 5-аминолевулината.
На последующих стадиях образуется характерная для порфирина тетрапиррольная структура. Связывание четырех молекул порфобилиногена с отщеплением NH2-групп и образованием уропорфириногена III катализируется гидроксиметилбилан-синтазой [3]. Для образования этого промежуточного продукта необходим второй фермент, уропорфириноген III-синтаза [4]. Отсутствие этого фермента приводит к образованию «неправильного» изомера — уропорфириногена I.
Тетрапиррольная структура уропорфиринoгена III все еще существенно отличается от гема. Так, отсутствует центральный атом железа, а кольцо содержит только 8 вместо 11 двойных связей. Кроме того, кольца несут только заряженные боковые цепи R (4 ацетатных и 4 пропионатных остатков). Так как группы гема в белках функционируют в неполярном окружении, необходимо, чтобы полярные боковые цепи превратились в менее полярные. Вначале четыре ацетатных остатка (R1) декарбоксилируются с образованием метильных групп (5). Образующийся копропорфириноген III снова возвращается в митохондрии. Дальнейшие стадии катализируются ферментами, которые локализованы на/или внутри митохондриальной мембраны. Прежде всего под действием оксидазы две пропионатные группы (R2) превращаются в винильные (6). Модификация боковых цепей заканчивается образованием протопорфириногена IX.
На следующей стадии за счет окисления в молекуле создается сопряженная π-электронная система, которая придает гему характерную красную окраску. При этом расходуется 6 восстановительных эквивалентов (7). В заключение с помощью специального фермента, феррохелатазы, в молекулу включается атом двухвалентного железа (8). Образованный таким образом гем или Fe-протопорфирин IX включается, например, в гемоглобин и миоглобин (см. с. 274), где он связан нековалентно, или в цитохром С, с которым связывается ковалентно (см. с. 108).
Дополнительная информация
Известен ряд заболеваний, вызванных наследственными или приобретенными нарушениями порфиринового синтеза, так называемые порфирии; некоторые из них протекают очень тяжело. Многие из этих заболеваний приводят к выделению предшественников гема с калом или мочой, которая вследствие этого может быть окрашена в темно-красный цвет. Также наблюдается отложение порфиринов в коже. При воздействии света это приводит к образованию трудноизлечимых волдырей. При порфириях часты также неврологические нарушения. Возможно, что в основе средневековых легенд о людях-вампирах (дракулах) лежит странное поведение больных порфириями (светобоязнь, необычные внешность и поведение, употребление крови в пищу, компенсирующее дефицит гема и зачастую улучшающее состояние при некоторых формах порфирий).
Деградаци 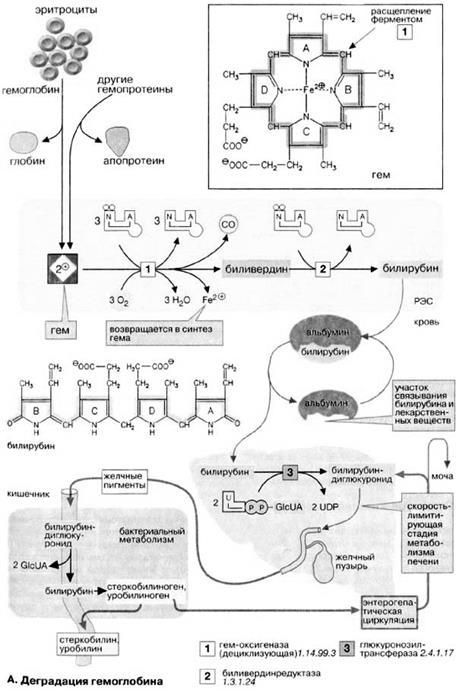 я порфиринов
я порфиринов
А. Деградация гемоглобина
В организме человека в течение 1 ч разрушается примерно 100-200 млн эритроцитов. Разрушение начинается в микросомальной фракции ретикуло-эндотелиальной системы [РЭС (RES)] клеток печени, селезенки и костного мозга. После отделения белковой части (глобина) красный гем расщепляется гем-оксигеназой с помощью кислорода и НАДФН на ионы Fe2+, СО (оксид углерода!) и зеленый биливердин. Далее железо утилизируется.
Затем биливердин восстанавливается биливердинредуктазой до оранжевого билирубина. Это изменение цвета легко можно наблюдать in vivo в виде синяков (гематомах). Интенсивный цвет гема и других порфиринов (см. рис. 195) является результатом сопряжения многочисленных двойных связей, которые образуют две резонансно стабилизированные (мезомерные) системы.
Для дальнейшего разрушения билирубин транспортируется кровью в печень. Так как он плохо растворим в плазме, транспорт осуществляется в комплексе с альбумином. В том же участке связывания альбумина сорбируются и лекарственные препараты. Паренхиматозные клетки печени забирают билирубин из крови.
После того как билирубин в печени дважды конъюгируется с активированной глюкуроновой кислотой (УДФ-GIcUA; см. рис. 113) (не показано), повышается его водорастворимость. Образование конъюгата катализируется УДФ-глюкуронозилтрансферазой — ферментом, находящимся в ЭР печени, а также в незначительных количествах в почках и слизистой кишечника. Глюкуроновая кислота присоединяется к пропионатным боковым цепям билирубина сложноэфирными связями. Образующийся диглюкуронид билирубина переносится в желчь путем активного транспорта против градиента концентрации. Этот транспорт является скорость-лимитирующей стадией метаболической трансформации билирубина в печени. Лекарственные препараты, такие, как, например фенобарбитал, могут индуцировать образование конъюгата и транспортный процесс.
В кишечнике конъюгат билирубина снова частично расщепляется бактериальной β-глюкуронидазой. Свободный билирубин постепенно восстанавливается до бесцветного уробилиногена и стеркобилиногена, которые далее окисляются кислородом воздуха до уробилина и стеркобилина. Эти конечные продукты метаболической трансформации желчных пигментов в кишечнике окрашены в цвета от оранжевого до желтого. Они выделяются по большей части с калом, а в меньшей степени резорбируются (энтерогепатическая циркуляция; см. рис. 307). При интенсивном процессе разрушения гема в моче внезапно появляется уробилиноген, где он при окислении кислородом воздуха темнеет, превращаясь в уробилин.
Наряду с гемоглобином, по аналогичному пути разрушаются группы гема и у других гемсодержащих белков (миоглобина, цитохрома, каталазы, пероксидазы). Однако их вклад в образование желчных пигментов (250 мг в сутки) составляет лишь примерно 10-15%.
Дополнительная информация
Гипербилирубинемия. Повышенный уровень билирубина ( >10 мг/л ) называется гипербилирубинемией. Билирубин диффундирует из крови в периферические ткани и окрашивает их в желтый цвет. Это особенно легко заметить на белой конъюктиве глаза, в таком случае говорят о желтухе. Ее причиной могут быть: повышенное образование билирубина из эритроцитов (гемолитическая желтуха из-за наследственного дефекта фермента или отравления организма), нарушение выделения билирубина и продуктов его расщепления вследствие повреждений печени (гепатоцеллюлярная желтуха из-за наследственного дефекта фермента или отравления организма) и застой желчи [обтурационная (механическая) желтуха из-за желчных камней]. Неконъюгированный билирубин может даже проходить гематоэнцефалический барьер и приводить к поражению мозга (ядерная желтуха). Для точного диагноза причин гипербилирубинемии важен анализ билирубина в плазме. Конъюгированный («прямой») билирубин от неконъюгированного («непрямого») можно отличить с помощью цветной реакции.
Билет 19
1.БИОСИНТЕЗ ТРИАЦИЛГЛИЦЕРОЛОВ И ФОСФОГЛИЦЕРИДОВ.Биосинтез триацилглицеролов и глицеролфосфатидов начинается с общих предшественников. В животных тканях биосинтез триацилглицеролов и главных фосфолипидов - фосфатидилэтаноламина и фосфатидилхолина начинается с двух общих предшественников и имеет несколько общих этапов. Общими предшественниками служат СоА-эфиры жирных кислот и глицерол-3-фосфат. Глицеролфосфат может образовываться двумя путями. В ходе гликолиза он возникает из дигидроксиацетонфосфата под действием цитоплазматического NAD-зависимого фермента глицеролфосфатдегидрогеназы:
Дигидроксиацетонфосфат + NADH + Н+ ↔ L-глицерол-З-фосфат + NAD + .
Кроме того, глицеролфосфат может образоваться из глицерола под действием глицеролкиназы:
АТР + Глицерол → Глицерол-3-фосфат + ADP.
Другими предшественниками триацил-глицеролов служат СоА-производные жирных кислот, образующиеся при помощи ацил-СоА—синтетаз.
Жирная кислота + АТР + СоА—SH — Ацил—S—СоА + AMP + РРi
На первом этапе биосинтеза триацил-глицеролов происходит ацилирование двух свободных гидроксильных групп глицеролфосфата двумя молекулами Со-А-производных жирных кислот с образованием диацилглицерол-3-фосфата: Ацил—S—СоА + Глицерол → Моноацилглицерол-3-фосфат + СоА—SH
Моноацилглицерол-3-фосфат + + Ацил—S—СоА → Диацилглицерол-3-фосфат + СоА—SH
 Диацилглицерол-3-фосфат (чаще его называют фосфатидной кислотой) встречается в клетках лишь в следовых количествах, однако он является важным промежуточным продуктом в биосинтезе липидов. В ходе синтеза триацилглицеролов фосфатидат гидролизуется фосфатидат-фосфатазой с образованием 1,2-диа-цилглицерола:
Диацилглицерол-3-фосфат (чаще его называют фосфатидной кислотой) встречается в клетках лишь в следовых количествах, однако он является важным промежуточным продуктом в биосинтезе липидов. В ходе синтеза триацилглицеролов фосфатидат гидролизуется фосфатидат-фосфатазой с образованием 1,2-диа-цилглицерола:
Фосфатидат + Н20 → 1,2-диацилглицерол + Рi.
Диацилглицерол, взаимодействуя с третьей молекулой СоА-производного жирной кислоты, превращается затем в триацилглицерол:
СоА-производное жирной кислоты +1,2-диацилглицерол → Триацилглиперол + СоА—SH.
Формирование каждой эфирной связи триацилглицеролов требует значительного количества свободной энергии. Для того чтобы возникла эфирная связь, жирная кислота сначала должна активироваться путем образования эфира с СоА; для этой реакции необходима энергия двух высокоэнергетических фосфатных связей, так как она протекает благодаря пирофосфатному расщеплению АТР и последующему гидролизу образовавшегося пирофосфата.
