Определение катаболизма. Катаболизм и анаболизм. Стадии катаболизма биомолекул в организме
Содержание
Оглавление
Содержание. 1
Билет №1. 5
1.Систематическая номенклатура ферментов. Классификация, шифры ферментов:характеристика отдельных классов. 5
2. Определение катаболизма. Катаболизм и анаболизм. Стадии катаболизма биомолекул в организме. 7
3.Катаболизм глюкозы. Анаеробный и аеробный обмен. Реакции анаеробного гликолиза. Эффект Пастера. Энергетический баланс анаэробного гликолиза. 9
Билет№2. 13
1.Ферменты. Специфичность ферментов. Активный центр фермента. 13
2.Экзергонические и эндергонические биохимические реакции. Роль АТФ и других макроэргических фосфатов в сопряжении экзергонических процессов и эндергонических процессов. 14
3.Пути внутриклеточного метаболизма глюкозы. Гликолиз и глюконеогенез. Обратимые и необратимые реакции. 16
Билет №3. 17
1.Регуляция активности ферментов. Проферменты. Изоферменты. Ингибиторы ферментов. 17
2.Реакции биологичемкого окисления.Типы реакций( дегидрогеназные, оксидазные, оксигеназные. Их биологическое значение. 20
3 Цитохромы Катализируют окисление веществ путем отдачи электронов Гемовое железо В одном из цитохромов имеется так же атом меди. 21
Билет№4. 24
1.Ферментативный катализ. 24
2.Митохондриальный транспорт. 25
3.Аэробное окисление пирувата (окислительное декарбоксилирование пировиноградной кты). 26
Билет№5. 28
1.Кинетика ферментативного катализа. Уравнение Михаэлиса-Ментен. Уравнение Лайнуивера-Берка. 28
Км показывает сродство фермента к субстрату; чем меньше ее значение, тем больше сродство. 29
2.Окислительное фосфорилирование. Пункты сопряжения окисления и фосфорилирования. АТФ-синтетаза митохондрий. 31
Работа АТФ-синтазы.. 32
3 субъединицы (γ,δ,ε) способствуют целостности АТФ-синтазы.. 33
Т-конформация — к АДФ присоединяется фосфат и образуется АТФ.. 33
3.Полное окисление глюкозы. Энергетический баланс. 33
Выход АТФ при аэробном распаде глюкозы до конечных продуктов. 34
Билет№6. 35
1.Аллостерические ферменты. Ингибиторы и активаторы аллостерических ферментов. Аллостерические центры. 35
2.В-окисление жирных кислот. 38
Деградация жирных кислот: β-окисление. 38
3.Пентозофосфатный путь окисления глюкозы. Реакции окислительной и неокислительной стадий пентозофосфатного цикла. Современная схема пентозофосфатного пути окисления углеводов, отзеркаливающая его связь с гликолизом. 41
Билет№7. 44
1.Опять ферменты.. 44
2. ИНГИБИТОРЫ И РАЗЪЕДИНИТЕЛИ ТРАНСПОРТА ЭЛЕКТРОНОВ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ 45
3.ГЛЮКОНЕОГЕНЕЗ. 45
Билет №8. 48
1. ВИТАМИНЫ.. 48
2. МИКРОСОМАЛЬНАЯ ЦЕПЬ ТРАНСПОРТА ЭЛЕКТРОНОВ. 49
3. ГЛЮКОЗОЛАКТОННЫЙ ЦИКЛ.. 51
1. ВИТАМИН В2. 52
2. ЦТК. 53
3.ГИПЕРГЛИКЕМИЯ. 55
Билет 10. 56
1. Витамин PP. 56
2. Гликоген. 57
3. Клеточная мембрана. 59
Билет 11. 60
1. Витамин В6(пиридоксин, пиридоксаль, пиридоксамин). 60
2. Гликоген синтезируется в период пищеварения. 61
3. Аминокислот — эт органически соединения. 63
Билет 12. 65
1.Биотин. 65
2. Нарушение обмена гликогена. 66
3. Существуют три источника аминокислот в клетке – поступление из крови, распад собственных внутриклеточных белков и синтез заменимых аминокислот. 66
Билет 13. 69
Фолиевая кислота. Биологическая роль. Пути поступления в организм. Коферментная функция. 69
2.Катаболизм триацилглицеролов. Реакции, механизм регуляции активности триглицеридлипазы. Нейрогуморальная регуляция липолиза (адреналин, глюкагон, инсулин). 71
3.Трансаминирование АМК. Аминотрансферазы. Отдельные аминотрансферазы. Реакции. Биохимическое значение трансаминирования АМК. 76
Билет 14. 80
1.Витамин В12. Биологическая роль. Пути попадания в организм. Коферментная функция. 80
2.Β-Окисление жирных кислот. Роль карнитина в транспорте жирных кислот в митохондрии. 82
3.Пути превращения аммиака в организме человека. Механизмы обезвреживания аммиака. 85
Билет №15. 89
1.Витамин С. 89
2.Окисление пальмитиновой кослоты. 90
3.Биосинтез мочевины. 92
Весь цикл мочевинообразования можно представить следующим образом:. 92
Билет №16. 93
1.Витамин А. 93
2.Окисление ненасыщенных жирных кислот. 94
3.Превращение безазотистого скелета ак. 95
Билет №17. 96
1.Витамин Д.. 96
2. Биосинтез высших жирных кислот. 97
3. Метаболизм АК с разветвленной цепью. 99
Билет №25. 100
Репликация ДНК. 100
Билет №18. 102
БИОСИНТЕЗ ХОЛЕСТЕРИНА.. 102
Сквален. 102
Формулы ланостерина и холестерина. 102
Желчные кислоты.. 103
Стероидные гормоны.. 104
2.Специализированные пути метаболизма цикл. А,К- фенилаланина и тирозина.. Заболевания, связанные с нарушением обмена фенилаланина и тирозина. 106
3.Биосинтез гема. 108
Билет 19. 112
1.БИОСИНТЕЗ ТРИАЦИЛГЛИЦЕРОЛОВ И ФОСФОГЛИЦЕРИДОВ. 112
2.Биосинтез пуриновых нуклеотидов. 113
3.Основные закономерности генетического кода. Адапторная гипотеза Ф. Крика и её развитие в wobble-гипотезе. 115
Билет №20. 116
1.Синтез белка на РНК. 116
2. Кинетика ферменативного катализа. График зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента. 117
Км показывает сродство фермента к субстрату; чем меньше ее значение, тем больше сродство. 118
3.Дезаминирование аминокислот. 120
Билет №21. 124
1.Факторы транскрипции Факторами транскрипции называют белки или белковые комплексы, непосредственно не участвующие в каталитическом акте образования РНК, но необходимые для прохождения основных этапов транскрипции и ее регуляции. По функциональному признаку принято различать три класса факторов транскрипции. 124
Транскрипционные факторы: Механизмы действия ТФ , связавающиеся с ДНК, могут влиять на транскрипцию генов через несколько механизмов: 124
2. Активность ферментов – способность в разной степени ускорять скорость реакции. Активность выражают 126
3 ОКИСЛИТЕЛЬНОЕ. 126
Билет№22. 129
1.Собственно трансляция происходит в рибосомах и включает три стадии: 129
2.ЦТК. 130
3.Глицеролфосфатного челночного механизма. 132
Билет 23. 133
1. Посттрансляционная модификация. 133
2. Полное окисление глюкозы. Энергетический баланс полного окисления глюкозы. 133
Выход АТФ при аэробном распаде глюкозы до конечных продуктов. 134
3. 135
Билет№24. 136
1.АНТИБИОТИЧЕСКИЕ ВЕЩЕСТВА, ПОДАВЛЯЮЩИЕ СИНТЕЗ БЕЛКА.. 136
24.2 Функционирование малат-аспартатного и глицерофосфатного шунта. 139
24.3. 141
Билет №25. 141
1.Репликация ДНК. 141
25 2 Синтез пальмитиновой кислоты Реакции. 143
3.Катаболизм аминокислот с разветвленной цепью.. 144
Билет №26. 146
1.Реплика́ция ДНК. 146
2. 147
3. Окисление капроновой кислоты.. 149
Билет №27. 150
27/1. 150
Репликация. 150
27/2. 152
27/3. 157
Билет 28. 158
28.1. 158
28.2. 160
28/3. 163
Билет29. 164
29.1Транскрипция. 164
29.2.Метаболизм аминокислот. 165
29.3.Триацилглицерины.. 167
Билет №30. 168
1.Особенности молекулярной организации и экспрессии генома эукариот (экзоны, интроны, сплайсинг) 168
2.Образование кетоновых тел и их утилизация. 171
3.Цикл трикарбоновых кислот. Реакции. 173
Билет №1
1.Систематическая номенклатура ферментов. Классификация, шифры ферментов:характеристика отдельных классов.
Современные классификация и номенклатура ферментов были разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в Москве.
Необходимость систематики номенклатуры диктовалась прежде всего стремительным ростом числа вновь открываемых ферментов, которым разные исследователи присваивали названия по своему усмотрению. Более того, одному и тому же ферменту часто давали два или несколько названий, что вносило путаницу в номенклатуру. Некоторые названия ферментов вообще не отражали тип катализируемой реакции, а при наименовании фермента исходили из названия субстрата, на который действует фермент, с добавлением окончания -аза: в частности, амилазы (ферменты, гидро-лизирующие углеводы), липазы (действующие на липиды), протеиназы (гидролизирующие белки) и т.д.
До 1961 г. не было и единой классификации ферментов. Трудности заключались в том, что разные исследователи за основу классификации ферментов брали различные принципы. Комиссией были рассмотрены 3 принципа, которые могли служить основой для классификации ферментов и их обозначения. Первый принцип – химическая природа фермента, т.е. принадлежность к флавопротеинам, пиридоксальфосфатпротеинам, гемо-протеинам, металлопротеинам и т. д. Однако этот принцип не мог служить общей основой для классификации, так как только для небольшого числа ферментов известны простетические группы, доступные идентификации и прямому определению. Второй принцип – химическая природа субстрата, на который действует фермент. По этому принципу трудно классифицировать фермент, так как в качестве субстрата могут служить разнообразные соединения внутри определенного класса веществ (белки, углеводы, липиды, нуклеиновые кислоты) и бесчисленное множество промежуточных продуктов обмена. В основу принятой классификации положен третий принцип – тип катализируемой реакции , который является специфичным для действия любого фермента. Этот принцип логично использовать в качестве основы для классификации и номенклатуры ферментов.
Таким образом, тип катализируемой химической реакции в сочетании с названием субстрата (субстратов) служит основой для систематического наименования ферментов. Согласно Международной классификации, ферменты делят на шесть главных классов, в каждом из которых несколько подклассов: 1) оксидоредуктазы; 2) трансферазы; 3) гидролазы; 4) лиазы; 5) изомеразы; 6) лигазы (синтетазы) (табл. 4.5).
Оксидоредуктазы. К классу оксидоредуктаз относят ферменты, катализирующие с участием двух субстратов окислительно-восстановительные реакции, лежащие в основе биологического окисления. Систематические названия их составляют по форме «донор: акцептор оксидоредуктаза». Например, лактат: НАД+ оксидоредуктаза для лактатдегидрогеназы (ЛДГ).
Различают следующие основные оксидоредуктазы: аэробные дегидро-геназы или оксидазы, катализирующие перенос протонов (электронов) непосредственно на кислород; анаэробные дегидрогеназы, ускоряющие перенос протонов (электронов) на промежуточный субстрат, но не на кислород; цитохромы, катализирующие перенос только электронов. К этому классу относят также гемсодержащие ферменты каталазу и пероксидазу, катализирующие реакции с участием перекиси водорода.
Трансферазы. К классу трансфераз относят ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов. Наименование их составляется по форме «донор: транспортируемая группа – трансфераза».
Различают трансферазы, катализирующие перенос одноуглеродных остатков, ацильных, гликозильных, альдегидных или кетонных, нуклеотидных остатков, азотистых групп, остатков фосфорной и серной кислот и др. Например: метил- и формилтрансферазы, ацетилтрансферазы, амино-трансферазы, фосфотрансферазы и др.
Гидролазы. В класс гидролаз входит большая группа ферментов, катализирующих расщепление внутримолекулярных связей органических веществ при участии молекулы воды. Наименование их составляют по форме «субстрат-гидролаза». К ним относятся: зстеразы – ферменты, катализирующие реакции гидролиза и синтеза сложных эфиров; гликозидазы, ускоряющие разрыв гликозидных связей; фосфатазы и пептидгидролазы, катализирующие гидролиз фосфоангидридных и пептидных связей; ами-дазы, ускоряющие разрыв амидных связей, отличных от пептидных, и др.
Лиазы. К классу лиаз относят ферменты, катализирующие разрыв связей С—О, С—С, С—N и других, а также обратимые реакции отщепления различных групп от субстратов не гидролитическим путем. Эти реакции сопровождаются образованием двойной связи или присоединением групп к месту разрыва двойной связи. Ферменты обозначают термином «субстрат-лиазы». Например, фумарат-гидратаза (систематическое название «L-малат-гидролаза») катализирует обратимое отщепление молекулы воды от яблочной кислоты с образованием фумаровой кислоты. В эту же группу входят декарбоксилазы (карбокси-лиазы), амидин-лиазы и др.
Изомеразы. К классу изомераз относят ферменты, катализирующие взаимопревращения оптических и геометрических изомеров. Систематическое название их составляют с учетом типа реакции: «субстрат – цис-транс-изомераза». Если изомеризация включает внутримолекулярный перенос группы, фермент получает название «мутаза».
К этому же классу относят рацемазы и эпимеразы, действующие на амино- и оксикислоты, углеводы и их производные; внутримолекулярные оксидоредуктазы, катализирующие взаимопревращения альдоз и кетоз; внутримолекулярные трансферазы, переносящие ацильные, фосфорильные и другие группы, и т.д.
Лигазы (синтетазы). К классу лигаз относят ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии распада АТФ (или другого нуклеозидтрифосфата). Систематическое название их составляют по форме «X : Y лигаза», где X и Y обозначают исходные вещества. В качестве примера можно назвать L-глутамат: аммиак лигазу (рекомендуемое сокращенное название «глутаминсинтета-за»), при участии которой из глутаминовой кислоты и аммиака в присутствии АТФ синтезируется глутамин.
В пределах классов ферменты группируются в подклассы и подподклассы в соответствии с особенностями катализируемых реакций; на этой основе (с учетом названия субстратов) базируется кодовая нумерация (шифры) ферментов и их систематические названия. Шифр фермента состоит из четырех разделенных точками чисел; первое число показывает, к какому из шести классов относится фермент; второе и третье числа показывают подкласс и подподкласс, соответственно, а четвертое число - порядковый номер фермента в его подподклассе. На- пример, кислая фосфатаза имеет шифр 3.1.3.2; это означает, что она относится к классу гидролаз (3.1.3.2), подклассу этих ферментов, действующих на сложноэфирные связи (3.1.3.2), к подподклассу ферментов, гидролизующих моноэфиры фосфорной кислоты (3.1.3.2), и что порядковый номер фермента в этом подподклассе "2" (3.1.3.2). Наряду с шифром фермент имеет систематическое название, которое составля- ется в соответствии с определенными (для каждого из классов) прави- лами, оно по возможности точно определяет действие фермента и тем самым идентифицирует его. Так, например, систематическое название кислой фосфатазы: "фосфогидролаза моноэфиров ортофосфорной кислоты (кислый оптимум)". Рекомендуется, однако, пользоваться, в основном, рабочими (тривиальными) названиями, в рассматриваемом случае это "кислая фосфатаза".
Определение катаболизма. Катаболизм и анаболизм. Стадии катаболизма биомолекул в организме.
Катаболи́зм или энергетический обмен — процесс метаболического распада, разложения на более простые вещества (дифференциация) или окисления какого-либо вещества, обычно протекающий с высвобождением энергии в виде тепла и в виде АТФ.
Анаболи́зм или пластический обмен — совокупность химических процессов, составляющих одну из сторон обмена веществ в организме, направленных на образование составных частей клеток и тканей.
В метаболизме можно выделить: пути анаболизма, которые предназначены для биосинтезов, и пути катаболизма, которые ведут к расщеплению сложных молекул. Хотя катаболические и анаболические пути во многом различаются, они тесно связаны друг с другом. Связь между ними обеспечивает оптимальный уровень метаболизма. Катаболизм и анаболизм - это сопряженные взаимодополняющие процессы.
Катаболизм сопровождается освобождением энергии, которая может аккумулироваться в виде АТФ. При анаболических процессах происходит потребление энергии, которая освобождается при распаде АТФ до АДФ и фосфорной кислоты или АМФ и пирофосфорной кислоты. Следовательно, АТФ является сопрягающим энергетическим звеном катаболизма и анаболизма. Кроме АТФ связующим звеном могут служить специфические метаболические пути или циклы. Связующий путь (цикл), объединяющий пути распада и синтеза веществ, называется амфиболическим. Примером амфиболического цикла может служить цикл Кребса. Амфиболические пути связаны, как правило, с окислением веществ до углекислого газа и воды.
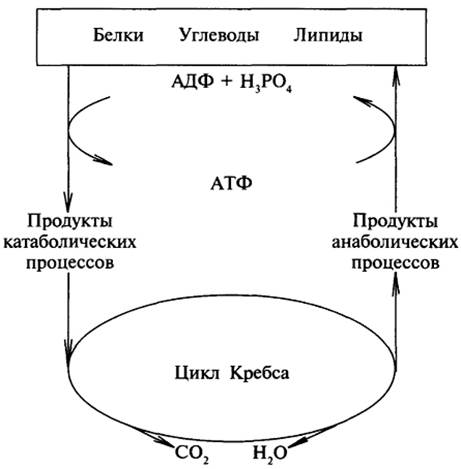
Стадии катаболизма биомолекул. При расщеплении биомолекул в организме выделяют 3 стадии, которые являются общими для катаболизма различных биомолекул.
В первойстадии все сложные биомолекулы (полимеры) расщепляются до простых компо нентов (мономеров): 1) полисахариды расщепляются до моносахаридов; 2) липиды (триа цилглицеролы) – до жирных кислот и глицерина; 3) белки – до аминокислот; 4) нуклеиновые кислоты – до мононуклеотидов. Реакции этой стадии катализируются гидролазами желудка, и кишечника. На этой стадии высвобождается около 1% химической энергии, которая рассеива ется в виде тепла.
Во второй стадии мономеры, образовавшиеся в первой стадии, внутриклеточно подвергают ся превращениям с выделением энергии (2030%). Основные реакции катаболизма:
1) для моносахаридов – гликолиз, конечным метаболитом которого является пировиноград ная кислота, которая далее подвергается окислительному декарбоксилированию и превраща ется в активную форму уксусной кислоты – ацетилКоА;
2) для жирных кислот – βокисление, конечным продуктом которого является ацетилКоА;для глицерина – расщепление до пирувата, который далее превращается в ацетилКоА;
3) для аминокислот и нуклеотидов – дезаминирование и расщепление безазотистых молекул до ди и трехуглеродных карбоновых кислот и их производных. Большинство этих метаболи тов превращается в ацетилКоА.
Таким образом, общим конечным продуктом второй стадии внутриклеточного катабо лизма углеводов, липидов и аминокислот является ацетилКоА.
В третьейстадии катаболизма в митохондриях происходит окисление ацетилКоА до СО2 и Н2О и окислительное фосфорилирование с образованием АТФ. Окисление ацетилКоА до СО2 происходит в цикле трикарбоновых кислот, при участии коферментов НАД и ФАД и ци тохромов Атомы водорода поступают в дыхательную цепь (электроннотранспортная цепь митохондрий) и переносятся на кислород, образуя Н2О. Полученная энергия (на этой стадии образуется 7080% енергии) используется для осуществления окислительного фосфорилиро вания, главного источника АТФ в организме.
3.Катаболизм глюкозы. Анаеробный и аеробный обмен. Реакции анаеробного гликолиза. Эффект Пастера. Энергетический баланс анаэробного гликолиза.
Гликолиз - это серия реакций, в результате которых глюкоза распадается на две молекулы пирувата (аэробный гликолиз) или две молекулы лактата (анаэробный гликолиз). Все десять реакций гликолиза протекают в цитозоле и характерны для всех органов и тканей. Аэробный распад глюкозы включает реакции аэробного гликолиза и последующее окисление пирувата в реакциях катаболизма.
Таким образом, аэробный распад глюкозы - это предельное ее окисление до СО2 и Н2О, а анаэробный гликолиз - это специфический путь катаболизма, т. е. часть аэробного распада глюкозы. Анаэробный распад включает те же реакции специфического пути распада глюкозы до пирувата, но с последующим превращением пирувата в лактат (т. е. термины анаэробный распад и анаэробный гликолиз совпадают).
В гликолизе можно выделить три основных этапа. На первом этапе превращениям подвергаются гексозы, на втором - триозы, на третьем - карбоновые кислоты.
Характеристика гликолиза:
большинство реакций обратимо, за исключением трех (реакций 1, 3, 10);все метаболиты находятся в фосфорилированной форме;источником фосфатной группы в реакциях фосфорилирования являются АТФ (реакции 1, 3) или неорганический фосфат (реакция 6);регенерация NAD+, являющаяся необходимым условием протекания гликолиза, происходит при аэробном гликолизе посредством дыхательной цепи. В этом случае водород транспортируется в митохондрии с помощью челночного механизма при участии переносчиков. Это происходит потому, что мембрана митоходрий непроницаема для протонов. При анаэробном гликолизе регенерации NAD+ осуществляется независимо от дыхательной цепи. В этом случае акцептором водорода от NADH является пируват, который восстанавливается в лактат;
образование АТФ при гликолизе может идти двумя путями: либо субстратным фосфорилированием, когда для фосфорилирования AДФ используется энергия макроэргической связи субстрата (реакции 7, 9), либо путем окислительного фосфорилирования AДФ, сопряженного с дыхательной цепью (реакция 6).
Анаэробный распад глюкозы (анаэробный гликолиз)
Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса:
С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O.
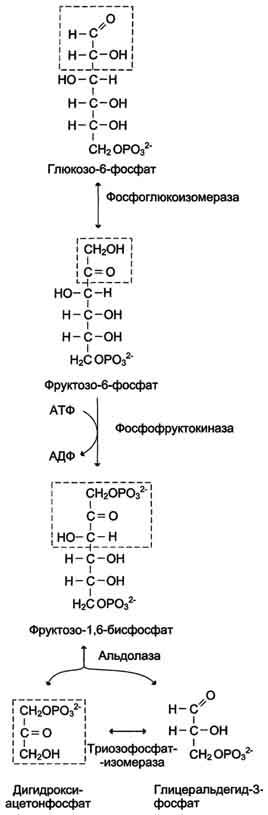
. Реакции анаэробного гликолиза
При анаэробном гликолизе (рис. 7-40) в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу. Лишь 11-я реакция, где происходит восстановление пирувата цитозольным NADH, является специфической для анаэробного гликолиза (рис. 7-41). Восстановление пирувата в лактат катализирует лактатдегидро-геназа (реакция обратимая, и фермент назван по обратной реакции). С помощью этой реакции обеспечивается регенерация NAD+ из NADH без участия митохондриальной дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от NADH (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию NAD+. К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма. Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО2 и Н2О. Баланс АТФ при анаэробном гликолизе
Анаэробный гликолиз по сравнению с аэробным менее эффективен. В этом процессе катаболизм 1 моль глюкозы без участия митохондриальной дыхательной цепи сопровождается синтезом 2 моль АТФ и 2 моль лактата. АТФ образуется за счёт 2 реакций субстратного фосфорилирования. Поскольку глюкоза распадается на 2 фосфотриозы, то с учётом стехиометри-ческого коэффициента, равного 2, количество моль синтезированного АТФ равно 4. Учитывая 2 моль АТФ, использованных на первом этапе гликолиза, получаем конечный энергетический эффект процесса, равный 2 моль АТФ. Таким образом, 10 цитозольньгх ферментов, катализирующих превращение глюкозы в пируват, вместе с лактатдегидрогеназой обеспечивают в анаэробном гликолизе синтез 2 моль АТФ (на 1 моль глюкозы) без участия кислорода.
Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжении их кислородом, в том числе в клетках опухолей. Для метаболизма клеток опухолей характерно ускорение как аэробного, так и анаэробного гликолиза. Но преимущественный анаэробный гликолиз и увеличение синтеза лактата служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов.
Снижение скорости потребления глюкозы и прекращение накопления лак-тата в присутствии кислорода носит название эффекта Пастера. Впервые это явление наблюдал Л. Пастер во время своих широко известных исследований роли брожения в производстве вина. В дальнейшем было показано, что эффект Пастера наблюдается также в животных и растительных тканях, где кислород тормозит анаэробный гликолиз. Значение эффекта Пастера, т.е. перехода в присутствии кислорода от анаэробного гликолиза или брожения к дыханию, состоит в переключении клетки на наиболее эффективный и экономичный путь получения энергии. В результате скорость потребления субстрата, например глюкозы, в присутствии кислорода снижается. Молекулярный механизм эффекта Пастера заключается, по-видимому, в конкуренции между системами дыхания и гликолиза (брожения) за АДФ, используемый для образования АТФ. Как известно, в аэробных условиях значительно эффективнее, чем в анаэробных, происходят удаление Piи АДФ, генерация АТФ, а также регенерирование НАД+, окисленного из восстановленного НАДН. Иными словами, уменьшение в присутствии кислорода количества Рi и АДФ и соответствующее увеличение количества АТФ ведут к подавлению анаэробного гликолиза.
Реакции анаэробного гликолиза
Билет№2.
