Характеристика амінокислот і 4 страница
Третинна структура білків
Наявність у молекулах білків первинної структури, а також певного співвідношення між впорядкованими і певпорядкованими ділянками пол і пептидного ланцюга, характерного для їх вторинної структури, ще не дає повної уяви про об'єм, форму та загальну просторову орієнтацію всієї молекули білка.
^Дослідженнями було встановлено, що крім первинної і вторинної структур для білкових молекул характерна тривимірна організація, яку назвали третинною структурою. Основний внесок у з'ясування третинної структури зробили представники англійської школи кристалографів Дж. Кенлрю, Д\. Перутц, Дж. Бернал.
При опроміненні монокристалів білків (ізоморфних похідних, добутих при введенні в їхню молекулу атомів важких металів) короткохвильовим рентгенівським випромінюванням за інтенсивністю розсіювання світла визначили просторове розміщення більшості атомів у молекулах білків. Завдяки високій точності та відтворюваності даний метод назвали молекулярною мікроскопією. На основі цих досліджень було введено поняття про третинну структуру білків як загальну орієнтацію в просторі одного чи кількох полінептидних ланцюгів білка з власною вторинною структурою, тобто третинна структура білків — це їх тривимірна орієнтація або конфігурація в просторі.
Третинна структура білків є досить важливою їх характеристикою. Вона специфічна для кожного окремого білка і визначає його фізико-хімічні властивості (каталітичні, гормональні, антигенні). Враховуючи це, третинна структура білків дістала назву н а т и в и о ї ко и ф о р-м а ц і ї. Нативна конформація білків суворо індивідуальна і генетично детермінована, тобто третинна структура білків визначається їх первинною структурою (якісним складом, кількісним вмістом та порядком розміщення залишків амінокислот у поліпептидному ланцюгу). При цьому первинна структура білків несе два види інформації і не лише визначає певну тривимірну орієнтацію поліпептидного ланцюга, а й спосіб її досягнення. Це так звана конформаційна інформація, яка забезпечує формування білкових молекул суворо визначеної, генетично детермінованої форми з певною їх просторовою орієнтацією. В свою чергу тривимірна структура білкової молекули несе функціональну інформацію, оскільки біологічна активність білків визначається їхньою третинною структурою. В утворенні третинної структури білків важлива роль належить взаємодії радикалів залишків амінокислот, що входять до складу білкових молекул, з навколишнім водним середовищем.
Вважають, нір т4тртиння структура, як правило, виникає автоматично і рушійною силою, що спонукає до її утворення, є гідрофобна взаємодія. При цьому гідрофобні (неполярні) радикали амінокислот, намагаючись уникнути контакту з полярними групами води, оріенту-
ються всер?дииу молекули, утворюючи так звані «сухі зони», тоді як гідрофільні радикали знаходяться на поверхні молекули. Отже, виникає термодинамічно найвигідніша конформація молекули, яка є досить стабільною, оскільки має мінімальний запас енергії.
Невелика кількість гідрофобних радикалів може залишатися на поверхні білкових молекул, де вони утворюють «гідрофобні кластери», що забезпечують мозаїчність поверхні глобул та відіграють певну роль у стабілізації четвертинної структури.
Гідрофобна взаємодія відіграє важливу роль у самоорганізації нативної структури білків. Вважають, що процес самоорганізації по-ліпептпдних ланцюгів па унікальну специфічну для кожного індивідуального білка просторову структуру проходить у кілька етапів, які включають локальну взаємодію між різними ділянками поліпептид-ного ланцюга за рахунок сил електростатичної взаємодії. При цьому утворюються флуктуючі а-спіралі. Наступне зближення окремих гідрофобних ділянок спіралей спонукає до утворення гідрофобних ядер, які у результаті взаємодії з навколишнім водним середовищем забезпечують формування нативної конформації (рис. 21). В деяких білках (лізоцим, рибонуклеаза) формується два чи більше гідрофобних ядра, внаслідок чого утворюється багатоядерна структура.
У процесі самоорганізації нативної структури просторова орієнтація одного чи кількох поліпептидних ланцюгів відбувається під час зближення радикалів амінокислот, які забезпечують її стабілізацію. Оскільки третинна структура білків є досить важливою характеристикою і при її порушенні білок втрачає біологічні властивості, в стабілізації третинної структури основна роль належить ковалентним дисуль-фідним зв'язкам. Вони виникають при наближенні двох сульфгідрильних груп залишків цистеїну внаслідок відщеплення атомів водню і «замикання» дисульфідних містків. Дисульфідні зв'язки забезпечують надійну стабілізацію третинної структури. Руйнування їх призводить до втрати білками біологічних властивостей і зменшення стабільності молекули білка.
Треба зазначити, що крім дисульфідних зв'язків у стабілізації третинної структури білків важлива роль належить нековалентним зв'язкам або силам слабкої взаємодії. Серед них важливе значення мають водневі зв'язки між радикалами амінокислот (водневі, іонні та гідрофобні зв'язки) (рис. 22). Про роль цих зв'язків у стабілізації третинної структури свідчить те, що є білки (міоглобін, гемоглобін, вірус тютюнової мозаїки), які в своєму складі не містять залишків цистеїну, однак молекули їх мають стабільну/нативну конформацію. В цьому випадку стабілізація нативної конфіормації забезпечується за рахунок сил слабкої взаємодії. Отже, має місце кооперативний ефект, суть якого полягає в тому, що під час взаємодії енергія, яка значно менша за енергію ковалентних зв'язків, сприяє надійній стабілізації структури білкових молекул та формуванню їх нативної конформації.
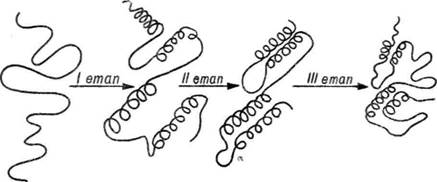
Рис. 21. Етапи формування нативної конформації
Оскільки нативна конформація білкових молекул генетично детермінована і визначається порядком чергування залишків амінокислот у поліпептидному ланцюгу, вважають, що конформація кожно'1' молекули білка зазнає певних змін у процесі еволюції. Тому для індивідуальних білків характерним є невеликий набір близьких конформацій з мінімальним запасом енергії, які можуть легко взаємоперетворюватись. На цьому грунтується принцип взаємоперетворення конформацій --один з важливих принципів сучасної біологічної науки. При формуванні нативної конформації молекула білка утворює в просторі компактні структури, об'єм та форма яких різноманітні — від сферичної та еліпсоподібної до овальної і витягнутої. У більшості випадків утворюються компактні асиметрично побудовані структури (див. Форма білкових молекул).
Ніри з'ясуванні третинної структури білків переважно використовували сучасні методи дослідження, такі як рентгено-стр_\к-турний аналіз, інфрачервона спектроскопія, ядерно-магнітний резонанс тощо.
Уперше третинну структуру м'язевого білка міоглобіну з'ясував Дж. Кендрю в 1960 р. Д\іоглобін —білок з відносно невеликою молекулярною масою 17 500 — належить до групи складних білків хромопротеїдів, які у вигляді простетичної групи містять похідне протопор-фірину ІХ-гем, що є комплексом порфірину з іонами Fe2b. Білкова частина молекули—глобін—містить 153 залишки амінокислот. Близько 70 °о пол і пептидного міоглобіну спіралізовано. Невпорядко-вані ділянки молекули містять велику кількість залишків проліну. Молекула міоглобіну має компактну форму, близьку до сферичної (4,5 х 3,5 X 2,5 нм) (рис. 23).
Поліпептидний ланцюг міоглобіну укладається в просторі навколо гему так, що полярні групи залишків пропіонової кислоти гему орієн-
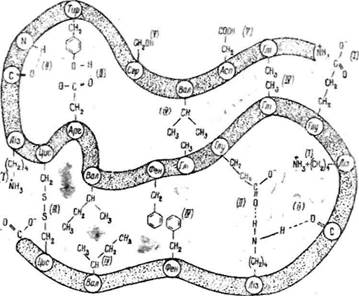
Рис. 22. Зв'язки, що стабілізують третинну структуру білків
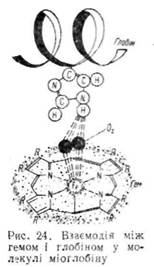
туються на поверхню молекули, а решта гему занурена в глобулу. Контакт між білковою частиною і простетичиою групою забезпечується за рахунок координаційних зв'язків між іонами Fe2+ і залишками гістидину, локалізованого в спіралі F (проксимальний гістидин). На другій ділянці молекули, з протилежного боку від атома заліза, знаходиться ще один залишок гістидину (дистальний гістидин). Ділянка між залізом (Fe2-r) та дистальним гістидином вільна і ліпофільна молекула кисню може зайняти шосте координаційне положення (рис. 24). На цьому грунтується унікальна властивість міоглобіну—здатність зв'язувати кисень без зміни ступеня окислення заліза гему.
Біологічна функція міоглобіну в організмі — це створення рухомого резерву кисню в м'язах. Чим інтенсивніше працюють м'язи, тим більше міститься в них міоглобіну. Оскільки спорідненість міоглобіну з киснем досить висока, то в м'язах може створюватись значний резерв кисню. Це має важливе значення для тварин, що живуть у воді. Так, якщо у людини міоглобін може зв'язувати до 10 % кисню, то у водних тварин до 47 %. Міоглобін, виділений з м'язів різних тварин, має подібний склад, однак відрізняється амінокислотним складом полшептидних ланцюгів, тобто для нього характерна видова специфічність.
У 1968 p. M, Перутц встановив третинну структуру іншого більш складного білка — гемоглобіну, молекула якого побудована з чотирьох
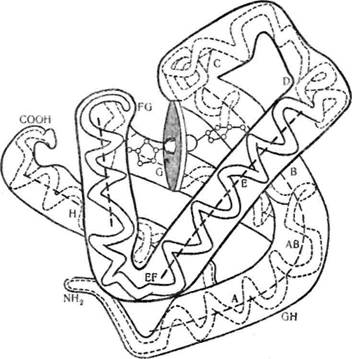
Рис. 23. Третинна структура міоглобіну
поліпептидних ланцюгів (субодиииць), причому кожний ланцюг має свою власну третинну структуру. Кожна з субодиниць за будовою нагадує міоглобін, складається з небілкової частини гему і білкової частини — глобіну. Функція даного білка подібна до функції міоглобіну, гемоглобін забезпечує дихальну функцію крові—постачання тканин і органів киснем.
Застосування нових методів дослідження дало змогу прискорити розшифрування тривимірної структури значної кількості високомоле-кулярних білків, дістати вичерпну інформацію про упаковку білкової молекули та її динамічні характеристики. Так, у кінці GO-x років з'ясували третинну структуру білків —ферментів лізоциму, альдолази, трипсину, хімотрипсину, лактатдегідрогенази та ін. При цьому було встановлено, що під час утворення третинної структури відбувається формування певних ділянок молекул ферментів, в яких локалізовані їхні активні центри, відповідальні за перетворення субстратів. Нині певних успіхів досягнуто у розшифруванні третинної структури великої кількості-мембранних білків, які мають ферментативні властивості.
 |
Це такі, як цитохром-с-редуктаза, АТФ-аз7, Н+-залежна АТФ-аза, які забезпечують внутрішньоклітинний метаболізм різних субстратів, енергетичний обмін та процеси гомеостазу. Встановлення їхньої тривимірної структури дало змогу підтвердити залежність між будовою білків та їх біологічними функціями.
Четвертинна структура білків
Детально вивчати четвертинну структуру білків почали в другій половині XX ст. А. Перутц і Дж. Бернал, застосовуючи такі фізико-хімічні методи дослідження, як електронна мікроскопія, рентгеноструктурний аналіз, ядерний магнітний резонанс, масс-спектроскопія тощо. Було встановлено, що молекули багатьох білків складаються не з одного, а з кількох поліпептидних ланцюгів, переважно з парної їх кількості 2, 4, 6 і т. д. Такі поліпептидні ланцюги Дж. Бернал назвав суб-одиницями, за аналогією з субодиницями, які виявив у складі білків Т. Сведберг у 1926 р. при застосуванні седиментаційних методів аналізу.
У 1965 р. Ж. Моно замість субодиниці запропонував назву протомер, а білки, побудовані з протомерів, дістали назву олігомерних. Отже, під четвертинною структурою білків слід розуміти взаємне просторове розміщення протомерів в олігомерній молекулі.
Протомери, що становлять четвертинну структуру білка, за амінокислотним складом можуть бути однакові або різні. Якщо протомери мають однаковий амінокислотний склад, то такі білки називають гомогенними, а якщо протомери не ідентичні, то білки називають гетерогенними.
Нині частина молекули олігомерного білка, яка має певну функціональну активність, називається субодиницею. fСубодиниця, в свою чергу, може бути представлена одним чи кількома протоме-рами.
До білків з четвертинною структурою належать також складні надмолекулярні комплекси, що складаються з сотень тисяч субоди-ниць. Такі білки називають мультимерами.
Об'єднання протомерів у будь-якій кількості, яке не веде до появи нових біологічних властивостей, називається агрегованим станом.
На основі детального вивчення особливостей структурної організації олігомерних білків та надмолекулярних комплексів було встанов-
4 5-287
лено деякі закономірності, характерні для четвертинної структури білків:
четвертинна структура характерна для білків, молекулярна маса яких понад 50 тис;
білки, що мають четвертинну структуру, складаються переважно з парної кількості субодиниць;
від наявності четвертинної структури значною мірою залежать біологічні властивості білків та їхні функції;
четвертинна структура білків стабілізується за рахунок сил слабкої
взаємодії — водневих, іонних, гідрофобних зв'язків, які виникають між
субодиницями, що контактують; л
і в забезпеченні контактів між субодиницями важлива роль належить полярним групам радикалів амінокислот, між якими виникають різні види зв'язків.
Кооперативний ефект між силами слабкої взаємодії забезпечує підтримання олігомерних білків у вигляді стійких організованих комплексів з характерними для них біологічними властивостями. Важливим є те, що субодиниці олігомерних білків або їхні окремі ділянки, як правило, мають на поверхні гідрофобні («липкі») плями. Це сприяє зближуванню субодиниць до мінімальних відстаней, що забезпечує їх досить тісний контакт («злипання»). Комплементарна електрозарядже-ність окремих точок посилює взаємні контакти між субодиницями та закріплення утвореної структури.
Контакти між субодиницями в олігомерних білках можуть забезпечуватись за рахунок різних видів взаємодії, що залежить від їх будови, форми та інших факторів. Найчастіше виникає два види взаємодій — ізологічна та гетерологічна. Ізологічна взаємодія виникає
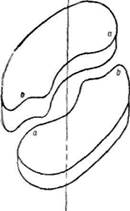 |
тоді, коли вся поверхня субодиниць, що контактують, комплементарна одна одній. При цьому кожна точка однієї субодиниці може бути суміщена з кожною точкою іншої субодиниці при повороті навколо осі симетрії (360°/2 — 180е). Даний вид взаємодії характерний для білків, у яких дві ідентичні субодиниці утворюють зв'язки типу a, b (рис. 25). При взаємодії двох ізологічних димерів між ними може виникати додаткова ізологічна взаємодія, внаслідок чого утворюються тетра-мерні структури з діедричною симетрією. Прикладом може бути фермент лактатдегідрогеназа.
Гетерологічна взаємодія між ділянками субодиниць, що контактують, виникає тоді, коли кожна субодиниця одного типу має вза-модіяміж субодиницями ємно комплементарні окремі ділянки а і b
$8
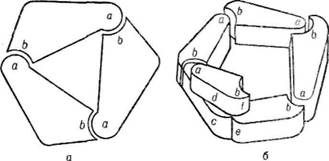 |
Рис. 26. Гетерологічиа взаємодія між субодиницями:
а — кільце; б — спіраль
(рис. 26). При контакті таких субодиниць у кожної з них залишається вільною одна з комплементарних ділянок, за рахунок якої можуть утворюватись кільцеві або спіральні структури. Кільцеві структури мають циклічну симетрію і під час повороту навколо осі симетрії на певний кут кожна субодиниця може суміщатись з іншою. Якщо кути, що виникають під час повороту субодиниць навколо осі симетрії, не приводять до замикання циклу, то утворюється спіральна структура (актинові волокна, віріони вірусів). У багатьох ви-сокомолекулярних білках, як правило, зустрічаються контакти двох типів: ізологічні і гетерологічні, оскільки четвертинна структура таких білків утворюється за рахунок протомерів двох або кількох типів, наприклад білок гемоглобіп-тетрамер, побудований з двох подібних, але не ідентичних субодиниць а і р" (а2, р2). Для структури, що утворюється при цьому, характерним є симетричні розміщення неідентичних субодиниць, внаслідок чого виникають оліго-мери різної форми з кубічною симетрією (типу тетраедра, куба тощо). Кубічна симетрія характерна для капсид віріонів, вірусів SV-40, бактеріофага ерX-174, аденовірусів.
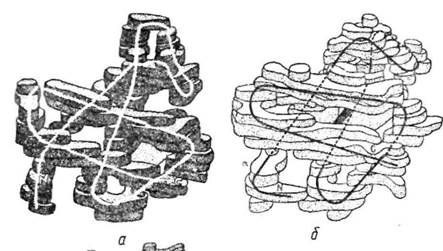
'Нині розшифровано четвертинну структуру значної кількості білків, які біологічно активні і мають важливі функції. Прикладом білка, що має четвертинну структуру, є гемоглобін. Дослідженням структури цього білка М. Перутц займався протягом 20 років, починаючи з 1937 р. Гемоглобін — гетерогенний тетрамер, молекула якого складається з чотирьох субодиниць: двох а і двох р. се-Субодиниці містять 141, ар — 146 залишків амінокислот. Молекулярна маса білка 68 000. Гемоглобін належить до групи складних білків — хромопротеїдів, простатичною групою яких є похідне протопорфірину ІХ-гем (рис. 27).
Кожен протомер гемоглобіну містить білкову частину (глобін) і простетичну групу — гем. Гемоглобін міститься в еритроцитах і виконує дихальну функцію — переносить кисень від альвеол легенів до
4*
 |
 |
| Рис. 27. .Модель молекули а-ланцюга (а), Р-ланцюга (б) і всієї молекули гемоглобіну (в) |
тканин і С02 в протилежному
напрямі. Під час приєднання
і віддачі кисню відбувається
зміна конформації гемогло
біну — приєднання супрово
джується стискуванням моле
кули внаслідок зближення
протомерів, а віддача кисню
викликає протилежний ефект,
тому гемоглобін часто нази
вають «молекулярними леге
нями».' При зв'язуванні кис
ню молекулами гемоглобіну
за участю заліза гемінового
угруповання виявляється по
зитивний кооперативний
ефект, суть якого полягає
в тому, що початкове зв'язу
вання ліганду з одним центром полегшує зв'язування наступного з ін
шим центром, тобто зв'язування однієї молекули кисню з одним гемом
полегшує зв'язування наступної молекули кисню з другим гемом і т.д.
Такий кооперативний ефект між певними ділянками молекули гемогло
біну можна пояснити на основі поняття алостеризму (білок може набу
вати різні тривимірні конформації, які мають різну біологічну актив
ність).
Стабілізація молекули гемоглобіну забезпечується за рахунок сил слабкої взаємодії, які виникають між певними ділянками субодиниць,
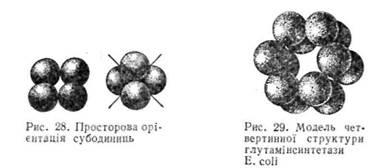
що контактують, внаслідок чого утворюється структура, близька до сферичної (рис. 28).
Четвертинну структуру мають більшість білків-ферментів, Так, фермент глутамінсинтетаза, який відіграє важливу роль у процесі зв'язування аміаку, складається з 12 ідентичних субодиниць з молекулярною масою 50 тис. кожна. Субодиниці вкладаються в просторі так, що утворюють два гексагональні кільця (рис. 29). Методом рентгено-структурного аналізу досліджено також четвертинну структуру досить важливого ферменту ДНК-залежної-РНК-полімерази Е. сої і, який забезпечує процес транскрипції (синтез інформаційної РНК на структурі ДНК). Фермент складається з п'яти субодиниць — двох ідентичних а з молекулярною масою 36 500, р„ р', і D з молекулярною масою відповідно 150 000, 155 000 і 70 000.
Досить складною є четвертинна структура аспартаттранскарбамі-лази — ферменту, що каталізує реакцію під час синтезу нуклеозид-монофосфатів піримідинового ряду. Складається фермент з 12 субодиниць — шість з яких виконують каталітичну (С-субодиниці), а другі шість — регуляторну функцію (/^-субодиниці). С-Субодиниці об'єднані в тримери, розміщені один над одним, а /^-субодиниці знаходяться на периферії.
Четвертинна структура характерна також для такого складного білка, як вірус тютюнової мозаїки, молекулярна маса якого близько 40 млн. До складу його молекули входить 2130 ідентичних протомерів з молекулярною масою 17 500. Вірус тютюнової мозаїки (ВТМ) має нук-леопротеїдну природу. Субодиниці вірусу закріплені на молекулі РНК і утворюють спіральну структуру (рис. 30). З'ясовано також четвертинну структуру білків вірусу жовтої мозаїки ріпи, який має молекулярну масу 5 млн і побудований з 180 ідентичних субодиниць (рис. 31).
Четвертинна структура білків має досить важливе значення. Біологічний зміст олігомерності пов'язаний з тим, що наявність субодинич-ної структури дає змогу організмам економити генетичний матеріал.
Рис. ЗО. Будова вірусу тютюнової мозаїки:
а — четвертинна структура; 6 ~ загальний вигляД
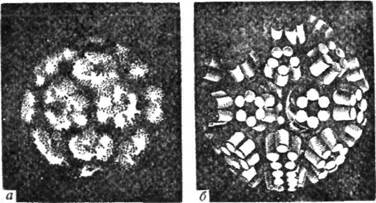
Рис. 31. Четвертинна структура молекули білка вірусу жовтої мозаїки ріпи: а — електронна мікрофотографія; б — модель
Для олігомерних білків, які складаються з ідентичних субодипиць, різко зменшуються розмір структурних генів і довжина іРНК. Наприклад, фермент гліцеральдегіддегідрофосфатгілрогеназа побудований з чотирьох ідентичних поліпептидних ланцюгів, кожен з яких містить 330 залишків амінокислот. Синтез даного ланцюга кодується ділянкою ДНК, яка містить 990 мононуклеотидних ланок. Якщо уявити існування даного ферменту у вигляді одного пол і пептидного ланцюга, довжина якого відповідала б чотирьом ланцюгам, тобто містила 1320 залишків амінокислот (4 • 330 = 1320), то для кодування такого білка вже потрібна була б ділянка ДНК. в чотири рази довша, тобто така, яка містила б 3960 залишків амінокислот (1320 • 3 = 3960). Проте припускають, що якщо поліпептидні ланцюги, які складають четвертинну структуру білка, різняться за складом амінокислот, то їх кодування здійснюється різними генами. Наприклад, у гемоглобіні а-поліпептиди кодуються одним геном, а (З-поліпептиди — іншим. Це стосується ферментів, які побудовані з різних поліпептидних ланцюгів.
Субодинична структура білків є основою будови білків-ферментів і має безпосереднє відношення до існування ізоферментів. Наприклад, якщо молекула ферменту складається з чотирьох протомерів типу А і В, то фермент може існувати в п'яти ізоформах АААА, АААВ, ААВВ, АВВВ. ВВВВ, тобто можливе існування п'яти форм ферменту, які відрізняються каталітичною активністю. Утворення ізоформ ферментів є важливим .механізмом регуляції активності ферментних систем, за рахунок якого забезпечується один з основних механізмів регуляції метаболічних процесів.
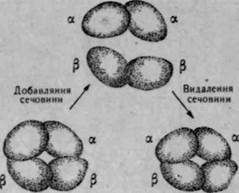 |
Особливістю четвертинної структури білків є те, що при дії на них
різних фізичних або хімічних факторів вони можуть розщеплюватися
(дисоціювати) на окремі протомерк (рис. 32). Такими фактора
ми є органічні розчинни-:
ки, сечовина, концентровані
розчини нейтральних солей,
меркаптоетаноламін, зміна рН
середовища тощо. Під час їх
дії на білок відбувається руй
нування зв'язків, які стабі
лізують четвертинну струк
туру, і молекула білка дисо
ціює на протомери. Для пере
важної більшості білків цей
процес {зворотний, тобто при
усуненні фактора, який ви
кликав дисоціацію, субодини-
ці з'єднуються між собою і
ВІДНОВЛЮЄТЬСЯ четвертинна рис. 32. Схема дисоціації і асоціації субо-
Структура білка. диницьмолекули гемоглобіну
При цьому процесі важливим є те, що піл час відновлення четвертинної структури білка відновлюється і його біологічна активність. Отже, субодинична структура дає змогу регулювати біологічну активність білків шляхом зміщення рівноваги асоціація — дисоціація в той чи інший бік. Оскільки білки з четвертинною структурою мають у складі молекул протомери з невеликою молекулярною масою, значно зменшується вплив випадкових помилок, що можуть виникнути при їх синтезі. Крім того, в процесі асоціації суболиниць в єдину молекулу дефектні субодиниці включені до її складу не будуть.
Четвертинній структурі належить важлива роль і в прискоренні процесів молекулярної еволюції. Мутації, що спричиняють незначні конформаційні зміни на рівні третинної структури за рахунок багатократного підсилення цих змін при переході до четвертинної структури, можуть сприяти виникненню в білків нових властивостей.
Характерною ознакою білків з четвертинною структурою є здат-ністьідо самоорганізації білкових молекул. Самоорганізація олігомер* них білків і надмолекулярних комплексів здійснюється без участі
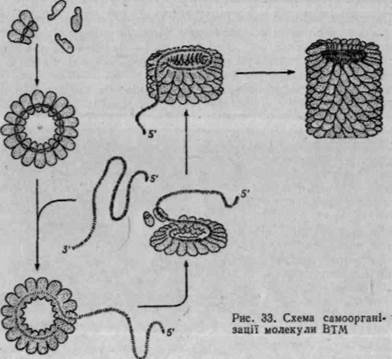
матриці за рахунок реалізації інформації, що закодована в первинній структурі білків (послідовному розміщенні відповідних залишків амінокислот у молекулі). Під самоорганізацією олігомерних білків розуміють здатність до спонтанної (самовільної) впорядкованої асоціації, що приводить до утворення біологічно активних структур. Так, досить легко відбувається самоорганізація молекули гемоглобіну з а-, (3-суб-одиниць. Висока здатність до самоорганізації характерна для таких надмолекулярних структур, як вірус тютюнової мозаїки.] Як відомо, молекула ВТМ складається з 2130 ідентичних субодиниць з молекулярною масою близько 40 млн і одного ланцюга РНК, що складається з 6400 нуклеотидних пар.'У 1962 р. X. Френкель-Конрат одержав активні віруси, здатні інфікувати рослини при змішуванні очищених субодиниць білка оболонки і молекул вірусної РНК. Порядок pQKQitecpyjfc: ції вірусних часточок ВТАІ-яекозано-на рис. 33. Субодиниці вірусу утворюють подвійний диск з 17-кратною коловою симетрією, який приєднується до молекули РНК з З'-кінця. Наступні субодиниці полімери-зуються на даному диску, нарощуючи спіраль (16 V3 субодиниці на 1 оборот) доти, поки не закриється 5'-кінець. Самоорганізацію і само-зборку слід розглядати як найпростіший етап біологічного морфогенезу на молекулярному рівні під час формування елементарних біологічних структур.
