Методы определения вирулентности бактерий и активности бактериальных токсинов на экспериментальных животных
Экспериментальное заражение животных. Инфекционный процесс может быть искусственно воспроизведен путем заражения лабораторных животных: кроликов, морских свинок, белых мышей, белых крыс и др. Это производится для изучения патогенности и вирулентности микроорганизмов, выделения чистой культуры возбудителя из различных материалов (метод биопробы), воспроизведения экспериментальной инфекции и других целей.
Заражают животных накожно, внутрикожно, подкожно, внутримышечно, внутривенно, внутрибрюшинно, перорально, интраназально, интратрахеально и интрацеребрально. Все манипуляции осуществляют с помощью стерильных инструментов. Перед началом опыта животных отбирают, взвешивают и маркируют. Мышь берут за хвост, опускают на стол, туловище быстро прижимают к столу двумя пальцами и, скользя ими по спине, захватывают кожу над головой и фиксируют животное в левой руке в растянутом положении. Взвесь микроорганизмов определенной концентрации набирают в шприц через иглу. Шприц держат как писчее перо в правой руке. При подкожном заражении иглой прокалывают кожную складку на спине или у корня хвоста и медленно вводят содержимое шприца под кожу. Затем иглу быстро извлекают, прикрыв место инъекции ватой, смоченной спиртом. При внутрибрю-шинном заражении животное фиксируют головой вниз, чтобы кишечник переместился к диафрагме. В левой нижней трети живота делают прокол кожи, удерживая иглу под острым уг-



Рис.9.1.1. Дермонекротическая проба, а — отрицательная реакция; б — положительная реакция.
лом, затем переводят шприц в положение, перпендикулярное к брюшной стенке, толчкообразным движением прокалывают брюшину и вводят содержимое шприца.
Дермонекротическая проба. Кролику внутрикожно вводят 0,2 мл бульонной испытуемой культуры туберкулиновым шприцом с тонкой иглой. В положительном случае через 2—3 сут на месте введения образуется очаг некроза (рис. 9.1.1).
Кератоконъюнктивальная проба (Шереня). Суточную агаровую культуру бактерий стандартной петлей диаметром 5 мм вводят под нижнее веко глаза морской свинки. Через 2—4 сут оценивают выраженность кератоконъюнктивита по наличию помутнения роговицы, нагноения и изъязвления.
Определение летальной дозы микробных токсинов. Оценивают количество токсина, вызывающеее гибель 50 % животных, которым вводилось данное вещество. С этой целью готовят ряд десятикратных разведений и вводят отдельным группам животных. Через определенный срок отмечают число погибших в каждой группе животных и производят расчет LD$q.
Бактериологическое исследование трупов животных. Для обнаружения микроорганизмов, вызвавших гибель животного, определения их локализации в организме и выделения чистой культуры возбудителя производят вскрытие зараженного животного сразу после его гибели, соблюдая правила асептики во избежание загрязнения посторонними бактериями. Мышь помещают брюшком кверху на марле, смоченной дезинфицирующим раствором, поверх слоя застывшего парафина в ванночке и прикрепляют булавками за лапки. Тщательно обрабатывают кожу раствором какого-либо антисептика. Вскрытие производят стерильными инструментами (рис. 9.1.2).
Делают продольный разрез кожи по прямой линии от ниж-
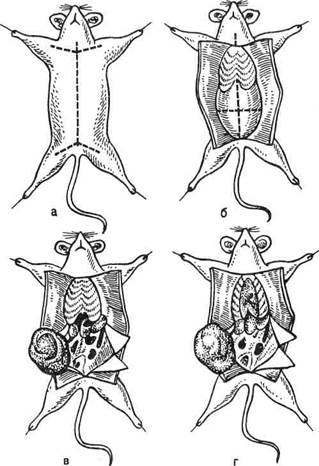
Рис.9.1.2. Вскрытие мыши, а—г — этапы вскрытия.
ней челюсти до лобка, осторожно отсепаровывают лоскуты кожи в стороны. Отмечают состояние подкожной жировой клетчатки и лимфатических узлов, при необходимости делают из них мазки-отпечатки и посевы.
Грудную полость вскрывают поперечным разрезом под мечевидным отростком и двумя продольными разрезами через Ребра параллельно грудине. Откладывают вырезанный лоскут и осматривают органы грудной полости, отмечая в протоколе наличия экссудата. Для посева крови из сердца его поверхность прижигают раскаленным кончиком пинцета и вводят капилляр стерильной пипетки в полость сердца. Затем каплю крови из
 пипетки выдувают в пробирку со средой. Из ткани легких готовят мазки-отпечатки и делают посевы.
пипетки выдувают в пробирку со средой. Из ткани легких готовят мазки-отпечатки и делают посевы.
Брюшную полость вскрывают продольным разрезом брюшины ножницами, не задевая кишечник. Осматривают органы брюшной полости, отмечая в протоколе наличие экссудата, величину, цвет и консистенцию печени, селезенки, надпочечников, брыжеечных лимфатических узлов. При необходимости делают посевы из этих органов на питательные среды.
Для приготовления мазков-отпечатков вырезают из печени, селезенки, почек небольшие кусочки ткани, берут их пинцетом и прикасаются к предметному стеклу поверхностью разреза. Мазки-отпечатки фиксируют в жидком фиксаторе и окрашивают метиленовым синим. При микроскопии отмечают присутствие микроба-возбудителя в различных органах и тканях. Результаты посевов учитывают на следующий день после инкубации в термостате. Данные вскрытия трупа протоколируют. Труп животного после вскрытия подлежит уничтожению.
| Глава 10 |
ПРИКЛАДНАЯ ИММУНОЛОГИЯ
Достижения современной фундаментальной иммунологии находят применение в области прикладной иммунологии, которая занимается вопросами иммунодиагностики, иммунотерапии, иммунопрофилактики и иммунокоррекции. Иммунодиагностика решает несколько разных диагностических задач: оценки иммунного статуса организма, выявления и идентификации специфических антигенов, выявления и количественного определения содержания специфических антител в сыворотке крови и других биологических жидкостях (серодиагностика), оценки эффективности клеточного и гуморального специфического иммунного ответа на конкретный антиген. Иммунотерапия включает применение иммунных сывороток или иммуноглобулинов, содержащих специфические антитела, с целью лечения или экстренной профилактики конкретного заболевания путем создания пассивного иммунитета, а именно — введения в организм готовых антител, способных нейтрализовать токсин или вирус и обеспечить специфическую защиту против возбудителя. Значительно реже с целью лечения хронических инфекций применяют препараты вакцин. Вакцины и анатоксины составляют арсенал иммунопрофилактики, которая преследует цель индуцировать в организме человека выработку собственного активного иммунитета против конкретного антигена, входящего в состав вакцины или анатоксина. При выявлении у больного какого-либо типа иммунопатологии с целью иммунокоррекции используют препараты: иммунодепрессанты или иммуностимуляторы.
Тема 10.1.МЕТОДЫ ВЫЯВЛЕНИЯ И ИДЕНТИФИКАЦИИ СПЕЦИФИЧЕСКИХ АНТИГЕНОВ
Специфичность и прочность связывания антигена с антителами позволяют использовать антитела для выявления и идентификации молекул антигенов в составе микроорганизмов, их продуктов, в клетках, тканях и биологических жидкостях организма. Для этого можно применять методы непосредственного связывания меченых антител известной специфичности с местами локализации соответствующего антигена. Используют различные варианты метки антител: флюоресцентную, ферментную или радионуклидную. Обязательным условием является сохранение нативной структуры антигена, которое обеспечивает возможность связывания антител с неизмененными эпитопами на его поверхности (рис. 10.1.1).
Другая группа методов выявления и идентификации антигенов включает реакции, которые проявляются изменением свойств антигена после взаимодействия со специфическими антителами: склеиванием клеток, выпадением в осадок из коллоидного раствора, утратой токсичности, потерей подвижности и т.д. В соответствии с этими эффектами различают антитела: агглютинины (вызывающие агрегацию клеток, несущих антигены), лизины (вызывающие разрушение клеточных мембран), преципитины (образующие преципитаты, осадки с растворимыми антигенами), антитоксины (нейтрализующие токсины).
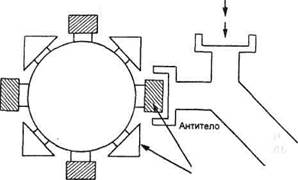 |
| Антигенные детерминанты (эпитопы) |
| Антиген |
| Рис. 10.1.1. Специфичность связывания антигена с антителом: эпитопа антигена с паратопом антитела. |
Паратоп антитела
ПО
 а План
а План
Программа
1. Методы выявления и идентификации специфических антигенов, основанные на реакциях непосредственного связывания антигена с антителами: иммунофлюо-ресцентный метод, радиоиммунный метод, иммуно-ферментный метод.
2. Методы выявления и идентификации специфических антигенов, основанные на реакциях связывания антигена с антителами, проявляющихся изменением свойств антигена: реакция агглютинации, реакция преципитации, реакция иммобилизации, реакция нейтрализации.
Демонстрация
1. Иммунофлюоресцентный метод для индикации присутствия в исследуемом материале возбудителей: бактерий или вирусов.
2. Наборы ингредиентов для иммуноферментного и радиоиммунного методов.
3. Иммуноэлектрофореграммы.
Задание студентам
1.Поставить ориентировочную реакцию агглютинации на стекле с целью идентификации выделенной чистой культуры бактерий. Сделать заключение по результатам реакции.
2. Протоколировать и оценить результаты РИГА, поставленной с целью выявления и идентификации бактериального экзотоксина в исследуемом материале. Сделать заключение по результатам реакции.
3. Протоколировать и оценить результаты реакции преципитации в геле, поставленной с целью определения токсигенности возбудителя дифтерии. Сделать заключение по результатам реакции.
4. Протоколировать и оценить результаты РТГА, постав
ленной с целью идентификации по гемагглютининам
выделенного вируса гриппа. Сделать заключение по
результатам реакции.
Методические указания
1. Иммунофлюоресцентный анализ.Один из наиболее чувствительных методов выявления связывания антител с антигенами в клетках и тканях — иммунофлюоресцентный анализ. Специальный флюоресцентный краситель (флюорохром) прикрепляется химической связью к молекуле специфического антитела, не нарушая его специфичности. Часто используют краситель изотиоцианат флюоресцеина, обладающий желто-зеленой флюоресценцией. Красители, выбранные для иммунофлю-
оресцентно^о метода, активируются светом одной длины волны (чаще —1 ультрафиолетовой части спектра), а сами испускают лучи другой длины волны (видимого спектра). В люминесцентном микроскопе используется в качестве источника света, возбуждающего люминесценцию, ртутная лампа с системой селективных! фильтров, пропускающих в окуляр только свет флюоресцирующего красителя. Прикрепляя разные красители к разным антителам, можно одновременно выявлять несколько антигенов в одной клетке.
Иммунофлюоресцентный метод является методом выбора для быстрого выявления и идентификации неизвестного микроорганизма в исследуемом материале, в связи с чем его называют методом экспресс-диагностики.
Недостатком прямого иммунофлюоресцентного метода является необходимость приготовления широкого набора флюоресцирующих специфических антител против каждого из изучаемых антигенов. Поэтому чаще используют непрямой иммунофлюоресцентный метод, при котором связанные с антигеном специфические антитела (немеченые) выявляются с помощью флюоресцирующих антииммуноглобулиновых антител против иммуноглобулинов того вида, которому принадлежат антиген-специфические антитела.
Применяют и иммуногистохимический метод, при котором к специфическим антителам прикрепляется фермент (например, пероксидаза хрена), способный превратить бесцветный субстрат в окрашенные продукты его ферментативного разложения, видимые в обычный световой микроскоп.
Для использования при электронной микроскопии антиген-специфические антитела можно метить частицами золота, локализация которых укажет на расположение соответствующего антигена.
При прямом иммунофлюоресцентном методе Кунса специфические флюоресцирующие антитела образуют комплексы с микробными антигенами, которые светятся при люминесцентной микроскопии препаратов (рис. 10.1.2).
Непрямой метод предусматривает использование одной универсальной флюоресцирующей сыворотки — антиглобули-новой, содержащей антитела против кроличьих глобулинов, поскольку диагностические антисыворотки получают путем иммунизации кроликов. При этом на образующемся комплексе (специфические антитела + исследуемый антиген) фиксируются флюоресцирующие антиглобулиновые антитела, обеспечивая его свечение при люминесцентной микроскопии (см. рис. Ю.1.2).
На предметном стекле готовят мазок из исследуемого материала, фиксируют на пламени и обрабатывают иммунной кроличьей сывороткой, содержащей антитела против антигенов возбудителя. Для образования комплекса антиген—антитело

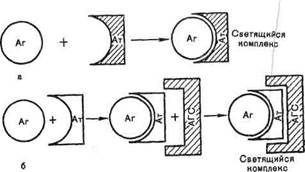
Рис. 10.1.2. Иммунофлюоресцентный метод Кунса.
i — прямой метод; б — непрямой метод: АГ — антиген, AT - антитело,
АГС — антиглобулиновая сыворотка.
препарат помещают во влажную камеру и инкубируют при 37 °С в течение 15 мин, после чего тщательно промывают изотоническим раствором хлорида натрия для удаления не связывающихся с антигеном антител. Затем на препарат наносят флюоресцирующую антиглобулиновую сыворотку против иммуноглобулинов кролика, выдерживают в течение 15 мин при 37 °С, а затем препарат тщательно промывают изотоническим раствором хлорида натрия. В результате связывания флюоресцирующей антиглобулиновой сыворотки с фиксированными на антигене специфическими антителами образуются светящиеся комплексы антиген—антитело, которые обнаруживаются при люминесцентной микроскопии.
2. Иммуноферментный анализ.Один из наиболее распространенных в практике методов — иммуноферментный анализ (ИФА) — основан на использовании двух разных по специфичности моноклональных антител против двух разных антигенных эпитопов в составе искомого антигена. В лунки с иммобилизованными антителами против одного эпитопа добавляют материал, в котором ищут антиген. В процессе инкубации на твердой фазе образуется комплекс антиген—антитело. Затем лунки отмывают от несвязавшихся компонентов и добавляют меченные ферментом антитела против другого эпитопа того же антигена. После повторной инкубации и отмывания от избытка конъюгата антител с ферментом определяют количество связавшихся антител по их ферментативной активности в присутствии субстрата с индикатором. При этом величина активности фермента пропорциональна концентрации исследуемого антигена. На стадии выявления иммунного комплекса антиген оказывается как бы зажатым между молекулами иммобилизированных и меченых антител, что послужило поводом для широко распространенного в литературе названия "сэндвич"-метод.
Повышение специфичности и чувствительности иммуно-ферментно^о анализа, так же как и иммунофлюоресцентного и радиоиммунного методов, связано с использованием моноклональных! антител (МКАТ).
Для получения МКАТ мышей иммунизируют очищенным препаратом антигена, затем выделяют лимфоциты из селезенки и лимфатических узлов и проводят слияние их с миеломными клетками-партнерами. Неслившиеся миеломные клетки погибают, так как они дефектны по синтезу некоторых нуклеотидов и не могут выжить на селективной среде без этих нуклеотидов. Неслившиеся лимфоциты погибают в культуре из-за отсутствия в среде необходимых им трофических факторов. Выживают только гибридные клетки (гибридомы), унаследовавшие от ми-еломных клеток способность к пролиферации в культуре, а от лимфоцитов — способность к синтезу антител соответствующей специфичности. Надосадочную жидкость культур гибридом исследуют с помощью ИФА с соответствующим антигеном. После выявления клеток, секретирующих нужные антитела, их клонируют методом лимитирующих разведений, т.е. клетки разводят таким образом, чтобы получить дочернюю культуру из одной клетки. Тогда все потомство будет генетически идентично: одна клетка дает один клон, который продуцирует МКАТ.
3. Радиоиммунный анализ.Радиоиммунный анализ (РИА) является чрезвычайно чувствительным методом, который может быть использован для количественного определения любого антигена. Чувствительность метода позволяет выявлять незначительные количества антигена.
Для проведения жидкостного радиоиммунного анализа очищенный известный антиген метят радионуклидами, чаще всего 1251. В этом случае используют конкурентный вариант связывания, когда для определения количества антигена в исследуемом образце оценивают его способность конкурировать с меченым референс-антигеном в связывании со специфическими антителами. Образующиеся комплексы антиген—антитело выделяют осаждением (сульфатом аммония или антиантителами) и определяют их радиоактивность в сопоставлении с радиоактивностью несвязанного антигена в надосадочной жидкости. Использование ряда концентраций немеченого антигена позволяет построить стандартную калибровочную кривую, с помощью которой определяется концентрация исследуемого антигена.
Более современный метод — твердофазный РИА, при котором специфические антитела фиксируются на твердой фазе, к ним добавляется исследуемый антиген, а затем меченый стандартный антиген. Определение связанной и несвязанной метки позволяет построить калибровочную кривую и определить количество исследуемого антигена.
РИА широко применяют для количественного определения
 различных веществ: гормонов (инсулина, гормона роста, адре-нокортикотропного гормона, трийодтиронина, тироксина, эстрогена), белков сыворотки крови (IgE, сс-фетопротеина и др.), метаболитов (фолиевой кислоты, циклических нуклеотидов и др.), лекарственных препаратов (дигоксина, дигитоксина, морфина), микробных антигенов (HBsAg).
различных веществ: гормонов (инсулина, гормона роста, адре-нокортикотропного гормона, трийодтиронина, тироксина, эстрогена), белков сыворотки крови (IgE, сс-фетопротеина и др.), метаболитов (фолиевой кислоты, циклических нуклеотидов и др.), лекарственных препаратов (дигоксина, дигитоксина, морфина), микробных антигенов (HBsAg).
4. Реакция агглютинации. Влабораторной диагностике ин
фекционных заболеваний реакцию агглютинации очень часто
применяют для идентификации видов и сероваров (серотипи-
рование) бактерий с помощью диагностических агглютиниру
ющих сывороток. Реакция агглютинации (РА) на стекле (плас
тинчатая реакция агглютинации) ставится с одним разведением
диагностической агглютинирующей сыворотки, которое в за
висимости от ее титра составляет 1:10, 1:25, 1:50 или 1:100.
Предметное стекло делят на квадраты восковым карандашом. В один квадрат наносят каплю изотонического раствора хлорида натрия, в другой — каплю сыворотки. Затем петлей в каждую каплю вносят небольшое количество бактериальной культуры и перемешивают круговыми движениями в каждой капле до получения равномерной взвеси. Стекло можно слегка подогреть, высоко держа над пламенем горелки в течение 2—4 мин. Реакция протекает быстро. Наблюдают за появлением зерен и хлопьев агглютината в каплях. Учет производят через 3—5 мин (рис. 10.1.3).
Кроме специфической агглютинации бактерий, вызванной антителами, возможна спонтанная агглютинация (в отсутствие иммунной сыворотки). Спонтанную агглютинацию дают R-формы бактерий, не образующие гомогенной взвеси в изотоническом растворе хлорида натрия и осаждающиеся в виде клеточных агрегатов. При кислой реакции среды в результате снятия одноименного заряда с поверхности бактериальных клеток в изоэлектрической зоне также происходит склеивание — наступает "кислотная" агглютинация. Чтобы исключить возможность учета ложноположительных результатов спонтанной агглютинации, всегда ставят контрольную пробу с изотоническим раствором хлорида натрия.
5. Реакция непрямой гемагглютинации.Реакция непрямой
гемагглютинации (РНГА) отличается значительно более высо
кой чувствительностью и специфичностью, чем реакция агг
лютинации. Ее используют для идентификации возбудителя по
его антигенной структуре или для индикации и идентификации
бактериальных продуктов — токсинов — в исследуемом пато
логическом материале. Соответственно используют стандарт
ные (коммерческие) эритроцитарные антительные диагности-
кумы, полученные путем адсорбции специфических антител на
поверхности танизированных (обработанных танином) эритро
цитов. В лунках пластмассовых пластин готовят последователь
ные разведения исследуемого материала. Затем в каждую лунку
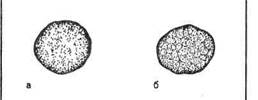
Рис. 10.1.3. Реакция агглютинации на стекле, а — наличие агглютинации; б — отсутствие агглютинации.
вносят одинаковый объем 3 % суспензии нагруженных антителами эритроцитов. При необходимости реакцию ставят параллельно в нескольких рядах лунок с эритроцитами, нагруженными антителами разной групповой специфичности. Через 2 ч инкубации при температуре 37 "С учитывают результаты, оценивая внешний вид осадка эритроцитов (без встряхивания): при отрицательной реакции появляется осадок в виде компактного диска или кольца на дне лунки, при положительной реакции — характерный кружевной осадок эритроцитов, тонкая пленка с неровными краями.
6. Реакция преципитации и ее варианты.Реакция преципитации характеризуется осаждением специфических мелкодисперсных антигенов эквивалентным количеством антител в присутствии электролита. Выпадение нерастворимого комплекса антиген—антитело в виде осадка наблюдается лишь при эквивалентных соотношениях ингредиентов, поскольку образовавшийся комплекс может раствориться в избытке антигена или антител. Антиген должен иметь характер прозрачного коллоидного раствора.
В лабораторной диагностике инфекционных заболеваний реакция преципитации служит главным образом для выявления или идентификации антигена (преципитиногена) по известной преципитирующей сыворотке, содержащей антитела (преципитины). Для приготовления коллоидных растворов антигенов, участвующих в реакции преципитации, используют различные методы их экстракции из исследуемого материала (шкуры, шерсть, мясо животных).
Реакция преципитации проводится с прозрачными коллоидными растворимыми антигенами, экстрагированными из патологического материала, объектов внешней среды или чистых культур бактерий. В реакции используют прозрачные диагностические преципитирующие сыворотки с высокими титрами антител. За титр преципитирующей сыворотки принимают то наибольшее разведение антигена, которое при взаимодействии с иммунной сывороткой вызывает образование видимого преципитата — помутнение (табл. 10.1.1).
 Таблица 10.1.1. Постановка реакции преципитации (форма прото
Таблица 10.1.1. Постановка реакции преципитации (форма прото
кола)____
| Ингредиенты, мл | Опытная проба | Номер контрольной пробирки | ||
Стандартная преципитирующая 0,3 — 0,3 0,3 0,3 сыворотка
Нормальная кроличья сыворотка — 0,3 — — —
Экстракт исследуемого материала 0,3 0,3 — — —
Стандартный антиген _____
Контрольный экстракт — — 0,3 — —
Изотонический раствор хлорида — — — — 0,3
натрия
Результаты
Реакция кольцепреципитации ставится в узких пробирках (диаметр 0,5 см), в которые вносят по 0,2—0,3 мл преципити-рующей сыворотки. Затем пастеровской пипеткой медленно наслаивают 0,1—0,2 мл раствора антигена. Пробирки осторожно переводят в вертикальное положение. Учет реакции производят через 1—2 мин. В случае положительной реакции на границе между сывороткой и исследуемым антигеном появляется преципитат в виде белого кольца. В контрольных пробирках преципитат не образуется (рис. 10.1.4).
Реакция преципитации в геле. Чашки заливают агаром, в котором вырезают несколько лунок на равном расстоянии друг от друга. В центральную лунку вносят сыворотку, содержащую антитела, в остальные — различные испытуемые антигены или один и тот же антиген в различных разведениях. При диффузии реагентов в агаровом геле в зонах оптимальных соотношений на месте встречи антигена и антител образуются мутные полосы — дуги преципитации (рис. 10.1.5).
В случае постановки реакции преципитации с различными разведениями антигена можно установить титр преципитирую-щей сыворотки — максимальное разведение антигена, которое дает преципитацию с данной сывороткой. Одна из разновидностей реакции преципитации в геле позволяет определить токсигенность исследуемых бактерий, например бактерий дифтерии (см. тему 14.2). При наличии токсигенной культуры в месте взаимодействия токсина с антитоксином образуются линии преципитации в виде дуг (рис. 10.1.6).
7. Иммуноэлектрофорез (ИЭФ). Иммуноэлектрофоретичес-кий анализ представляет собой сочетание электрофореза в агаровом геле с иммунодиффузией. Вначале проводят электрофо-ретическое разделение белков в агаровом геле. После разделения в канавку, которая идет параллельно линии миграции
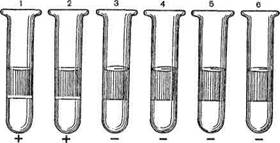
Рис. 10.1.4. Реакция преципитации.
1 — преципитирующая сыворотка + исследуемый материал; 2 — преципитирующая сыворотка + гомологичный преципитиноген; 3 — преципитирующая сыворотка + контрольный экстракт без антигена; 4 — преципитирующая сыворотка + изотонический раствор хлорида натрия; 5 — нормальная сыворотка + исследуемый антиген; 6 — нормальная сыворотка + контрольный экстракт без антигена.
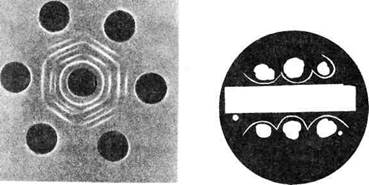
Рис. 10.1.5. Реакция преципитации Рис.10.1.6. Определение токси-
в геле по Оухтерлони. генности коринебактерий диф-
терии в реакции преципитации в агаре.
белков, вносят преципитирующую иммунную сыворотку. Антигены и антитела диффундируют в геле навстречу друг другу, и в месте их взаимодействия возникают дугообразные линии преципитации, число, положение и форма которых дают представление о составе исходной смеси антигенов. ИЭФ — один из широко распространенных методов качественного анализа антигенов. Располагая соответствующими преципитирующими антисыворотками, с его помощью можно исследовать любую антигенную смесь. В частности, успешно анализируются белки сыворотки крови, спинномозговой жидкости, мочи, молока,
 экстрактов из органов, а также белки растительного и бактериального происхождения.
экстрактов из органов, а также белки растительного и бактериального происхождения.
8. Реакция торможения гемагглютинации. Типирование вируса проводят в реакции торможения гемагглютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса гриппа А с антигенами H0N1, H1N1, H2N2, H3N2 и другие могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток (табл. 10.1.2, 10.1.3).
Таблица 10.1.2. Постановка РТГА для типирования вируса
| Манипуляции | Номера пробирок | |||||||
| опытные | контрольные | |||||||
| 1к | 2к | Зк | ||||||
Приготовление разведе- 1:10 1:20 1:40 1:80 1:160 1:10
ний типоспецифической
сыворотки
Внесение сыворотки, мл 0,2 0,2 0,2 0,2 0,2 0,2 — —
Внесение суспензии ви- 0,2 0,2 0,2 0,2 0,2 —- 0,2 —
руса (4 гемагглютини-
рующие дозы в 0,2 мл)
Внесение изотоническо- — — — — — — 0,2 0,4
го раствора хлорида натрия, мл
Экспозиция 60 мин при комнатной температуре Внесение 1 % суспензии 0,4 0,4 0,4 0,4 0,4 0,4 0,4 0,4 эритроцитов курицы, мл
Экспозиция 30—60 мин при комнатной температуре Учет результатов
Таблица 10.1.3. Результаты РТГА при типировании вируса гриппа
| Типоспецифи- | Разведение сыворотки | Контроль | ||||||
| вогриппозная сыворотка | 1:10 | 1:20 | 1:40 | 1:80 | 1:160 | сыворотки | вируса | эритроцитов |
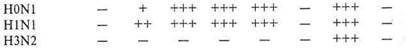
Условные обозначения: (+++) — наличие просветов в пленке; (++) — наличие пленки с фестончатыми краями из склеивающихся эритроцитов; (+) — хлопьевидный осадок эритроцитов, окруженный зоной комочков агглютинированных эритроцитов; (—) — резко очерченный осадок эритроцитов, неотличимый от контроля.
Тема 10.2. МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКИХ АНТИТЕЛ (СЕРОДИАГНОСТИКА)
Количество специфических антител в сыворотке крови можно определить методами непосредственного выявления связывания со специфическим антигеном. Два наиболее современных метода серологических исследований: радиоиммунный и иммуноферментный. В любом случае нужен известный очищенный антиген, к которому прикрепляется метка: радионук-лидная или ферментная. Соответственно связывание меченого антигена с антителами учитывается радиометрическим или спек-трофотометрическим методом.
Кроме методов непосредственного выявления связывания антител с антигеном, используют серологические исследования, основанные на изменении свойств антигена: реакции агглютинации, преципитации, иммунного лизиса, связывания комплемента, нейтрализации.
▲ План
▲ Программа
1. Методы непосредственного выявления связывания антигена с антителами: радиоиммунный метод, иммуноферментный метод, иммунофлюоресцентный метод.
2. Методы связывания антигена с антителами, проявляющегося изменением свойств антигена: реакция агглютинации, реакция преципитации, реакции иммунного лизиса, реакция связывания комплемента, реакции нейтрализации.
А Демонстрация
1. Диагностические препараты для выявления антител (диагностикумы).
А Задание студентам
1. Протоколировать и оценить результаты развернутой реакции агглютинации, поставленной с целью определения титра специфических антител в исследуемой сыворотке.
2. Протоколировать и оценить результаты РИГА, поставленной с целью серодиагностики.
3. Протоколировать и оценить результаты реакции преципитации в геле, поставленной с целью серодиагностики.
4. Протоколировать и оценить результаты титрования комплемента с целью расчета рабочей дозы комплемента.
5. Протоколировать и оценить результаты реакции связывания комплемента (РСК), поставленной с целью серодиагностики.
6. Протоколировать и оценить результаты реакции Кум-
 бса, поставленной с целью определения титра неполных антител в исследуемой сыворотке.
бса, поставленной с целью определения титра неполных антител в исследуемой сыворотке.
7. Протоколировать и оценить результаты иммунофер-ментного анализа с целью выявления специфических антител в исследуемых сыворотках.
8. Протоколировать и оценить результаты реакции флок-куляции, поставленной с целью титрования антитоксической сыворотки.
9. Протоколировать и оценить результаты антистрепто-лизиновой реакции, поставленной с целью серодиагностики ревматизма.
10. Протоколировать и оценить результаты РТГА, постав
ленной с целью серодиагностики вирусной инфекции.
Сделать заключение по результатам каждой серологи
ческой реакции.
Методические указания
Для приготовления сыворотки взятую из вены кровь в количестве 3—4 мл помещают в термостат при 37 °С на 10—15 мин. После свертывания крови сгусток отслаивают от стенок пробирки стеклянной палочкой и выдерживают при 4 °С в течение часа для лучшей ретракции сгустка и более полного отделения сыворотки. Затем сыворотку осторожно отсасывают пипеткой.
1. Радиоиммунный метод.Количество специфических антител в исследуемом образце можно определить, используя вариант конкурентного связывания: по их способности ингибиро-вать связывание радиоактивно меченных антител со специфическим антигеном, фиксированным на твердой фазе. Но чаще используют метод выявления связавшихся с антигеном на твердой фазе специфических антител с помощью радиоактивно меченных антииммуноглобулиновых антител, специфичных к константной области молекулы иммуноглобулина. Проще всего получить антииммуноглобулиновую сыворотку путем иммунизации животных одного вида иммуноглобулинами животного другого вида. Такая антииммуноглобулиновая сыворотка будет связывать любые молекулы иммуноглобулинов соответствующего вида (мышей, кроликов или других видов). Такую меченную радионуклидами антииммуноглобулиновую сыворотку против иммуноглобулинов человека используют в РИА для выявления связывания немеченых человеческих антител на фиксированном антигене. Эта антииммуноглобулиновая сыворотка "распознает" антитела разной специфичности, связываясь с антигенными эпитопами в константной части молекул. Используя РИА или ИФА, можно определить не только количество антигенспецифических антител, но и принадлежность этих антител к тому или иному изотипу иммуноглобулинов. Для этого используют антииммуноглобулиновые антитела, специфичные для отдельных изотипов иммуноглобулинов. По-
лучение таких антииммуноглобулиновых антител начинается с иммунизации животного очищенным препаратом одного из изотипов иммуноглобулинов. Из полученной иммунной сыворотки путем многократной абсорбции удаляют все антитела, перекрестно реагирующие с иммуноглобулинами других изотипов. Полученные антиизотипические антитела используют для определения количества антител каждого из изотипов в иммунной сыворотке, реагирующей с антигеном. Особая роль отводится антителам против IgE, которые позволяют определить количество иммуноглобулинов этого изотипа и специфических антител, относящихся к этому изотипу, при лабораторной диагностике аллергических реакций анафилактического типа и атопических заболеваний.
2. Иммуноферментный анализ.Одним из наиболее чувствительных методов выявления антител считается ИФА, который не уступает по чувствительности РИА и в то же время отличается от него большей доступностью для обычных диагностических лабораторий. Специфический антиген адсорбируют на поверхности лунок в пластинах из полистирола (поливинил-хлорида). Фиксированный на пластине антиген инкубируют с испытуемыми человеческими сыворотками. После отмывания от несвязавшихся белков связанные иммобилизованными антигенами иммуноглобулины выявляют с помощью антивидо-вой (античеловеческой) антииммуноглобулиновой сыворотки, меченной ферментом пероксидазой. После инкубации с субстратом (пероксидом водорода) и индикатором оценивают ферментативную активность по интенсивности окраски. Интенсивность окраски, пропорциональную количеству сорбированных на антигене антител, можно оценить визуально или с помощью спектрофотометра. В данной модификации удобна универсальность меченого реагента, который позволяет выявлять антитела к разным антигенам.
3. Иммуноэлектрофорез.Для выявления антител, специфических по отношению к отдельным антигенным компонентам в составе сложной смеси, например к отдельным антигенам микроорганизмов, приходится прибегать к методам выделения белков из смеси. Одним из наиболее популярных методов выделения белков является электрофорез в полиакриламидном геле (PAGE) в присутствии додецилсульфата натрия (SDS), который получил сокращенное обозначение: SDS-PAGE. Белковые фракции распределяются в геле в соответствии с их размерами. После этого разделенные в электрофоретическом поле белки переносят на нитроцеллюлярную пластину, где они обрабатываются специфической антисывороткой. Положение белков, с которыми связываются специфические антитела, выявляется с помощью антииммуноглобулиновых антител, меченных ферментом или радионуклидом. Этот метод получил название Western blot и используется в качестве уточняющего

 при выявлении в сыворотке крови антител против вируса иммунодефицита человека. Для этого белки вируса разделяют с помощью SDS-PAGE, разделенные белки переносят на пластину нитроцеллюлозы и проводят инкубацию с испытуемой сывороткой. Антитела из сыворотки связываются с разными антигенными фракциями, что выявляется с помощью фер-ментно-меченой антииммуноглобулиновой сыворотки против иммуноглобулинов человека.
при выявлении в сыворотке крови антител против вируса иммунодефицита человека. Для этого белки вируса разделяют с помощью SDS-PAGE, разделенные белки переносят на пластину нитроцеллюлозы и проводят инкубацию с испытуемой сывороткой. Антитела из сыворотки связываются с разными антигенными фракциями, что выявляется с помощью фер-ментно-меченой антииммуноглобулиновой сыворотки против иммуноглобулинов человека.
4. Иммунофлюоресцентный метод.Используется, например, в серодиагностике сифилиса. Мазок из взвеси T.pallidum на стекле обрабатывают исследуемой сывороткой, в которой подозревается присутствие специфических антител. Если в сыворотке имеются антитела против антигенов спирохеты, они связываются с микробом. Избыток антител удаляют отмыванием. Мазок дополнительно обрабатывают флюоресцирующей сывороткой против человеческих иммуноглобулинов. О выявлении специфических антител в исследуемой сыворотке будет свидетельствовать обнаружение светящихся спирохет при люминесцентной микроскопии мазка.
Аналогичным методом выявляют антинуклеарные антитела (антитела против ДНК) в сыворотке крови при ряде аутоиммунных заболеваний, используя в качестве антигена ядерные клетки животного происхождения.
5. Реакция развернутой агглютинации.Сначала готовят основное разведение сыворотки, из которого делают серию разведений путем последовательного переноса 1 мл из предыдущей пробирки в следующую пробирку ряда. Из последней пробирки 1 мл разведенной сыворотки удаляют для сохранения одинакового объема. В контрольную пробирку (контроль антигена) вносят 1 мл изотонического раствора хлорида натрия. В каждую пробирку с разведениями сыворотки и в контрольную пробирку вносят пастеровской пипеткой по 2 капли взвеси бактерий, содержащей 3 млрд микробных тел в 1 мл. Пробирки встряхивают и помещают в термостат при 37 °С на 2 ч, затем сутки выдерживают при комнатной температуре. Учет реакции развернутой агглютинации производят, оценивая последовательно каждую пробирку, начиная с контрольных, при осторожном встряхивании. В контрольных пробирках агглютинации не должно быть. Интенсивность реакции агглютинации отмечают следующими знаками: "++++" — полная агглютинация (хлопья агг-лютината в абсолютной прозрачной жидкости), "+++" — неполная агглютинация (хлопья в слабоопалесцирующей жидкости), "++" — частичная агглютинация (хлопья четко различимы, жидкость слегка мутная), "+" — слабая , сомнительная агглютинация (жидкость очень мутная, хлопья в ней плохо различимы), "—" — отсутствие агглютинации (жидкость равномерно мутная) (рис.
10.2.1).
За титр сыворотки принимают последнее ее разведение, в
 |
котором интенсивность агглютинации оценивается не менее чем "++".
