Регенерация периферических нервов
При разрушении участка периферического нерва в течение недели наступает восходящая дегенерация проксимальной (ближайшей к телу нейрона) части аксона с последующим некрозом как аксона, так и шванновской оболочки. На конце аксона формируется расширение (ретракционная колба). В дистальной части волокна после его перерезки отмечается нисходящая дегенерация с полным разрушением аксона, распадом миелина и последующим фагоцитозом детрита макрофагами и глией (рис. 1.5.7, 1.5.8).
Начало регенерации характеризуется сначала пролиферацией шванновских клеток, их передвижением вдоль распавшегося волокна с образованием клеточного тяжа, лежащего в эн-доневральных трубках. Таким образом, шван-новские клетки восстанавливают структурную целостность в месте разреза. Фибробласты также пролиферируют, но медленнее шванновских клеток. Указанный процесс пролиферации шванновских клеток сопровождается одновременной активацией макрофагов, которые первоначально захватывают, а затем лизируют оставшийся в результате разрушения нерва материал.
Следующий этап характеризуется прорастанием аксонов в щели, образованные шваннов-скими клетками, проталкиваясь от проксимального конца нерва к дистальному. При этом от ретракционной колбы в направлении дистальной части волокна начинают отрастать тонкие веточки (конусы роста). Регенерирующий аксон растет в дистальном направлении со скоростью 3—4 мм/сут вдоль лент из шванновских клеток (ленты Бюгнера), которые играют направляющую роль. В последующем наступает дифференциация шванновских клеток с образова-
Глава 1. КЛЕТКА И ТКАНИ

 |
| Дистальное Проксимальное } i |
| Место повреждения t t_________ tt___ ft |
 J
J
| Ретроградная |
Уолеров- Тер- Транс-ская миналь- нейронная ная
Рис. 1.5.7. Термины, используемые при описании
различных типов дегенерации нейронов и нервных
волокон
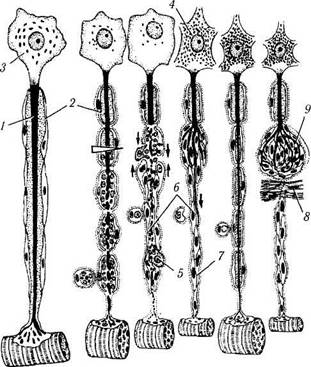
Рис. 1.5.8. Регенерация миелинового нервного волокна:
а — после перерезки нервного волокна проксимальная часть аксона (/) подвергается восходящей дегенерации, миелиновая оболочка (2) в области повреждения распадается, перикарион (3) нейрона набухает, ядро смещается к периферии, хромафильная субстанция (4) распадается; б—дистальная часть, связанная с иннервируемым органом, претерпевает нисходящую дегенерацию с полным разрушением аксона, распадом миелиновой оболочки и фагоцитозом детрита макрофагами (5) и глией; в — лем-моциты (6) сохраняются и митотически делятся, формируя тяжи — ленты Бюгнера (7), соединяющиеся с аналогичными образованиями в проксимальной части волокна (тонкие стрелки). Через 4—6 недель структура и функция нейрона восстанавливается, от проксимальной части аксона дистально отрастают тонкие веточки (жирная стрелка), растущие вдоль ленты Бюгнера; г — в результате регенерации нервного волокна восстанавливается связь с органом-мишенью и регрессирует ее атрофия; д — при возникновении преграды (8) на пути регенерирующего аксона компоненты нервного волокна формируют травматическую неврому (9), которая состоит из разрастающихся веточек аксона и леммоцитов
нием миелина и окружающей соединительной ткани. Коллатерали и терминали аксонов восстанавливаются в течение нескольких месяцев. Регенерация нервов происходит только при условии отсутствия повреждения тела нейрона, небольшом расстоянии между поврежденными концами нерва, отсутствии между ними соединительной ткани. При возникновении преграды на пути регенерирующего аксона развивается ампутационная нейрома. Регенерация нервных волокон в центральной нервной системе отсутствует.
Литература
1. Афанасьев Ю. И., Юрина Н. А. Гистология, ци
тология и эмбриология. — М.: Медицина, 1999. — 744 с.
2. Билич Г., Катинас Г. С, Назарова JJ. В. Цито
логия. — Спб., 1999.— 216 с.
3. Быков В. JI. Цитология и общая биология. —
Спб.: СОТИС, 1999.— 519 с.
4. Быков В. JI. Частная гистология человека. —
Спб.: СОТИС, 1997.— 300 с.
5. Дудел Д., Циммерман Л. Физиология чело
века: В 4 т. / Пер. с англ.; под ред. Р. Шмидта и
Г. Тевса. — Т. 2. — М.: Мир, 1985.— 240 с.
6. Луцик О. Д., 1ванова А.Й., Кабак К-С. Псто-
лопя людини.—Льв1в: Мир, 1992. — С. 399.
7. Леей А., Сикевиц И. Структура и функция клет
ки. — М.: Мир, 1971, —583 с.
8. Хэм А., Кормак Д. Гистология / Пер. с англ. —
М.: Мир, 1982,— 1350 с.
9. Елисеев В. Г. Гистология.—М.: Медицина,
1972.— С. 612.
10. Toda K-, Fitzpatrlck Т. В. The origin of melano-somes, in Kawamura T. (eds): Biology of normal and Abnormal melanocytes // Tokyo, University of Tokyo press. — 1971. — P. 265—267.
U.Szabo G., Gerald А. В., Pathak M. A. Racial differences in the fate of meanosomes in human epidermis // Nature. — 1969.— Vol. 222. — P. 1081— 1082.
12. Wolff K- Melanocyte-Keratinocyte interactions in
vivo: The fate of melanosomes // Yale J Biol Med. —
1973.—Vol. 46.— P. 384—396.
13. Ramirez F., Pereira L. The fibrillins // Int J Bio-
chem Cell Biol. — 1999. — Vol. 31. —P. 255—259.
14. Kielty С M., Shuttleworth С A. Fibrillin-contain-
ing microfibrils: structure and function in health and di
sease // Int J Biochem Cell Biol. — 1995. —Vol. 27. —
p. 747—760.
15. Sakai L. Y., Keene D. R., Engvall E. Fibrillin, a
new 350-kd glycoprotem, is a component of extracellu
lar microfibrils // J Cell Biol. — 1986. — Vol. 103.—
P. 2499.
16. Wright D. W., McDaniels С N., Swasdison S.
Immunisation with undenatured bovine zonular fibrils
results in monoclonal antibodies to fibrillin // Matrix
Biol. — 1994.— Vol. 14.— P. 41—49.
17'. Thurmond F.A., Trotter J. A. Morphology and biomechanics of the microfibrillar network of sea cucumber dermis // J Exp Biol. — 1996. — Vol. 199.— P. 1817—1828.
18. McConnell СМ., DeMont M.E., Wright G. M.
Microfibrils provide non-linear elastic behaviour in the
abdominal artery of the lobster Homarus americanus //
J. Physiol.—1997.—Vol. 499. — P. 513—526.
19. Rosenbloom J., Abrams W. R., Mecham B. Extra
cellular matrix 4: the elastic fibre // FASEB J. —
1993.— Vol. 7.— P. 1208—1218.
Литература
 20. Davis Е.С., Mecham R. P. Intracellular trafficking of tropoelastin // Matrix Biol. — 1998. — Vol. 17. — P. 245—254.
20. Davis Е.С., Mecham R. P. Intracellular trafficking of tropoelastin // Matrix Biol. — 1998. — Vol. 17. — P. 245—254.
2\.Mayne R., Mayne P. R., Baker J. R. Fibrilllin-1 is the major protein present in bovine zonular fibrils // Invest Ophthalmol Vis Sci. — 1997. — Vol. 38.— P. 1399—1411.
22. Wheatley H.M., Traboulsi E.I., Flowers В. Е.
Immunohistochemical localization of fibrillin in human
ocular tissues // Arch Ophthalmol. — 1995. — Vol. 113.—
P. 103—109.
23. Walacce R. N., Streeten B. W., Hanna R. B. Ro
tary shadowing of elastic system microfibrils in the ocu
lar zonule, vitreous, and ligamentum nuchae // Curr
Eye Res. — 1991, — Vol. 10.— P. 99—108.
24. Wright D. W., Mayne R. Vitreous humor of
chicken contains two fibrillar systems: an analysis of
their structure // J. Ultra Mol. Struct. Res. — 1988. —
Vol. 100. — P. 224—234.
25. Bishop P., Ayad S., Reardon A. Type VI collagen
is present in human and bovine vitreous // Graefes
Arch. Clin. Exp. Ophthalmol. — 1996.— Vol. 234.—
P. 710—713.
26. Lee В., Godfrey M., Vitale E. Linkage of Mar-
fan syndrome and a phenotypically related disorder
to two different fibrillin genes // Nature.— 1991.—
Vol. 352. — P. 330—338.
27. Zhang H., Apfelroth S. D., Ни W. Structure and
expression of fibrillin-2, a novel microfibrillar compo
nent preferentially located in elastic matrices // J. Cell
Biol. — 1994.— Vol. 124.— P. 855—863.
28. Zhang H., Ни W., Ramirez F. Developmental
expression of genes suggests heterogeneity of extracel
lular microfibrils // J. Cell Biol. — 1995. — Vol. 129. —
P. 1165—1176.
29. Mir S., Wheatley H. M., Maumenee-Hussels I. E.
A comparative histologic study of the fibrillin microfibril
lar system in the lens capsule of normal subjects and
subjects with Marfan syndrome // Invest Ophthalmol
Vis Sci. — 1998. — Vol. 39. — P. 84—93.
30. Farnsworth P. N. В., Burke P. Three-dimensional architecture of the suspensory apparatus of the lens of the rhesus monkey // Exp. Eye Res. — 1977. — Vol. 25. — P. 563.
3\.Pessier A. P., Potter K-A. Ocular pathology in bovine Marfan syndrome with demonstration of altered fibrillin immunoreactivity in explanted ciliary body cells // Lab Invest. — 1996. — Vol. 75. — P. 87—95.
32. Kielty СМ., Davies 5., Phillips J. Marfan synd
rome expression and microfibrillar abnormalities in a
family with predominant ocular defects // J. Med. Ge
net. — 1994. — Vol. 31. —P. 1—5.
33. Izquierdo N. J., Traboulsi E., Enger C. Glauco
ma in the Marfan syndrome // Trans Am Ophthalmol
Soc. — 1992. — Vol. 90.— P. 111 — 122.
34. Izquierdo N. J., Traboulsi E. /., Enger C. Strabis
mus in the Marfan syndrome // Am. J. Ophthalmol. —
1994.—Vol. 117.— P. 632—635.
35. Allen R., Straatsma В., Apt L. Ocular manifesta
tions of the Marfan syndrome // Trans. Am. Acad. Oph
thalmol. Otolaryngol. — 1967. — Vol. 71.— P. 18—38.
36. Ramsay M.S., Fine B.S., Shields J.A. The Mar
fan syndrome. A histopathologic study of ocular findings
//Am. J. Ophthalmol.—1973. —Vol. 76. —P. 103—116.
37. Cross H.E., Jensen A. D. Ocular manifestations
in the Marfan syndrome and homocystinuria // Am J.
Ophthalmol. — 1973. —Vol. 75. — P. 405—419.
38. Freissler K., Kuchle M., Naumann G. О. Н. Spon
taneous dislocation of the lens in pseudoexfoliation
syndrome // Arch Ophthalmol. — 1995. — Vol. 113.—
P. 1095—11??.
39. Schlutzer-Schrehardt U., Naumann G.O.H.
A histopathologic study of zonular instability in pseudo-
exfoliation syndrome // Am. J. Ophthalmol.— 1994. —
Vol. 118.— P. 730—743.
40. Schlutzer-Schrehardt U., Stumer J. P., Reme С. Е.
The fibrillin-containing microfibrillar network in the
trabecular meshwork of normal and glaucomatous eyes
// Invest Ophthalmol Vis Sci. — 1997. — Vol. 38.—
P. 2117—2126.
