Общие сведения об азотистом обмене
Белки пищевых продуктов являются основным источником азота для организма. Азот выводится из организма в виде конечных продуктов азотистого обмена. Состояние азотистого обмена характеризуется понятием азотистый баланс.
Азотистый баланс – соотношение между поступающим в организм и выводимым из организма азотом. Различают три вида азотистого баланса: азотистое равновесие, положительный азотистый баланс, отрицательный азотистый баланс
При положительном азотистом балансе поступление азота преобладает над его выделением. В физиологических условиях встречается истинный положительный азотистый баланс (беременность, лактация, детский возраст). Для детей в возрасте 1 года жизни он составляет +30%, в 4 года +25%, в подростковом возрасте +14%. При заболевании почек возможен ложный положительный азотистый баланс, при котором происходит задержка в организме конечных продуктов азотистого обмена.
При отрицательном азотистом балансе преобладает выделение азота над его поступлением. Это состояние возможно при таких заболеваниях как туберкулез, ревматизм, онкологические заболевания.
Азотистое равновесие характерно для здоровых взрослых людей, у которых поступление азота равно его выделению.
Азотистый обмен характеризуется коэффициентом изнашивания, под которым понимают то количество белка, которое теряется из организма в условиях полного белкового голодания. Для взрослого человека он составляет 53 мг N/ кг (или 24 г белка/сутки). У новорожденных коэффициент изнашивания выше и составляет 120 мг N на 1 кг массы тела. Азотистое равновесие обеспечивается белковым питанием.
Белковый рацион характеризуется опредёленными количественными и качественными критериями.
Количественные критерии белкового питания
Белковый минимум – то количество белка, которое обеспечивает азотистое равновесие при условии, что все энергетические затраты обеспечиваются углеводами и жирами. Он составляет 40-45 г/сутки. При длительном использовании белкового минимума страдают иммунные процессы, процессы кроветворения, репродуктивная система. Поэтому для взрослых людей необходим белковый оптимум - то количество белка, которое обеспечивает выполнение всех его функций без ущерба для здоровья. Он составляет 100 – 120 г/сутки.
Для детей норма потребления в настоящее время пересматривается в сторону её снижения. Для новорожденного потребность в белках составляет около 2 г/кг, к концу первого года снижается при естественном вскармливании до 1 г/кг, при искусственном вскармливании остаётся в пределах 1,5 – 2 г/кг
Качественные критерии белкового питания
Более ценные для организма белки должны отвечать следующим требованиям:
· содержать набор всех незаменимых аминокислот (валин, лейцин, изолейцин, треонин, метионин, лизин, аргинин, гистидин, триптофан, фенилаланин);
· соотношение между аминокислотами должно быть близким к соотношению их в тканевых белках;
· хорошо перевариваться в желудочно-кишечном тракте.
Этим требованиям в большей степени отвечают белки животного происхождения. Для новорожденных все белки должны быть полноценными (белки грудного молока). В возрасте 3-4 лет около 70-75% должно приходиться на полноценные белки. Для взрослых людей их доля должна составлять около 50%.
Переваривание белков
Переваривание белков происходит в желудке и в тонком кишечнике. Оно сводится к ферментативному гидролитическому расщеплению белков пищи до аминокислот. Переваривание белков в желудочно-кишечном тракте имеет ряд особенностей:
· протеолитические ферменты выделяются в неактивном состоянии (защитный механизм от переваривания тканевых белков);
· их активирование происходит в просвете желудочно-кишечного тракта путём частичного протеолиза;
· протеазы желудочно–кишечного тракта отличаются субстратной специфичностью, могут относиться или к эндопептидам, или экзопептидазам.
В желудке основным ферментом, расщепляющим белки, является пепсин. Он выделяется в неактивном состоянии в виде профермента пепсиногена. При участии HCl происходит частичный протеолиз пепсиногена и превращение его в активную форму пепсин. При частичном протеолизе уменьшается молекулярная масса, изменяется структура фермента, обнажается его активный центр.
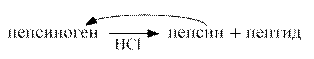
Пепсин относится к эндопептидазам, разрывает в белках внутренние пептидные связи, образованные с участием остатков тирозина и фенилаланина..
Роль HCl в переваривании белков:
· участвует в активации пепсиногена;
· обеспечивает оптимум рН для пепсина (рН = 1-2);
· вызывает частичную денатурацию белка, способствует их набуханию;
· является бактерицидным барьером.
Слизистая желудка имеет целый ряд защитных механизмов от агрессивного действия пепсина и соляной кислоты. К ним относятся:
а) выработка слизи (основной её компонент протеогликаны);
б) выделение пепсина в неактивном состоянии;
У детей процессы переваривания белков в желудке менее активны, чем у взрослых людей, так как снижена активность пепсина и продукция соляной кислоты. У грудных детей в желудке кроме пепсина в переваривании белков участвуют ферменты химозин (фермент, створаживающий молоко), гастриксин (оптимум рН 4-5), катепсины, а также протеазы грудного молока. В желудке происходит частичное переваривание белков до полипептидов.
Дальнейшее переваривание белков осуществляется в тонком кишечнике под действием ферментов поджелудочной железы и собственных ферментов слизистой оболочки кишечника. К ферментам поджелудочной железы относятся трипсин, химотрипсин, эластаза, карбоксипептидазы. Трипсин выделяется поджелудочной железой в неактивном состоянии в виде трипсиногена, который активируется ферментом энтеропептидазой (энтерокиназой), вырабатываемой слизистой кишечника. Активация трипсиногена происходит путём частичного протеолиза с отщеплением 6 аминокислот и освобождением активного центра. В зоне связывания активного центра трипсина преобладают кислые аминокислоты (глютаминовая, аспарагиновая), поэтому трипсин расщепляет в пищевых белках внутренние пептидные связи, образованные щелочными аминокислотами (лизином и аргинином). Трипсин, в свою очередь, активирует в кишечнике другие протеолитические ферменты. Химотрипсин вырабатывается в неактивном состоянии в виде химотрипсиногена, активируется частичным протеолизом трипсином. Химотрипсин относится к эндопептидазам, содержит в активном центре гидрофобные аминокислоты, расщепляет в белках связи, образованные СООН – группами ароматических аминокислот (фенилаланин, тирозин). Эластаза образуется из проэластазы под действием трипсина путём частичного протеолиза. В активном центре эластазы преобладают аминокислоты с разветвлённым радикалом, поэтому она расщепляет в белках внутренние пептидные связи, образованные глицином, не содержащим радикала. Карбоксипептидазы относятся к экзопептидазам, отщепляют от белков концевые аминокислоты. Карбоксипептидазы «А» отщепляют С-концевые ароматические аминокислоты (фенилаланин, тирозин), карбоксипептидазы «В» отщепляют С-концевые аминокислоты лизин и аргинин.
К ферментам кишечника относятся аминопептидазы и дипептидазы. Аминопептидазы – экзопептидазы, отщепляют N-концевые аминокислоты. К аминопептидазам относится, в частности, лейцинаминопептидаза (ЛАП). Дипептидазы кишечника расщепляют дипептиды. В тонком кишечнике происходит полное гидролитическое расщепление пищевых белков до аминокислот, которые не обладают видовой специфичностью. Образовавшиеся аминокислоты подвергаются всасыванию. У детей снижена активность протеолитических ферментов слизистой кишечника и поджелудочной железы.
