Мікробіологічні методи дослідження чутливості мікроорганізмів до антимікробних препаратів
Для визначення чутливості мікроорганізмів до дезинфікуючих препаратів найчастіше використовують методи засновані на явищі дифузії антимікробної речовини в агар, до них належать наступні методи:
паперових дисків,
циліндрів,
лунок в товщі агару,
радіальних штрихів.
Першим етапом для трьох перших методів є виконання посіву тестової культури на щільне поживне середовище однорідним шаром. Дані методи дозволяють проводити оцінку чутливості досліджуваної культури одразу до декількох дезинфікуючих препаратів.
Метод паперових дисків(рис. 47А) полягає у дифузії в агар антибіотиків зі стандартних паперових дисків, які просочені певним дезрозчином в чітко визначеній концентрації. Такі диски встановлюються на щільне поживне середовище з попередньо засіяною культурою рівномірно на відстані від краю чашки Петрі близько 20 мм та на такій же відстані один від одного. В одній чашці можна встановлювати диски з різними препаратами або з різними концентраціями однієї досліджуваної речовини.
Метод циліндрів(рис. 47Г)відрізняється від попереднього тим, що на поживне середовище із засіяною рівномірним «газоном» культурою встановлюють за допомогою пінцета стерильні фарфорові, металеві чи скляні циліндри з дотриманням відстаней наведених у попередньому методі. Далі у встановлені циліндри вносять досліджувані розчини дезрозчинів в кількості 0,1 см3.
Метод лунок в товщі агару(рис. 47В).Після засіву поживного середовища відповідною тест-культурою за допомогою стерильного свердла виконують лунки на відстані 1,5 – 2,0 см від краю чашки. В лунки вносять водні розчини певного дезінфікуючого засобу різної концентрації, або різні засоби.
При виконанні дослідження методом радіальних штрихів (рис. 47Б)у щільному поживному середовищі вирізають воронку чи доріжку по центру або біля краю чашки Петрі в утворену порожнину вносять певну кількість розчину будь-якої антимікробної речовини, дають їй повністю всмоктатися в агар, а далі проводять посіви різних тест-культур штрихом від краю доріжки.
Для оцінки ступеню чутливості мікроорганізмів до антимікробних препаратів при виконанні дослідження будь-яким із наведених методів вимірюють зону затримки росту тестової культури. Відсутність зони затримки росту вказує на те, що досліджувана культура не чутлива до дії даного антимікробного засобу. При діаметрі зони до 15 мм вважають, що мікроорганізми мають малий ступінь чутливості до досліджуваного засобу, діаметр зони від 15 до 25 мм вказує на середній ступінь чутливості. Наявність зони діаметром більше 25 мм свідчить про високий ступінь чутливості мікроорганізмів до даного антимікробного засобу.
За допомогою методів лунок в товщі агару та циліндрів можна перевірити ефективність дезінфікуючої дії антимікробного препарату (АМП) використовуючи в якості тест-культур типові для певного виду виробництва контамінанти.

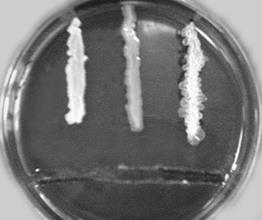
А Б
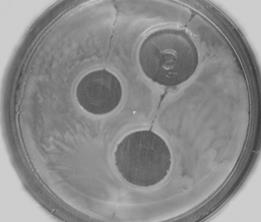

В Г
Рис. 47. Дослідження чутливості мікроорганізмів до антимікробних препаратів методом: А – паперових дисків, Б – радіальних штрихів, В – лунок в товщі агару, Г – циліндрів.
Використовуючи один і той же препарат, але у різних концентраціях користуючись методами паперових дисків, лунок в товщі агару та циліндрів можна також визначити мінімальну інгібуючу концентрацію (МІК) антимікробного засобу. За потреби можна з більшою точністю визначити МІК антимікробних препаратів використовуючи метод Є-тесту.
Є-тест являє собою вузьку смужку полімеру (0,5 x 6,0 см), на яку нанесений градієнт концентрацій антибактеріального препарату (АБП) (від мінімальних до максимальних). Пригнічення росту мікроорганізму довкола смужки Є-тесту відбувається лише в тій зоні, де концентрація АБП, дифундуючого з носія, вища МІК, при цьому утворюється краплевидна зона затримки росту (Рис.48). Значення концентрації АБП в кожній ділянці носія друкарським способом нанесені на зовнішній (зверненій до дослідника) поверхні Є-тесту. Величину МІК враховують в тому місці, де кордон зони затримки росту впритул прилягає до носія.

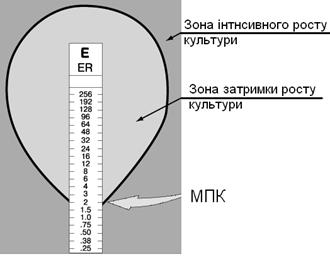
Рис. 48. Визначення МІК антимікробних препаратів методом Є-тесту
Завдання на виконання
1. Визначити вплив різних концентрацій кухонної солі на спороутворювальні і неспороутворювальні бактерії.
2. Визначити вплив різних концентрацій глюкози на дріжджі і плісняві гриби.
3. Провести визначення впливу температури на життєдіяльність культур дріжджів S.cerevisiae
4. Провести дослідження дії антибіотиків ( розчинів деззасобів) на Sarcina flava, Escherichia coli, Bacillus subtilis, Bacillus mesentericus, Candida valida, Rhodotorula glutinis, Rhizopus nigricans, Aspergillus niger, Penicillium chryzogenum, Fusarium culmorum методом паперових дисків чи методом лунок в товщі агару.
5. Провести дослідження дії фітонцидів цибулі і часнику на бактерії (Sarcina flava, Escherichia coli) і міцеліальні гриби (Rhizopus nigricans, Penicillium chryzogenum).
Особливості виконання:
1. Визначення впливу концентрації кухонної солі (NaCl) у середовищі на бактерії
· Виконати посів бактерій у МПБ із 5-, 10- і 20%-ю концентрацією NaCl і без нього (контроль).
· Посів бактерій з бульйонної чистої культури виконувати бактеріологічною петлею, дотримуючись правил асептики. Бактеріологічну петлю перед кожним посівом стерилізувати в полум’ї газового пальника.
· Пробірки з засіяними середовищами зібрати в склянку з етикеткою, яка містить таку інформацію: прізвище студента, номер групи, назву та дату виконання аналізу; підписану склянку з посівами помістити в термостат із температурою 30 ºС.
2. Визначення впливу концентрації глюкози в середовищі на пліснявий гриб ( або дріжджі)
· Виконати посів спор пліснявого гриба (або дріжджів) у пивне сусло з 10-, 20- і 30 %-ю концентрацією глюкози і без неї (контроль).
· Далі дослід проводити за тієї ж послідовності, як описано в попередньоому завданні.
3. Визначення впливу температури на життєдіяльність культур дріжджів S.cerevisiae.
· Виконати посів суспензії дріжджів S.cerevisiae у 3 пробірки пивного сусла з 10-%-ю концентрацією глюкози.
· Посів проводити в тій же послідовності, як перший дослід за тим виключенням, що посіви для культивування встановлюють: першу пробірку - в термостат із температурою 30 ºС, другу - в холодильник з температурою 5 ºС а третю – залишають при кімнатній температурі (близько 20 ºС).
4. Дослідження антибактеріальної дії антибіотиків (розчинів деззасобу).
Чашку Петрі з застиглим МПА перевернути нагору дном і позначити на ньому номери дисків з антибіотиками (за кількістю виданих зразків). У лабораторний зошит занести назви антибіотиків і відповідні їм номери. Потім покласти чашку на стіл кришкою нагору. Дотримуючись правил стерильності, нанести піпеткою на поверхню пластинки агару краплю суспензії бактерій (мікрококи, сарцини чи інші види сапрофітів) ретельно розтерти її по всій поверхні середовища за допомогою стерильного шпателя. Обпаленим пінцетом нанести на поверхню агару диски, просочені антибіотиком (пеніциліном, стрептоміцином, левоміцетином, біоміцином тощо).
Диски розташувати по колу чашки так, як показано на рис. 49. Чашки помістити у термостат при температурі 37°С.
5. Визначення впливу фітонцидів цибулі та часнику на плісняві гриби (або бактерії).
У стерильній фарфоровій ступці розтовкти стерильним товкачиком невелику ріпчасту цибулину або зубчик часнику після зняття з них сухих лушпайок.
На поверхню застиглого сусло-агара (СА) чашки Петрі зробити суцільний посів спор досліджуваного гриба. Для цього відібрати стерильною піпеткою 0,2 см3 суспензії спор гриба, нанести її на поверхню агару, розподілити ретельно й рівномірно по всій поверхні СА стерильним шпателем Дригальського. Після цього у чашку в центр засіяної пластинки СА помістити невелику кількість (біля 1 г) подрібнених у ступці цибулі або часнику.
При проведенні визначення впливу фітонцидів цибулі або часнику на бактерії дослід проводиться так само, але береться інше поживне середовище – МПА.
Чашки помістити в термостат з температурою 25 °С.
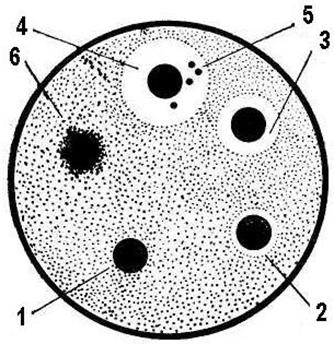
Рис. 49. Визначення антимікробної дії антибіотиків методом паперових дисків:
1 – культура стійка до дії антибіотика на даному диску; 2, 3, 4 – культура чутлива до антибіотика; 5 – колонії стійких особин даного штаму; 6 – колонії антибіотикозалежних клітин
Послідовність проведення дослідів записати у робочих зошитах.
Опрацювання результатів
1. Провести оцінку інтенсивності росту бактерій у поживному середовищі з різним змістом NaCl і без нього ( на наступному занятті). Інтенсивність розвитку бактерій у МПБ із NaCl і без нього оцінити після ретельного перемішування вмісту пробірок за ступенем мутності середовища, користуючись умовними позначеннями:
– (відсутність росту); + (слабкий ріст); ++ (помірний ріст); +++ (рясний ріст). Результати дослідження записати у вигляді таблиці (табл.5.):
Таблиця 5.
| Назва бактерій | Концентрація NaCl, % | |||
| Оцінка росту | ||||
2. Оцінити ріст пліснявого гриба (або дріжджів) на поживному середовищі з різним вмістом глюкози або без неї (на наступному занятті). Вплив концентрації глюкози в поживному середовищі на ріст пліснявого гриба визначити за інтенсивністю розвитку грибниці і спороутворення (звичайно при забарвлені грибниці). Для оцінювання результатів досліду користуватися умовними позначеннями: + (слабкий ріст або спороносіння); ++ (помірний ріст або спороносіння); +++ (рясний ріст або спороносіння).
Інтенсивність розвитку дріжджів встановити за ступенем мутності пивного сусла, порівнючи вміст пробірок після ретельного перемішування, і за числом клітин в 1 см3 сусла. Інтенсивність розвитку дріжджів за мутністю середовища характеризувати вищезазначеними умовними позначеннями.
Визначення кількості клітин дріжджів у середовищі зробити методом прямого підрахунку з використанням лічильної камери (див.п.5.1 лаб.роботи №2). Рахувати клітини дріжджів у пивному суслі без глюкози і з глюкозою при тій її концентрації, де спостерігався мінімальний ріст дріжджів. При великій кількості дріжджових клітин у суслі потрібно попередньо його розбавити стерильною водою у співвідношенні 1:10.
Результати дослідження записати у вигляді таблиці (табл.6.):
Таблиця 6.
| Назва мікроорга-нізмів | Показник інтенсивності розвитку | Концентрація глюкози, % | |||
| Гриб роду | Міцелій Спороносіння | ||||
| Дріжджі | Мутність сусла Кількість клітин в 1 см3 сусла |
3. Оцінити інтенсивність розвитку дріжджів при різній температурі культивування за послідовністю описаною в попередньому аналізі. Результати дослідження записати у робочий зошит.
4. Зробити висновки щодо чутливості мікроорганізмів до різних видів антибіотиків та фітонцидів часнику і цибулі після вимірювання величини наявних зон затримки росту. Для оцінювання чутливості мікроорганізмів користуватись методикою наведеною в пункті 4 загальних відомостей даної лабораторної роботи. Результати оформити у вигляді таблиці (табл.7.).
Таблиця 7.
| Назва тестової культури | Величина (мм) зони затримки росту при дії | Заключення про ступінь чутливості | |||
| пеніциліну | стрептоміцину | левоміцитину | біоміцину | ||
Контрольні запитання
1. Чому для розвитку мікроорганізмів має значення концентрація речовин у поживному середовищі?
2. Як встановлюється вплив концентрації середовища на досліджуваний мікроорганізм?
3. Що таке плазмоліз, плазмоптиз клітини?
4. Чи життєдіяльні плазмолізовані клітини?
5. Як використовується вплив на мікроорганізми концентрації речовин у середовищі при зберіганні харчових продуктів?
6. Що таке осмофільні мікроорганізми?
7. Чим пояснюються розходження в інтенсивності розвитку бактерій у бульйоні з різним вмістом NaCl і без нього при проведені досліду?
8. Чи можна досліджувані бактерії вважати галофітами?
9. Чим пояснюються знайдені в досліді розходження в інтенсивності розвитку пліснявого гриба (або дріжджів) у пивному суслі з різною концентрацією глюкози і без неї?
10. За якими ознаками можливо віднести досліджуваний гриб (чи дріжджі) до осмофілів?
11. Яка природа дії рН середовища на мікроорганізми?
12. В яких межах значень рН розвиваються бактерії, дріжджі, гриби?
13. Наведіть приклади використовування несприятливого впливу на мікроорганізми рН середовища в практиці зберігання харчових продуктів.
14. Як встановлюється вплив температури на досліджуваний мікроорганізм?
15. Яка природа дії низьких і високих температур на мікроорганізми? Як цей фактор використовується у практиці зберігання харчових продуктів?
16. В яких межах температур можливий розвиток плісняви?
17. При якій температурі гинуть міцелій і спори грибів?
18. Які способи зберігання харчових продуктів засновані на використанні низьких і високих температур?
19. Як визначається термостійкість досліджуваних мікроорганізмів?
20. Чи однакова термостійкість вегетативних клітин і спор бактерій?
21. Що таке антисептики? Які види антисептиків дозволено використовувати у харчовій промисловості?
22. Що таке антибіотики? Які методи використовують для якісного та кількісного визначення антибіотичної активності?
23. Чим мікробостатичні речовини відрізняються від мікробоцидних?
24. Що таке фітонциди? Наведіть приклади використання фітонцидів.
ЛАБОРАТОРНА РОБОТА 6
