Сведения о коррозии металлов
Для правильного определения причин разрушения металла, из которого сделан предмет, приостановления и предотвращения этого процесса необходимо знать некоторые основы теории коррозии и защиты металлов. Умение различить виды коррозии необходимо как реставратору для правильной оценки состояния металла при составлении точного описания в реставрационном паспорте и выбора наиболее подходящего метода реставрации, так и хранителю для определения начавшихся изменений и опасности этих изменений для сохранности предметов.
По механизму разрушения различают химическую и электрохимическую коррозию.
Химическая коррозия происходит при контакте металла с сухими газами или воздухом, в жидкостях-не-электролитах, т.е. не проводящих электрический ток. К этому виду коррозии относится, в частности, окисление металлов - образование на поверхности тонкой пленки оксидов, приводящей к пассивности. Электрохимическая коррозия возникает при наличии физико-химической неоднородности поверхности металла или среды в присутствии жидкости, проводящей ток, - электролита. Так как на поверхности металла практически всегда находится пленка влаги, часто тончайшая, практически невидимая, содержащая растворенные соли, которые попадают в нее из атмосферы, с пылью, из почвы, т.е. проводящая ток, а поверхность металла не бывает однородной, то металлические предметы разрушаются вследствие электрохимической коррозии.
При электрохимической коррозии металлов происходит два основных процесса:
1) анодный процесс - переход металла в раствор в виде гидратированных ионов или его окисление; при этом в металле остается соответствующее число электронов;
2) катодный процесс - поглощение появившихся в металле избыточных электронов деполяризаторами, которыми могут быть атомы, молекулы или ионы раствора, подвергающиеся восстановлению на всей поверхности металла или отдельных его участках.
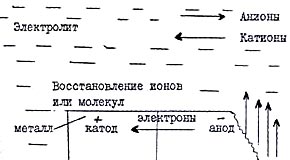
Рис. 1. Схема электрохимического коррозионного процесса
Переход ионов металла в раствор (разрушение)
Пример анодной реакции:
Fe → Fе2+ + 2е окисление железа
В общем виде: Ме → Меn++nе– .
Примеры катодных реакций: 2Н+ + 2е → 2H→ Н2 - восстановление ионов водорода в кислой среде;
2H+ + 2Н2О + 4е → 4ОН- - восстановление растворенного кислорода в нейтральной или щелочной среде.
Таким образом разрушаются анодные участки поверхности. Теоретически для анодной реакции должно было бы наступить равновесие а следовательно, и прекращение разрушения. Практически это равновесие не достигается в силу того, что в ходе коррозии химический состав раствора вблизи металлической поверхности меняется в результате вторичных реакций, например, образования гидроокисей металлов, удаления ионов от поверхности, выделения газов.
Идеальное равновесие и прекращение растворения могли бы быть достигнуты только в случае полной химической и физической однородности как металла, так и электролита, и в случае невозможности побочных реакций ионов металла. Так как такая идеальная однородность недостижима, то практически процесс растворения или коррозия может продолжаться, хотя и очень медленно, до полного разрушения металла.
Таким образом, процесс электрохимической коррозии очень приближенно можно уподобить процессу, происходящему в простом гальваническом элементе. Электродвижущая сила гальванического элемента зависит от активности, проявляемой в реакциях вытеснения металлов друг другом из растворов их солей.
В зависимости от этой активности металлы располагаются в следующий электрохимический ряд напряжений: Li, К, Са, Nа, Mg, Be, Al, Ti, Zr, Mn, Nb, Zn, Cr, Fe, Cd, Co, Ni, Mo, Sn, Рb, Н, Cu, Hg, Pd, Ag, Pt, Аu. Каждый левее стоящий в ряду металл может вытеснять все следующие за ним металлы из растворов их солей, настоящее время не существует способов экспериментального измерения абсолютного значения потенциала металла, поэтому его значение в справочниках приводится относительно, например, водородного электрода сравнения. При контакте разнородных металлов, а такие случаи, в практике достаточно часты, например инкрустация железа медью, серебром или золотом, серебряное покрытие на медном сплаве и др. возникает особый вид электрохимической коррозии - контактная коррозия.
По величинам потенциалов двух металлов в данном электролите можно указать, какой из них будет замедлять коррозию другого, а какой ускорять: металл, имеющий более положительный потенциал, т.е. стоящий правее в ряду напряжений, ускоряет катодный процесс и способствует коррозии металла, с которым находится в паре. В реальных условиях металлы могут покрываться оксидными пленками, что меняет их электрохимическое состояние, и опытные данные могут противоречить теоретическим предсказаниям. При контакте металлов коррозия наиболее интенсивно происходит вблизи места соединения двух разнородных металлов. Контактом разных металлов объясняется быстрое химическое разрушение спаянных изделий именно по месту спайки. Кроме того, на скорость коррозии анодного металла в контактной паре оказывает влияние соотношения анодных и катодных площадей. Например, в случае соединения медных листов стальными заклепками последние за короткое время подвергаются ному разрушению. При обратной картине, когда стальные листы соединены медными заклепками, наблюдается незначительный рост коррозии вблизи медных заклепок. Известно покрытие железа цинком и оловом. Исходя из электрохимического ряда напряжений цинк должен защищать железо, тогда как олово - усиливать коррозию. Оловянное покрытие чисто механически защищает железо и достаточно в одном месте нарушить цельность олова, как , железо начинает разрушаться. Иначе обстоит дело с цинковым покрытием: до тех пор, пока не растворится весь цинк, железе не корродирует. Предотвращают контактную коррозию подбором соответствующих материалов с малой разностью потенциалов, электрической изоляцией различных металлов друг от друга и др. Скорость электрохимической коррозии зависит от внутренних и внешних факторов. К внутренним относятся факторы, связанные с природой металла, его химическим составом, структурой, наличием неметаллических включений. Очень чистые металлы медленно разрушаются. Инородные включения заметно понижают стойкость металлов, двухфазные сплавы корродируют гораздо быстрее, чем однофазные. Коррозия быстрее развивается по напряжённым местам металлических изделий, чем по ненапряженным - более деформированные участки становятся анодами и подвергаются большему разрушению; литой металл разрушается меньше кованого. Тонкая обработка поверхности (шлифовка, полировка), как правило, повышает коррозионную стойкость металлов, облегчая образование на поверхности защитных пленок.
К внешним факторам относятся природа и свойства коррозионной среды и ее параметры.. На скорость электрохимической коррозии влияет концентрация водородных ионов в растворе электролита (т.н. рH среды). Для каждого металла имеется определённое значение рН раствора, при котором скорость коррозии минимальна. Известно, например, что железо пассивно в молочной среде. Значительное влияние оказывает температура, так как она меняет скорость диффузии и растворимость продуктов коррозии.
В зависимости от внешних условий различают атмосферную коррозию и почвенную.
Атмосферной коррозии подвергаются памятники на открытом воздухе, в условиях музейного хранения и экспозиции. Атмосферная коррозия разделяется на три типа, хотя это деление условно, так как в реальных условиях возможен переход одного типа коррозии в другой:
1) "Сухая" коррозия протекает при полном отсутствии следов влаги на поверхности металла. Большинство металлов при взаимодействии с кислородом воздуха или другими окислителями в сухой атмосфере покрываются пленкой оксида. По своему механизму этот процесс является чисто химическим и не приводит к сколько-нибудь существенным разрушениям металла. Толщина плёнок меняется в широких пределах:
а) тонкие (невидимые), толщина которых от нескольких до 400 А;
б) средние (дающие цвета побежалости), толщина которых от 400 до 5000 А;
в) толстые (видимые), толщина которых свыше 5000 А.
В образующихся на металлах пленках при их утолщении могут возникать внутренние напряжения, которые вызывают механическое разрушение пленок с потерей защитных свойств, так как защитными свойствами обладают только сплошные пленки. В двухкомпонентном сплаве окисление начинается с образования оксида - менее благородного компонента сплава, т.е. менее термодинамически устойчивого (например, в низкопробном серебре окисляется медная составляющая сплава).
2) "Влажная" атмосферная коррозия - коррозия при наличии на поверхности металла тончайшей, невидимой пленки влаги, которая образуется в результате конденсации при относительной влажности воздуха ниже 100%. С понятием относительной влажности часто приходится сталкиваться на практике, поэтому напомним, что относительной влажностью называется отношение фактического содержания водяных паров в воздухе к максимально возможному в данных условиях. Средняя относительная влажность в городах составляет 70-80% в отдельные летние месяцы -60-65%. Влажность на этом же уровне держится в музейных залах и запасниках. При таком значении имеются все условия для увлажнения металлической поверхности. Конденсации способствуют перепады температуры. Например, при температуре +25°С и влажности 50% конденсат образуется при охлаждении металла до +14°С если влажность воздуха 90%, то конденсат образуется при перепаде температур в 1°С, т.е. уже при +24°С. Влажность, при которой резко возрастает скорость коррозии называется критической. Критическое значение относительной влажности равно примерно 70%, но при некоторых условиях значительно ниже.
Величина критической влажности меняется в зависимости от состояния поверхности металла и состава атмосферы. Так при наличии в атмосфере сернистого газа или других активных реагентов она может снизиться до 50%.
3) "Мокрая" атмосферная коррозия - коррозия при наличии на поверхности металла видимой пленки влаги. Атмосферная коррозия этого типа наблюдается при относительной влажности воздуха около 100%, когда имеется капельная конденсация влаги на поверхности металла, а также при непосредственном попадании влаги на металл, например, во время дождя.
Конденсация влаги настолько вредный процесс, что металлы, находящиеся под навесом, могут корродировать интенсивнее, чем условиях открытой экспозиции, где дождь быстро смывает кислоты, образовавшиеся на поверхности при конденсации, т.к. влага, конденсирующаяся на поверхности металла вечером при понижении температуры, обладает часто большей кислотностью, чем дождевая вода.
Наиболее агрессивными примесями воздуха являются сернистый газ, хлористый натрий, сероводород, аммиак, пары соляной кислоты. Ускорение коррозии наблюдается при концентрации сернистого газа порядка 10-4 – 10-5 объемн. %. Сернистый газ попадает в атмосферу вместе с продуктами сжигания сернистого топлива, хлористый натрий - за счет соли, уносимой ветром с поверхности океанов и морей. Концентрация хлористого натрия в воздухе меняется в широких пределах и сильно зависит от удаленности от моря. В приморских районах повышенная скорость коррозии объясняется высокой влажностью и наличием в воздухе частичек хлористого натрия. Например, содержание хлор-иона в дожде, снеге, тумане Одессы достигает 440 мг/л. При попадании на поверхность железа хлористого натрия критическое значение относительной влажности задает до 58%.
Влияние углекислого газа неоднозначно. В некоторых случаях его присутствие даже тормозит коррозию. Сильно ускоряет коррозию газообразный хлор. Причем, характерно, что в присутствии этого газа коррозия возрастает и в относительно сухих атмосферах (влажность менее 42%). Сероводород при повышенной влажности также является весьма сильным реагентом. Кроме газов и паров кислот, на процесс коррозии большое влияние оказывают твердые частицы, осаждающиеся на поверхности металла из воздуха. Одни из них (коррозионно-активные) оказывают прямое воздействие на металл, другие, хотя и не отличаются коррозионно-активными свойствами, например, частички угля, приводят к ускорению коррозии благодаря тому, что они способствуют адсорбции на поверхности металла сернистого газа. Вот почему недопустимо отложение пыли и грязи на металлических предметах в музеях. Особенно опасными местами являются поднутрения на высоких рельефах. Известны случаи развития коррозионного процесса на бронзовой скульптуре, стоящей в залах и не защищенной витринами.
Почвенная коррозия. Почвенной коррозии подвергается археологический металл. Сохранность такого металла гораздо xyже, чем предметов, никогда не соприкасавшихся с почвой. Каковы же особенности почвы как коррозионной среды? Наличие влаги и растворенных в ней солей делает почву электролитом и вызывает электрохимическую коррозию металла. Увеличение влажности грунта, затрудняя доступ кислорода, замедляет пассивацию металла. В зависимости от содержания в почвенной влаге растворимых солей грунтовые воды подразделяются на пресные (до0,1%), солоноватые (от 0,1 до 1%), соленые (от 1 до 5%) и рассолы (от 5 до 40%). Большая часть соединений находится в грунтовых водах в виде ионов. Содержание аниона хлора в незасоленных почвах незначительно, благодаря хорошей растворимости и вымываемости его солей. В засоленных почвах количество хлоридов, сульфатов, карбонатов достигает значительной величины. Величина рН изменяется в зависимости от общей минерализации грунтовых вод и присутствия в них кислот, кислых и основных солей. По величине рН различают сильнокислые почвы (3-4,5), кислые (4,5-5,5), слабокислые (5,5-6,5), нейтральные (6,5-7), слабощелочные (7-7,5)-, щелочные (7,5-8,6) и сильно-щелочные (8,5-9). Содержание кислорода, углекислого газа и азота в почвенном и атмосферном воздухе различно. В почвенном воздухе наблюдается более высокое содержание углекислоты (0.1-0.5%) по сравнению с атмосферным (0,03%). Это обусловлено протекающими в почве биохимическими процессами. Содержание кислорода в почве колеблется от 2 до 0,1% (в атмосфере 21%). Почвенный воздух всегда насыщен парами воды. Его относительная влажность обычно около 100%. Коррозионную активность почвы с достаточной точностью характеризует величина электропроводности, которая зависит от влажности, состава и количества солей и структуры. Неоднородность почвы по структуре, плотности, составу, влажности, кислотности и др. приводит к усилению неравномерности коррозии. Коррозионная активность почвы меняется во времени. Кроме того, существуют местные причины, которые влияют на агрессивность - применение удобрений, повышение концентрации вредных газов в атмосфере вблизи индустриальных центров, понижение уровня почвенных вод в результате строительства ирригационных сооружений и др.
Биокоррозия. Микроорганизмы, находящиеся в большом количестве в почвах, могут вызвать ускорение разрушения черных металлов. Особенно активны анаэробные сульфовосстанавливыающие бактерии, которые развиваются в илистых, глинистых и болотных почвах.
Из аэробных бактерий опасны серобактерии, которые в процессе своей жизнедеятельности окисляют сероводород в серу, а затем в серную кислоту. Образующаяся серная кислота вызывает интенсивную коррозию.
Морская коррозия. Морская вода является хорошо аэрированным (8 мг/л 02), нейтральным ( pH 7,2-8,6) электролитом с высокой электропроводностью, обусловленной растворенными солями, главным образом хлоридами и сульфатами натрия, магния, кальция и калия. Общая засоленность морской воды колеблется от I до 4%. В морской воде металлические предметы покрываются слоем растительных и животных организмов. Вместе с кремнекислыми соединениями и углекислым кальцием они дают осадки на металле, которые могут оказывать защитное действие. На предметах, находящихся в зоне периодического смачивания, коррозия протекает с повышенной скоростью за счет облегченного доступа кислорода к поверхности металла.
По характеру коррозионного разрушения различают: 1) сплошную или общую коррозию, и 2) местную коррозию, Сплошная коррозия бывает равномерной, которая протекает с одинаковой скоростью по всей поверхности металла. Равномерной по толщине окисной пленкой покрываются металлические предметы, находящиеся в музейных, условиях, за которыми тщательно ухаживают: на них не скапливается пыль, не попадают агрессивные вещества, например с рук или при уборке помещения. Сплошная коррозия бывает и неравномерной и протекает с неодинаковой скоростью на различных участках поверхности металла. К этому виду коррозии относится разрушение археологического металла. В атмосферных условиях до образования патины коррозия также имеет неравномерный характер.
Местная коррозия приводит к разрушению отдельных участков поверхности металлического предмета. Коррозия может иметь вид тёмных пятен, точек (питтингов), язв в виде раковин. Это наиболее часто встречающиеся повреждения музейного металла. К этому виду разрушения относятся случаи "бронзовой болезни", которые будут подробно рассмотрены в разделе "Разрушение медных сплавов". К местной коррозии относится также межкристаллическая коррозия - разрушение по границам кристаллитов (этот вид коррозии опасен тем, что, не меняя внешнего вида, металл теряет прочность и пластичность), сквозная коррозия, коррозионное растрескивание - разрушение металла при одновременном воздействии коррозионной среды и внешних или внутренних механических напряжений.
При соприкосновении с предметом не защищенных перчатками рук происходит взаимодействие металла с потом. Нередки случаи образования на поверхности музейного экспоната коррозионного пятна, воспроизводящего отпечаток пальца.
Пот содержит кроме воды (98-99% по массе) молочную кислоту, мочевину, хлорид натрия, что определяет его агрессивность.
