Теория кислот и оснований. Водородный показатель. Значение рН.
1. А) Кислота - это, частица, способная выступать в роли донора-протона (Н+).
Б) Протолиты (кислоты и основания) могут быть нейтральными или молеку-
лярными, катионными и анионными:
| Молекулярные или нейтральные | Катионные | Анионные | |
| НС1 ( | nh4 | hso4- | |
| Кислоты | H2SO4 | НO3+ | H2ро4 - |
| н3ро4 | [Zn(h20)]2+ | ||
| н2о | [Cu(h20)]2+ | нсо3- |
2. Основание - это частица, способная принять протон (Н+), быть акцептором протона (Н+) в данной реакции.
Протолиты (кислоты и основания) могут быть нейтральными или молеку-
лярными, катионными и анионными: Таблица №6
| Молекулярные или нейтральные | Катионные | Анионные | |
| Основания | nh3 н2о с2н5он | [Zn(oh)(h20)j+ [Cu(oh)(h20)j+ | s2-, со32-, С1-, Н2ро4-, СН3соо- 4 5 3 5 он-, нсо3- |
3.

4.
а) HPO42  + H3O
+ H3O 
 H2PO4
H2PO4  + H2O
+ H2O
б) HPO42  + OH
+ OH 
 PO43
PO43  + H2O
+ H2O
5.



Значение постоянства pH биосред:
· Ионы H – катализаторы биохимических процессов
· Ферменты и гормоны биологически активны только в определенном интервале pH
· Ионы H влияют на осмотическое давление клетки
6. К протолитическим реакциям относят реакции нейтрализации, гидролиза, ионизации (диссоциации) кислот и оснований.
Реакцией нейтрализацииназывается протолитическое взаимодействие кислоты и основания, в результате которого образуется соль и вода:
НС1 + NaOH = NaCl + Н20
Реакции ионизации (диссоциации):
сн3соон+н2о = н3о++сн3соо-
кис. осн. сопр. кис. сопр. осн.
7. а) гидролиз по аниону:
CH3COONa + НОН = СН3СООН + NaOH
сн3соо-+ НОН = сн3соон+ он-
осн. кис. сопр. кис. сопр. осн.
б) гидролиз по катиону:
NH4C1 + НОН = NH4OH + НС1
NH4 + НОН = NH4ОН + Н+
Кис. Осн. Сопр.осн сопр.кис
Гидролитические процессы вместе с процессами растворения играют важную роль в обмене веществ. С ними связано поддержание на определенном уровне кислотности крови и других физиологических жидкостей.
8. Допишите уравнения протолитических реакций:
а) СН3СОО- + Н2О→СН3СООH + OH- (гидролиз по аниону)
осн. Кисл. С.к. с.о.
б) НСО3- + 〖ОН〗^- →H2O + CO3- (реакция нейтрализации)
кисл. Осн. С.к. с.о
9.
нсо3-+ н2о =н2со3+ он-
осн. кис. с. к. с.o .
HCO3 + H2O = СО3 + H3O+
Кисл. Осн. С.о. с.к.
10. Общая кислотность –это сумма концентраций всех катионов H+ (свободных и связанных), находящихся в растворе. Общая кислотность равна сумме молярных концентраций эквивалентов всех кислот, находящихся в растворе:

Активная кислотность –это концентрация свободных ионов Н+, имеющихся в растворе при данных условиях. Мерой активной кислотности является значение pH раствора:
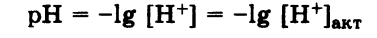

Потенциальная кислотность -это концентрация ионов Н+, связанных в молекулы или ионы слабых кислот, имеющихся в растворе.

11. . Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары. Это, например, ионы водорода — протоны, ионы металлов (Ag+, Fe3+), оксиды некоторых неметаллов (например, SO3, SiO2), ряд солей (AlCl3), а также такие вещества как BF3, Al2O3. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонные кислоты рассматриваются как частный случай класса кислот.
Основание Льюиса — это молекула или ион, способные быть донором электронных пар: все анионы, аммиак и амины, вода, спирты, галогены.
Принцип ЖМКО касается взаимодействий, рассматриваемых в теории кислот и оснований Льюиса. Эффективность взаимодействия кислоты и основания Льюиса зависит от их химического состава и электронного строения.
Согласно Пирсону, жёсткие кислоты — это акцепторы электронной пары, обладающие малым размером, большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. Жёсткие основания — это доноры с аналогичными свойствами (с большим отрицательным зарядом, большой электроотрицательностью и низкой поляризуемостью). Мягкие кислоты — это кислоты Льюиса с малым положительным зарядом, большим размером, низкой электроотрицательностью и высокой поляризуемостью. Мягкие основания — это основания Льюиса с теми же свойствами. Жёсткость кислоты или основания означает его склонность образовывать связи преимущественно ионного характера, а мягкость кислоты или основания — склонность к образованию связей ковалентного характера.
12. На основании справочных данных рКа(NH4+) = 9,62, рКа (СН3СОН) =16, рКа(НСООН)=3,7, определите, чем будут являться по отношению к NH3 метанол и муравьиная кислота. Допишите уравнение протолитической реакции:
NH3+ НСООН→ … +… Укажите сопряженные кислотно- основные пары.
Чем меньше pKa, тем сильнее кислота и слабее сопряженное ей основание.
Т.к. рКа(NH4+) = 9,62, иона аммония – слабая кислота, поэтому аммиак (с.о.) является сильным основанием.
рКа(NH4+) < рКа (СН3СОН), СН3СОН по отношению к NH3 – основание
рКа(NH4+) > рКа(НСООН), НСООН по отношнию к NH3 – кислота
NH3+ НСООН→ NH4 + HCOO-
О. к. с.к. с.о.
13. Объясните с точки зрения теории Льюиса следующие кислотно- основные взаимодействия: NH3 + H+ → [ NH4+ ]; BF3 + F- → [BF3]-. Что называется кислотой и основанием согласно теории Льюиса?
Кислота Льюиса — молекула или ион, имеющие вакантные электронные орбитали, вследствие чего они способны принимать электронные пары.
Основание Льюиса — это молекула или ион, способные быть донором электронных пар
В реакции
NH3 + H+ → [ NH4+ ]
Ион H+ способен принять электронную пару от NH3, следовательно H+ - кислота Льюиса, аммиак – основание Льюиса.
BF3 + F- → [BF4]-
BF3 способен принять электронную пару от F-: BF3 – кислота Льюиса, F- - основание Льюиса.
