Тема 7. ПОЛЕЗНЫЕ МИКРООРГАНИЗМЫ
Занятие И.Методы изучения антагонизма у микроорганизмов
План
1. Выявление антагонизма у микробов.
2. Выделение микробов-антагонистов из почвы.
3. Определение активности антибиотиков.
Материалы и оборудование
1. Микроскопы с иммерсионной системой.
2. Чашки Петри.
3. Пипетки.
4. Стеклянные трубки диаметром 0,5 - 0,6 мм.
5. Микробиологические петли.
6. Предметные и покровные стекла.
7. Фильтровальная бумага.
8. Различные образцы свежей почвы.
9. Мясопептонный агар.
10. Стерильная вода.
11. Чистые культуры бактерий Bacillus mycoides, Вас. mesentericus и Sarcina lutea.
12. Пенициллин или другой антибиотик.
Основные сведения
В естественных условиях обитания микроорганизмы существуют не изолированно друг от друга, а образуют сложные сообщества (микробоце- нозы), в которых находятся в различных взаимоотношениях. Одним из широко распространенных типов взаимоотношений микроорганизмов является антагонизм, или антагонистические взаимоотношения, при которых один микроорганизм оказывает отрицательное воздействие на другой, задерживая его рост или вызывая полную гибель. Достаточно развести небольшое количество почвы в воде и посеять почвенную разводку на поверхность питательного агара в чашке Петри, как там разовьется несколько колоний антагонистов, не допускающих роста окружающих микроорганизмов и поэтому образующих вокруг себя светлые зоны агара, свободного от микроорганизмов.
Антагонистическое действие вызывается большей частью тем, что один организм выделяет в окружающую среду продукты своей жизнедеятельности, оказывающие тормозящее влияние на развитие другого организма вплоть до его гибели. Такие вещества различной химической природы, образующиеся в процессе жизнедеятельности микроорганизмов и обладающие способностью отрицательно воздействовать на другие микроорганизмы, получили название антибиотиков, или антибиотических веществ.
Химическая природа этих веществ различна, но все они обладают антибактериальным действием различного характера. Одни подавляют развитие бактерий (бактериостатическое действие), другие вызывают их полную гибель (бактерицидное действие), а третьи способны растворять клетки бактерий (бактериолитическое действие). Характерной особенностью антибиотиков является резко выраженная избирательность их по отношению к различным бактериям. Каждый антибиотик действует на определенные бактерии - только грамположительные или грамотрицательные.
Продуцентами антибиотических веществ являются многие растительные и животные организмы, но наибольшее значение имеют микроорганизмы: бактерии, актиномицеты и грибы. Микроорганизмы-антагонисты широко распространены в природе, главным образом в почве, богатой органическими веществами, откуда были выделены наиболее активные из них (например, Actinomyces globisporus - продуцент стрептомицина). В настоящее время многие антибиотики получены в чистом виде и находят широкое применение как в медицине и ветеринарии для лечения человека и животных, так и в фитопатологии в борьбе с грибными и бактериальньми болезнями культурных растений.
При изучении явления антагонизма и действия антибиотиков, выявлении антагонистических взаимоотношений микроорганизмов, выделении из почвы микробов-антагонистов для определения их антибиотической активности против бактерий разработаны различные микробиологические методы разной сложности. С некоторыми наиболее простыми из них следует ознакомить будущих биологов и специалистов сельского хозяйства.
Ход работы
Поставить опыты и изучить явление антагонистических взаимоотношений микроорганизмов, ознакомиться с методикой выделения микро- бов-антагонистов и определения активности антибиотика по отношению к бактериям - задача настоящей работы.
Опыт по выявлению антагонистических взаимоотношений. Антагонистические взаимоотношения микроорганизмов можно выявить путем посева на твердой питательной среде нескольких видов микроорганизмов- антагонистов.
В чашку Петри выливают расплавленный мясопептонный или бобо- вопептонный агар, который через несколько минут затвердевает в виде ровной пластинки. Затем на поверхность твердого питательного агара производят посев разных бактерий в двух направлениях. Например, посредине чашки делается посев широкой полосой Bacillus mesentericus, а перпендикулярно к ней подсевают параллельными штрихами чистую культуру Вас. mycoides и Sarcina lutea. Засеянные чашки помещают в термостат при температуре 26...28°С и через сутки или двое производят учет результатов опыта. При этом следует обратить внимание на различие в интенсивности роста микробов в местах их соприкосновения на питательной среде. Если в этих местах рост слабый или его совсем нет, то это свидетельствует о налинии антагонизма между микроорганизмами и об угнетающем действии одного из них на другой. Угнетающее действие микробов-антагонистов может сказываться не только в задержке роста, но иногда и в изменении формы клетки, в чем можно убедиться, сравнивая препараты, приготовленные из зон нормального и угнетенного роста.
Опыт по выделению микробов-антагонистов из почвы. При выделении антагонистов из почвы или других естественных источников применяются различные методы, из которых наиболее простым является метод прямого посева почвы.
Питательный мясопептонный или бобовопептонный агар разогревают, выливают в чашки Петри и равномерно распределяют по дну. Когда агар затвердеет, производят посев бактериями или грибами, по отношению к которым желают выделить антагонистов. Для этого петлей или пипеткой наносят каплю посевного материала и равномерно распределяют его по поверхности питательной среды стерильным стеклянным шпателем. Чашку Петри с посевом помещают в термостат при температуре 25-30°С на2 суток. После этого на выросший бактериальный или грибной налет раскладывают мелкие кусочки свежей почвы. Если в почве содержатся микробы-антагонисты, то они в процессе своего развития будут тормозить рост или вызывать гибель (лизис) бактерий или грибов, а вокруг комков почвы появятся светлые участки их лизиса. Из литических участков в дальнейшем производят выделение чистых культур антагонистов.
Определение активности антибиотиков. Для доказательства антибиотической активности и избирательности действия антибиотиков на микроорганизмы можно поставить такой опыт (опыт А. Флеминга). В чашке Петри с застывшим питательным агаром делают желобок, который заполняют пенициллином или культуральной жидкостью какого-либо другого антагониста. После этого производят посев культур различных бактерий в виде полосок, расположенных перпендикулярно к желобку. Раствор антибиотика диффундирует из желобка в окружающий питательный агар и препятствует росту бактерий в каждой из полосок. При этом ближайшая к желобку часть полоски каждого микроба остается прозрачной, и рост микробов начинается лишь на некотором расстоянии. Величина этой прозрачной части полоски может служить мерой активности антибиотика. Этот же опыт свидетельствует о том, что действие антибиотиков на микроорганизмы избирательно и чувствительность их неодинакова.
Более точное определение концентрации антибиотика и содержания его в жидкости может быть осуществлено чашечным методом с цилиндриками, основанным на диффузии антибиотика в окружающую питательную среду и поэтому иногда называемым методом диффузии. Сущность его состоит в следующем. В расплавленный и охлажденный до 45°С мясопептонный или бобовопептонный агар вносят петлю культуры сарцины (Sarcina lutea), содержимое пробирки тщательно перемешивают и выливают в чашку Петри. После того, как агар застынет, берут короткие (длиной около 1 см) стеклянные цилиндрики с внутренним диаметром 5-6 мм и устанавливают их на агаре на равном расстоянии друг от друга. Для удобства погружения цилиндриков в агар их с одного конца немного нагревают на спиртовке или горелке. Одновременно готовят различные разведения пенициллина (1:1000; 1:10000; 1:50000), вносят их в открытые цилиндрики и чашку Петри, помещают в термостат. Пенициллин диффундирует из цилиндриков в окружающий агар и препятствует росту бактерий на поверхности агара. Вокруг каждого цилиндрика образуется светлая (стерильная) зона, в которой не наблюдается роста бактерий. Скорость проникновения антибиотика и активность его действия на бактерии пропорциональна концентрации антибиотика в цилиндриках, т. е. чем крепче раствор пенициллина, тем больше диаметр стерильной зоны.
Сравнивая величину зон, полученных с раствором антибиотика неизвестной концентрации, с величиной зон со стандартным раствором того же антибиотика, определяют приближенное содержание последнего в исследуемой жидкости.
Контрольные вопросы
1. Что такое антагонизм микроорганизмов?
2. Какие типы антагонизма микробов вы знаете?
3. Как выявить антагонизм микробов?
4. Как выделить микробы-антагонисты из почвы?
5. Как определить активность антибиотиков?
6. Каково практическое значение антагонизма микробов?
Занятие 12. Микробиологический метод защиты растений.
План
1. Микроскопическое исследование бактериальных препаратов энто- бактерина, битоксибациллина, лепидоцида.
2. Микроскопическое исследование бактериального препарата бак- токумарина.
1. Материалы и оборудование
3. Бактериальные препараты Вас. thuringiensis (энтобактерин, би- токсибациллин, лепидоцид), Salmonella decumanicidum (бактокумарин).
4. Грибной препарат Beauveria bassiana (боверин).
5. Краситель карболовый фуксин.
6. Предметные стекла.
7. Микробиологические петли.
8. Микроскопы.
9. Спиртовки.
10. Лотки.
Основные сведения
Первые научные эксперименты по использованию микроорганизмов для борьбы с вредными насекомыми были проведены И.И. Мечниковым, который открыл возбудителей грибных и бактериальных болезней хлебного жука в начале 80-х годов 19 века.
В настоящее время открыты и изучены многие виды бактерий, грибов и вирусов, на основе которых разработаны и производятся препараты для биологической защиты растений от болезней, вредителей и мышевидных грызунов.
Против возбудителей болезней используются грибы-паразиты второго порядка (сверхпаразиты):
-против ржавчинных грибов - грибы родов Darluca и Tuberculina;
-против мучнисторосяных грибов - род Cicinobolus;
-против возбудителей болезни увядания растений (Verticillium, Fusarium) - род Trichoderma.
В борьбе с вредными насекомыми используются вирусы, бактерии, энтомофторовые и энтомофильные грибы.
Вирусы ядерного и цитоплазматического полиэдрозов, а также гра- нулеза обнаружены у 200 видов насекомых-вредителей. Они только изучаются в экспериментах, препараты для использования в производстве еще не разработаны.
 Бактерии выделены из погибших насекомых, они вызывают инфекционные болезни у жуков (Вас. popilliae), огневок, шелкопрядов, кукурузного мотылька, яблоневой плодожорки (Вас. cereus). Наиболее широкий спектр действия у бактерий Вас. thuringiensis. Этот вид имеет несколько разновидностей, на основе которых разработаны и производятся в промышленных масштабах биопрепараты. Это бактерия, образующая кристаллы (эндотоксин) и три экзотоксина нуклеотидной и ферментной природы.
Бактерии выделены из погибших насекомых, они вызывают инфекционные болезни у жуков (Вас. popilliae), огневок, шелкопрядов, кукурузного мотылька, яблоневой плодожорки (Вас. cereus). Наиболее широкий спектр действия у бактерий Вас. thuringiensis. Этот вид имеет несколько разновидностей, на основе которых разработаны и производятся в промышленных масштабах биопрепараты. Это бактерия, образующая кристаллы (эндотоксин) и три экзотоксина нуклеотидной и ферментной природы.
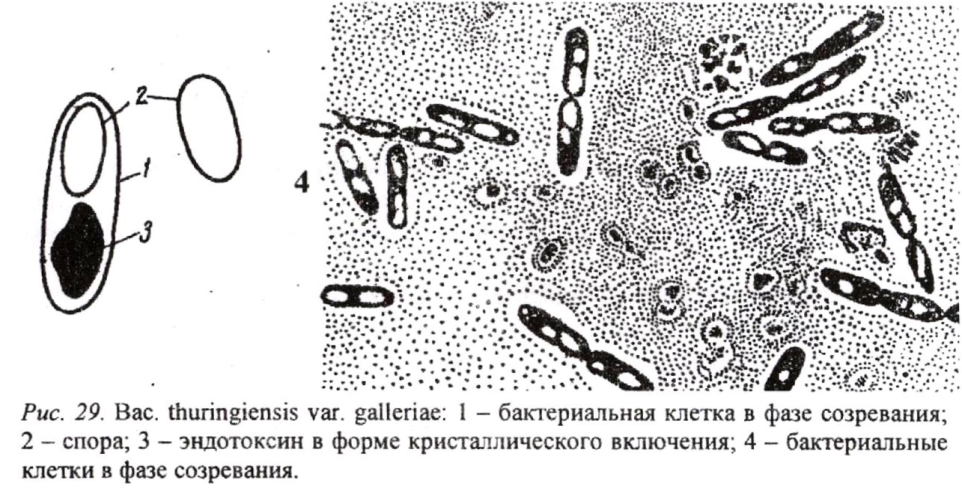
Энтобактерин - препарат на основе Вас. thuringiensis var. galleriae (рис. 29). Эффективен против 50 видов листогрызущих вредителей овощных, плодовых, садово-парковых и лесных насаждений.
Дендробациллин - препарат на основе Вас. thuringiensis var. dendro- limus. Эффективен против огневок, пядениц, златогузки, капустной моли и белянки, ряда вредных чешуекрылых - вредителей сада.
 Битоксибациллин - препарат Вас. thuringiensis var.alesti - против колорадского жука, боярышницы, кольчатого шелкопряда и др.
Битоксибациллин - препарат Вас. thuringiensis var.alesti - против колорадского жука, боярышницы, кольчатого шелкопряда и др.
Грибы относятся к группе энтомопатогенных, т.е. вызывающих инфекционные болезни насекомых. Наиболее изучены следующие. Энтомофторовые грибы класса Zygomycetes, представители 3 родов: Entomophthora, Massaspora, Tarichium. Они поражают различные виды насекомых, некоторые виды клещей и пауков.
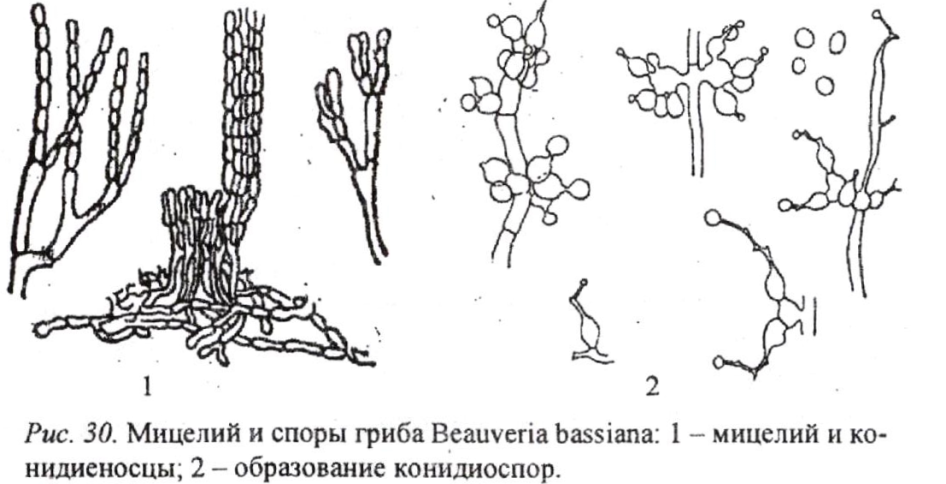
Порядок гифомицеты класса Deuteromycetes включает как фитопатогенные виды (род Monilia), так и энтомопатогенные. К последним относят представителей родов Cephalosporium, Aspergillus, Paecilomyces и Beauveria. К последнему роду относится Beauveria bassiana (рис. 30) - наиболее изученный вид, вызывающий болезнь мюскардину, на основе которого разработан и широко применяется в производстве препарат боверин, поражающий 60 видов насекомых и ряд клещей, в том числе таких, как клоп-черепашка, колорадский жук, свекловичный долгоносик, яблонная моль и плодожорка, луговой и кукурузный мотыльки, совки и др.
Для борьбы с мышевидными грызунами используются бактерии рода Salmonella, вызывающие брюшной тиф у мышей, крыс, полевок и др. Наиболее изученными являются S. typhi spermophilorum (бактерия Мережковского), S. decumanicidum (бактерия Исаченко), S. typhimurida rodentia (бактерия №5170 Прохорова), S. Danysz (бактерия Данича), а также бактерии №295 и ВК2С.
Разработаны и применяются в производстве препараты бактороден- цид (на основе бактерии Мережковского) и бактокумарин (бактерии №5170 Прохорова).
Ход работы
Приготовить фиксированный препарат имеющихся в наличии биологических средств защиты растений (энтобактерин, дендробациллин, биток- сибациллин, боверин, бактокумарин и др.). Обнаружить споры бактерий и грибов, наполнитель (тальк), зарисовать.
Контрольные вопросы
1. Экологическая роль биологического метода защиты растений.
2. Краткая история разработки биометода.
3. Охарактеризовать основные виды бактерий, грибов и вирусов, применяемых в борьбе с вредными насекомыми.
4. Охарактеризовать микробиологический метод борьбы с болезнями сельскохозяйственных растений.
5. Охарактеризовать микробиологический метод борьбы с мышевидными грызунами.
Тема 8. ОСНОВЫ ИММУНОЛОГИИЗанятие 13.Изучение некоторых иммунологических реакций
План
1. Произвести дифференциацию фитопатогенных бактерий постановкой пластинчатой (капельной) реакции агглютинации на стекле.
2. Поставить капельную реакцию агглютинации с соком, полученным из листьев больного растения или клубня картофеля.
3. Поставить реакцию преципитации из диализированных белков растений.
Материалы и оборудование
1. Свежие листья растений, зараженных вирусом.
2. Клубни картофеля, зараженного вирусом X.
3. Соковыжималка или пинцет Пиана.
4. Стерильные салфетки, смоченные физиологическим раствором (в чашках Петри).
5. Предметные стекла.
6. Иммунная и нормальная сыворотки.
7. Физиологический раствор в пробирках.
8. Преципитационные пробирки.
9. Раствор диализованных белков растения.
10. Взвесь фитопатогенных бактерий в физиологическом растворе (3 культуры).
Основные сведения
Иммунитет - это совокупность защитных механизмов, обеспечивающих сохранение постоянства внутренней среды и функций макроорганизма при вторжении и распространении болезнетворных микроорганизмов, их токсинов или других чужеродных тел белковой природы.
Еще в древности было известно, что люди, перенесшие ту или иную инфекционную болезнь, в течение определенного времени оказываются невосприимчивыми к повторному заражению теми же бактериями или вирусами. Организм приобретает активную специфическую устойчивость к данной инфекции. Это происходит благодаря появлению в переболевшем организме специфических антител против данного возбудителя заболевания.
Впоследствии было выявлено, что антитела накапливаются в организме и при искусственном введении в него ослабленных или убитых возбудителей инфекционных заболеваний или продуктов их жизнедеятельности.
Антитела представляют собой белки, принадлежащие к группе у-глобулинов. По своей химической структуре и свойствам они идентичны «нормальным» у-глобулинам сыворотки крови. Происхождение антител и механизм их образования - одна из самых трудных проблем в иммунологии. До сих пор не найдено ее удовлетворительного решения. Считают, что антитела образуются в фагоцитирующих клетках ретикуло-эндотели- альной системы (РЭС), к которым относится большинство клеток селезенки, лимфатических узлов и костного мозга, клетки эндотелия печени, легких, кожи и других органов.
Специфические антитела образуются и накапливаются в результате раздражения клеток лимфоидной ткани РЭС антигенами, естественно проникшими (при заболевании) или искусственно введенными (при иммунизации) в организм. Накапливаясь в организме, они защищают его от возбудителя инфекции и ликвидируют болезнетворное начало.
Антигенами называют такие вещества, которые при парэнтеральном введении (минуя желудочно-кишечный тракт) в организм животного или человека вызывают образование специфических антител. Антигенами могут быть как возбудители инфекционных заболеваний или продукты их жизнедеятельности, так и совершенно безвредные вещества, чаще всего белковой или полисахаридной природы. Вне организма (в пробирке) антитела способны вступать в реакцию специфического взаимодействия с антигенами и вызывать их осаждение - преципитацию, склеивание - агглютинацию, растворение - лизис или нейтрализацию токсинов.
Все реакции взаимодействия «антиген - антитело» основаны на соединении антигена с гомологичным специфическим антителом. В качестве источника антител используют сыворотку крови многократно иммунизированных (гипериммунизированных) животных, чаще всего кроликов. Сыворотки крови, содержащие специфические антитела, называются иммунными. Способность к специфическому взаимодействию между антителом
и антигеном используется в лабораторной практике для диагностики инфекционных заболеваний людей, животных и растений. Чаще всего для этих целей используют реакции преципитации и агглютинации.
Реакция преципитации заключается в изменении дисперсности коллоидов антигена (растворимого белка) и их осаждении под влиянием специфических антител, находящихся в иммунной сыворотке. Коллоидные частицы, образующиеся в результате взаимодействия антител с соответствующим антигеном, обычно электрически нейтральны и соединяются в крупные конгломераты. В результате этого коллоид становится нестойким и в пробирке появляется видимый невооруженным глазом
непрозрачный беловато-матовый осадок (рис. 31).
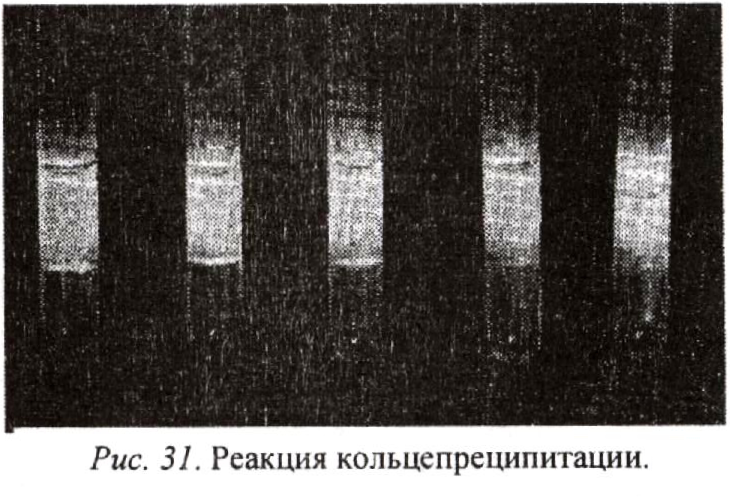
Реакция исключительно специфична и чувствительна. С ее помощью можно уловить минимальное количество белка и даже его следы, далеко не всегда определяемые химическими методами. Кроме того, эта реакция позволяет определить природу белка.
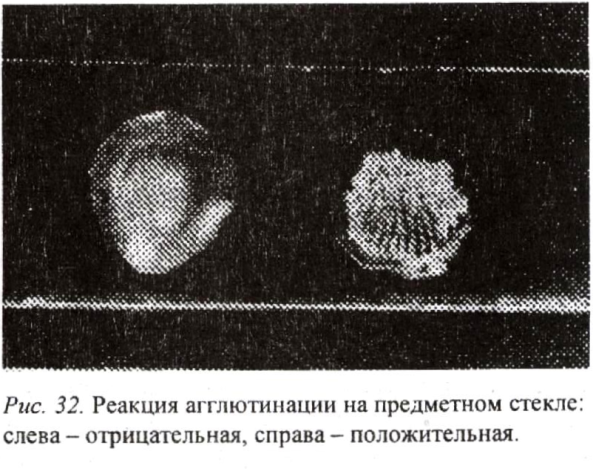
Реакция агглютинации. Агглютинацией называется склеивание микробных клеток под влиянием антител - агглютининов, содержащихся в сыворотке крови, и образование хлопьев или комков. Это очень специфическая реакция. В организме животного агглютинация не всегда вызывает гибель микробов. Однако, собирая их группами, облегчает лейкоцитам «охоту» на них. Лейкоцитам и другим фагоцитирующим клеткам во много раз легче захватить склеенные вместе бактерии, чем фагоцитировать их по отдельности. Кроме того, агглютинины, по-видимому, вызывают оп- сонизацию (подготовку к перевариванию) поверхности бактерий, что облегчает фагоцитоз.
Реакция агглютинации применяется в тех же целях, что и реакция преципитации. По технике постановки различают несколько разновидностей реакции агглютинации: пробирочную, пластинчатую, капельную (рис. 32).
Иммунологические реакции высоко чувствительны и специфичны. Однако специфичность их не абсолютна, так как существуют групповые реакции, зависящие от способности различных, но близких по своему химическому составу антигенов вступать в реакцию с одной и той же иммунной сывороткой.
Все иммунологические реакции протекают только в присутствии электролитов, например 0,85-процентного раствора хлористого натрия. Различают две фазы в течении иммунологических реакций:
1. специфическая фаза, когда антитело адсорбируется на поверхности антигена. Эта фаза протекает при повышенной температуре, но остается невидимой, так как внешнего эффекта не дает; 2) неспецифическая фаза, которая протекает аналогично коллоидным процессам: происходит растворение, склеивание или осаждение антигена. Протекает она медленно и лучше всего выявляется через 12-18ч. при температуре 4-6°С. В зависимости от внешнего проявления процесса взаимодействия антител с антигеном можно увидеть невооруженным глазом осаждение антигена, выпадение его в осадок или лизис клеток.
Иммунологические реакции применяют с двумя целями:
а) для выявления антител в сыворотке больного при помощи реакции с заведомо известным антигеном (диагностикум);
б) для обнаружения в исследуемом материале специфического антигена при помощи реакции с заведомо известной иммунной сывороткой.
Вследствие более простой организации у растений (по сравнению с животными) процессы развития инфекции и механизм устойчивости (иммунитета) у них проще, чем у животных и человека. Врачи обычно говорят о врожденном и приобретенном (в результате перенесенного заболевания или вакцинации) иммунитете. Напряженность приобретенного иммунитета обычно очень высокая и обусловлена накоплением антител.
Совершенно иное положение отмечается в растительном мире. Здесь также имеет место явление естественной (врожденной) невосприимчивости, проявляющейся на довольно высоком уровне. У растений наблюдается также и приобретенная невосприимчивость к возбудителям инфекций. Но случаи приобретенного иммунитета у растений более редки, чем у животных, а главное - приобретенная невосприимчивость у растений ничего общего не имеет с иммунитетом животных, она проявляется лишь в течение короткого срока и только на участках, близко соприкасающихся с местом иммунизации. Поэтому для защиты растений от болезней практическое значение имеет не искусственно приобретенный иммунитет, а присущий растительным тканям врожденный естественный иммунитет. Он вырабатывается в ходе длительной эволюции или же создается в результате селекции.
Естественный иммунитет растений основан на способности живой клетки синтезировать в ответ на инфекцию защитные вещества. Эти вещества называют по-разному: фитоалексинами, фитонцидами, антибиотическими или фунгитоксическими соединениями. Химическая природа и механизм действия этих веществ еще недостаточно изучены. В отличие от антител, все защитные вещества, которые удалось выделить из растений, оказались небелковой природы. Они принадлежат к сложным циклическим соединениям и не имеют ничего общего с антителами животных.
Все микроорганизмы-возбудители болезней растений (вирусы, бактерии, грибы) представляют собой полноценные антигены. При иммунизации ими животных удается получить иммунные сыворотки, содержащие специфические антитела. В настоящее время получены сыворотки ко многим грибам, бактериям и особенно вирусам, вызывающим инфекционные заболевания растений. Такие сыворотки широко используются в фитопатологии, селекции и семеноводстве. Они применяются для ранней диагностики грибковых, бактериальных и вирусных заболеваний растений, в целях дифференциальной диагностики возбудителей, вызывающих сходные симптомы заболеваний, для отбора здоровых, устойчивых к заболеванию растений при селекционной работе и для определения устойчивости растений к заболеваниям.
Все эти многочисленные задачи решаются проведением различных серологических реакций между антителами сывороток и антигенами. В качестве антигенов при постановке реакций используют или чистые культуры возбудителей заболеваний, или сок растений, подозреваемых в заболевании, или диализированные белки растительных тканей. В работе с растениями чаще всего применяются реакции преципитации и реакции агглютинации.
Ход работы
Методические указания. Для дифференциации фитопатогенных бактерий по реакции агглютинации студентам выдаются разведенные нормальная и иммунная сыворотки, специфичные к одному из возбудителей бактериоза растений. В качестве антигена выдают три пробирки со взвесью фитопатогенных бактерий в физиологическом растворе. В одной из пробирок находится возбудитель, на который получена иммунная сыворотка. Пробирки с сыворотками и культурами нумеруются.
Техника постановки капельной реакции агглютинации. На три предметных стекла наносят пастеровской пипеткой по капле иммунной сыворотки. Капли наносят ближе к одному из концов стекла. На второй конец стекла из пастеровской пипетки капают каплю нормальной сыворотки. Стекла с каплями нумеруют. Пастеровской пипеткой набирают взвесь фитопатогенных бактерий из пробирки и капают по 1 капле в нормальную и иммунную сыворотки. Номер вносимой культуры должен соответствовать номеру предметного стекла с сывороткой. Сыворотки и внесенную взвесь бактерий хорошо перемешивают бактериологической петлей или, проще, углом чистого предметного стекла. Наблюдения ведут в течение 5-10 мин.
При совпадении антигена и антитела в капле смеси (сыворотка + антиген) через несколько минут появляются зернышки или хлопья, жидкость в капле светлеет. Следовательно, реакция положительная. Если внесенный антиген не соответствует содержащимся в сыворотке антителам, то капля остается равномерно мутной, как в каплях с нормальной сывороткой.
Для постановки диагноза на вирусное заболевание вегетирующего растения ставят капельную агглютинацию с его соком.
Антиген получают из листьев свежего растения или из клубней проросшего картофеля. Для этого свежие листья сворачивают плотным жгутом, а картофель нарезают мелкими кусочками и заворачивают в стерильную салфетку из трех слоев марли. Салфетку перед употреблением смачивают стерильным физиологическим раствором и слегка отжимают. Салфетку с листьями или картофелем перекручивают и сдавливают пинцетом Пиана или соковыжималкой. Появившийся сок собирают в пробирку или наносят в виде капли на предметное стекло. К капле сока на предметном стекле добавляют каплю иммунной сыворотки, содержащей антитела к предполагаемому возбудителю болезни. Углом предметного стекла хорошо перемешивают капли. Если в соке растения содержится антиген, соответствующий антителам сыворотки, то в капле появляются хлопья, а жидкость светлеет. В капле с нормальной сывороткой или при отсутствии в растении соответствующего вируса жидкость остается равномерно мутной.
Образование видимого осадка при смешивании растительных соков, содержащих вирус, с их антисывороткой обычно классифицируется как реакция преципитации. Однако, если капля неочищенного растительного сока, содержащего вирус, смешивается с антисывороткой то происходит склеивание мелких частиц материала растения-хозяина. Явление это можно наблюдать невооруженным глазом или через микроскоп при малом увеличении. Хотя в этом случае в реакцию не вовлекаются антитела, специфичные к веществам растения, тем не менее, указанный процесс называют реакцией агглютинации (по-видимому, из-за внешнего сходства выпадающего осадка) со специфической агглютинацией бактерий под действием противобактериальной антисыворотки.
Реакция преципитации. Для определения устойчивости растений к инфекционному заболеванию селекционерами широко используется серологический метод, предложенный Т. И. Федотовой (1935). По этому методу ставят реакцию пробирочной кольцепреципитации иммунной сыворотки, полученной на определенного возбудителя, с раствором диализата белка исследуемого растения. Антитела, содержащиеся в иммунной сыворотке, при встрече с белком восприимчивого сорта растения дают положительную реакцию преципитации. Белок сыворотки и белок антигена, соединяясь, образуют видимое невооруженным глазом кольцо преципитата на границе жидкостей. Это означает, что белок восприимчивого сорта серологически родствен с антигеном, используемым для иммунизации животного, т. е. с белком возбудителя болезни. Отрицательная реакция указывает на устойчивость сорта - нет серологического родства между белком возбудителя болезни и белком исследуемого сорта растения. Точного объяснения существующего родства между белками растения-хозяина и микроба-паразита нет. Предполагают, однако, что восприимчивые сорта, обеспечивая возбудителя болезни питанием, влияли на состав и строение белков этого паразита. Эта принятая пища оказывает определенное влияние на создаваемые организмом специфические белки, что и улавливается реакцией иммунитета.
Техника постановки реакции кольцепреципитации. Для постановки реакции преципитации требуется:
1) иммунная сыворотка к предполагаемому возбудителю заболевания; 2) антиген - диализированный белок растения; 3) физиологический раствор; 4) тонкие пастеровские пипетки; 5) преципитационные пробирки диаметром 3-5 мм; 6) штативы к пробиркам.
Сыворотки, антиген и физиологический раствор должны быть совершенно прозрачными.
В узкие преципитационные пробирки, установленные в штативе, наливают пастеровской пипеткой по 0,5мл преципитирующей сыворотки, разведенной физиологическим раствором 1 : 2. По стенке наклоненной пробирки осторожно тонкой пастеровской пипеткой наслаивают на сыворотку 0,5мл белкового диализата растений, разведенного последовательно до нужной концентрации (1 : 2; 1 : 4 и т. д.). Пробирку осторожно, чтобы не смешать жидкости, ставят в штатив. При хорошем наслоении отчетливо бывает заметна граница соприкосновения сыворотки с антигеном.
При наличии в диализате (восприимчивое растение) специфического преципитиногена, а в сыворотке - антител к нему, на границе жидкостей появляется дымчатое кольцо (диск) выпавшего преципитата. Кольцо должно возникнуть в специфических случаях в течение 5-10 мин. после наслаивания жидкостей. Диагностическую оценку ведут на черном фоне в проходящем свете.
При постановке этой реакции для исключения неспецифической преципитации обязательно ставят следующие контроли:
1. преципитирующая сыворотка + физиологический раствор;
2. нормальная сыворотка + исследуемый антиген;
3. преципитирующая сыворотка (заведомо) + специфический антиген.
В двух первых пробирках контроля реакция должна быть отрицательной.
Контрольные вопросы:
1. Что такое инфекция и иммунитет?
2. Какие виды иммунитета вы знаете?
3. Что такое антигены и антитела?
4. Какие реакции иммунитета вы знаете?
5. Как провести реакцию преципитации?
6. Как провести реакцию агглютинации?
ПРИЛОЖЕНИЯ
Приложение 1
Приготовление наиболее употребительных красок и реактивов
Для окраски микроорганизмов применяют насыщенные растворы красителей, которые готовятся по указанным ниже рецептам.
Метиленовый синий. Насыщенный спиртовый раствор этого красителя можно приготовить впрок. Для этого к 100 мл спирта добавляют 3 г сухой краски. Для окрашивания фиксированных препаратов метиленовый синий используют в концентрации 1:40 (1 мл насыщенного спиртового раствора смешивают с 40 мл дистиллированной воды).
Фуксин основной. Для приготовления насыщенного спиртового раствора к 100 мл спирта добавляют 10 г сухой краски. Краску разбавляют в пропорциях 1:10; 1:100.
Карболовый фуксин Циля. К 100 мл 50-процентного раствора фенола (карболовой кислоты) добавляют 100 мл насыщенного спиртового раствора основного фуксина. Через 24 ч краску фильтруют. Карболовый фуксин Циля хорошо красит споры и поэтому применяется наиболее часто. Для окраски вегетативных клеток применяют раствор, разбавленный в 5-10 раз дистиллированной водой (разбавленный раствор быстро портится).
Карболовый генциановый фиолетовый (для окраски по Граму). 1 г генциано- вого фиолетового растворяют в 10 мл спирта. Полученный раствор выливают в 100 мл 50-процентного раствора фенола (карболовой кислоты). Добавляют по каплям спирт до исчезновения с поверхности металлической блестящей пленки.
Карболовый зритрозин для окрашивания бактерий почвы. Для приготовления рабочего раствора в 100 мл дистиллированной воды растворяют 5 г фенола (карболовой кислоты) и 1-5 г эритрозина. После этого дают жидкости отстояться.
Для окраски клеточных включений применяют следующие реактивы:
Раствор Люголя
а) для окраски гранулезы: 2 г йодида калия растворяют в 5 мл воды, затем прибавляют 1 г йода и объем доводят водой до 300 мл;
б) для окраски гликогена: 20 г йодида калия растворяют в 100 мл воды, затем прибавляют 7 г кристаллического йода.
Краска судан III для окраски жира: к 100 мл 90-процентного спирта добавляют 0,5 г краски.
Метиленой синий для окраски волютина применяют в концентрации 1:40, готовят из спиртового насыщенного раствора.
Для негативной окраски капсул: одну часть обыкновенной туши разбавляют в 10 раз, раствор кипятят, фильтруют и хранят в холодном месте.
Раствор нигрозина для обнаружения капсул: к 100 мл дистиллированной воды добавляют 10 г нигрозина, раствор кипятят в течение 30 мин., добавляют 0,5 мл формалина и хранят в темноте.
Реактив Грисса для обнаружения азотистой кислоты. Готовят два раствора.
Раствор 1: смешивают 14,7 г ледяной уксусной кислоты, 1 г сульфаниловой кислоты и 15 мл дистиллированной воды; смесь нагревают до растворения реактивов, охлаждают и приливают 270 мл воды.
Раствор 2: смешивают 0,2 г нафтиламина, 14,3 г ледяной уксусной кислоты и 25 мл дистиллированной воды; нагревают до растворения и приливают 300 мл воды.
Перед употреблением оба раствора смешивают в равных объемах.
Раствор дифениламина для обнаружения азотной кислоты. Несколько кристаллов дифениламина растворяют в 1 мл концентрированной серной кислоты. К капле исследуемой культуральной жидкости прибавляют каплю этого раствора, при наличии азотной кислоты проявляется синее окрашивание.
Реактив Несслера для обнаружения аммиака. Раствор хлорида ртути (II) (17 г в 300 мл воды) приливают к раствору йодида калия (35 г в 100 мл воды) до выпадения красного нерастворимого осадка. Объем полученной жидкости доводят до 1 л, добавляя 20-процентный раствор едкой щелочи. Если при этом осадок растворился, то снова добавляют раствор хлорида ртути (II) до получения осадка. Светло-желтый раствор хранят в герметично закрытой склянке. По мере обесцвечивания окраски раствора к нему добавляют небольшие порции хлорида ртути (II).
Приготовление чернил для письма по стеклу. 1 г фуксина основного растворяют в 15 мл спирта, 2 г таннина растворяют в 15 мл воды и кипятят. Оба раствора смешивают в равных объемах.
Приготовление баритовой воды для обнаружения оксида углерода (IV): 10 г гидроксида бария растворяют в 100 мл дистиллированной воды, взбалтывают 15 мин, дают отстояться раствору в течение суток, затем осторожно сливают прозрачный раствор в чистую колбу, доливают 90 мл дистиллированной воды; переливать раствор в чистую колбу лучше через сифонную трубку; колбу необходимо плотно закрыть пробкой.
Приложение 2
Работа с микроскопическими препаратами
Препараты микроорганизмов готовят на предметных стеклах. В одних случаях изучают живые микроорганизмы (прижизненно), в других - их убивают, фиксируют. Методы приготовления прижизненных и фиксированных препаратов описаны в соответствующих работах. Во всех случаях стекла должны быть совершенно чистыми и обезжиренными. Перед работой их промывают водой и протирают смесью, состоящей из равных частей спирта и эфира. Можно выдерживать предметные стекла в этой смеси 2-3 дня.
Предметные стекла, бывшие в употреблении, опускают на 2 часа в хромовую смесь, затем хорошо промывают водой и кипятят в 2-процентном растворе соды. После кипячения стекла вновь промывают в проточной воде и сушат.
Препараты не рекомендуется класть на стол; нужно иметь специально приготовленные для этого штативы. Такой штатив можно сделать самим из двух стеклянных палочек и двух резиновых трубок. Стеклянные палочки длиной 15-20 см дугообразно соединяют друг с другом с двух сторон с помощью резиновых трубок. Расстояние между трубками 4-5 см, т.е. меньше длины предметного стекла.
Такой штатив кладут на эмалированную ванночку или кристаллизатор и на него (поперек) укладывают предметные стекла. При приготовлении постоянных препаратов с применением окраски после окрашивания их промывают водой прямо на штативах. Такое приспособление ускоряет и облегчает работу.
Чтобы рабочее место во время занятий было чистым, рекомендуется все краски, реактивы, пипетки и другое оборудование держать на лотках или подставках.
Если нет предметных стекол с вышлифованными углублениями для изучения микроорганизмов методом висячей капли, надо сделать из картона кольца или квадратики площадью 4 см2 с круглым отверстием посередине диаметром несколько меньше размера покровного стекла и наклеить их на предметные стекла.
Наиболее удачные и интересные фиксированные препараты, полученные на занятиях, рекомендуется сохранять, составив из них музейный демонстрационный материал.
Чтобы фиксированный и окрашенный препарат сохранить надолго, можно покровное стекло по краям обмазать канадским бальзамом или покрыть сверху раствором плексигласа. Капля жидкого плексигласа наносится на сухой препарат: растекаясь по его поверхности и высыхая, она образует тонкую, прозрачную, твердую пленку, надежно защищающую мазок от повреждений. Пленка не мешает рассмотрению препарата под микроскопом, даже с иммерсией. Жидкий плексиглас готовят путем растворения
г плексигласа в 100 мл дихлорэтана; после растворения получается довольно густая масса, быстро застывающая. На предметное стекло с фиксированным препаратом с левой стороны приклеивается этикетка с наименованием вида микроорганизмов и датой приготовления. Готовые препараты сохраняют в специальных папках или коробках. Такие препараты могут служить учебным пособием для занятий. Если позволяет время, то приготовление постоянных препаратов можно включить в программу практических занятий студентов.
Приложение 3
Способы стерилизации питательных сред, посуды и других лабораторных материалов
| Стерилизуемый материал | Метод стерилизации | Режим стерилизации | Примечания |
| Питательные среды с почвенной вытяжкой; картофельные среды | автоклавирование | 1,5-2 атм. 30 мин. | в колбах, пробирках, бутылях и т.д., закрытых ватными пробками |
| Жидкие и агаризованные среды, не содержащие сахаров и других веществ, разлаг ающихся при 120°С | автоклавиро- вание | 1 атм. 20 мин. | так же |
| Жидкие и агаризованные среды с сахарами и другими соединениями, не выдерживающими 120°С | автоклавиро- вание | 0,5 атм. 15-20 мин. | так же |
| Среды или компоненты сред, не выдерживающие нагревания выше 100°С | дробная стерилизация | текучий пар 3 раза по 30-40 мин. | так же |
| Среды или компоненты сред, не выдерживающие нагревания, например белки, некоторые витамины и др. | фильтрование через бактериальные фильтры | - | - |
| Чашки Петри, пипетки, шпатели | горячим воздухом | 165-170°С, 2 ч | завернутые в бумагу (отверстия пипеток закрыты ватными тампонами) |
| Колбы, пробирки, химические стаканы, флаконы, стеклянные центрифужные пробирки, трубки Бур- ри | горячим воздухом | 165-170°С, 2 ч. | закрытыми ватными пробками |
| .Держатели бактериальных фильтров, резиновые пробки и шланги, фильтры Зейтца, свечи Шамберла- на и Баркефельда | автоклавиро- вание | 1 атм. 20 мин. | завернутые в бумагу |
| Мембранные фильтры | автоклавиро- вание | 0,5 атм. 15 мин. | в сосуде с дистиллированной водой: можно стерилизовать длительным кипячением |
| Пробирки, изготовленные из термолабильных пластмасс | ультрафиолетовыми лучами | время экспозиции устанавливают экспериментально | пробирки после облучения хранят в стерильной посуде |
Список латинских названий микроорганизмов
| Acetobacter aceti 31,36,40 pasteurianum 31,36,40 xylinum 31,36,40, 41 Achromobacter stutzeri 9 Actinomyces albus 56 griseus 56 bovis 56 globisporus 58 citreus 56 chromogenes 56 longisporus 56 Ascomycetes 52 Aspergillus 40, 61 niger 53 flavus 53 fumigatus 53 oryzae 53 Azotobacter agilis 44 chroococcum 15, 18, 19, 20, 21, 43, 44, 49 vinelandii 44 Вас. idosus 25 maximus buccalis 14 mesentericus 6, 7, 9, 11,16, 17, 25, 44, 58, 59 megaterium 19 ,44 mycoides 9, 12, 16, 19,20, 25, 44, 58, 59 putriflcus 18, 44 cellulosae methanicus 35 cellulosae hydrogenicus 35 cereus 61 popilliae 61 subtilis 6, 7, 9, 11, 12, 14, 16, 18, 19, 25, 44, 45, 48 thuringiensis 60, 61, 63 Var. alesti 61 Var. galleriae 61,62 Var. dendrolimus 61 Bact. marcescens (Serratia marcescens) 44, 45, 49 xanthochlorum schuster 50, 51, 53 Basidiomycetes 52 Beauveria bassiana 60, 62 Beggiatoa mirabilis 11, 13 Bejerinkia 44 Candida 41 Cellfalcicula 35 viridis 40 Cellvibrio 35, 40 Cicinobolus 61 Cephalosporium 61 Clostridium omelianskii 35, 39 pasteurianum 11, 16, 18,38,43 amylobacter 15, 17 pectinovorum 35, 39 felsineum 35, 39 Chytridiomycetes 52 Chomobacter denitrificans 19 Crenothrix polyspora 9, 14, 15 Cytophaga 35, 40 Chytridiomycetes 52 | Darcula 61 Deuteromycetes 52, 61 Derxia 44 Entomophthora 61 Escherichia coli 12, 34 Fungi imperfecti 52 Fusarium 40,61 Fusarium nivale 50, 54 Granulobacter pectinovorum 11 Galionella ferruginea 14 Lactobacillus bulgaricum 34, 37 lactis 34, 37 plantarum 34, 38 brassicum 38 fermenti 34, 38 Lactobacterium acidophillum 37 Leuconostoc mesenteroides 20 Leptothrix ochracea 14 Massaspora 61 Micrococcus aurantiacus 9, 11, 14, 20 denitrificans 43, 50 Monilia 61 Mucor mucedo 52 Nitrobacter 43, 45, 46, 49, 50 Nitrozomonas sp. 19, 20, 43, 45, 46, 50 Oidium lactis 38 Oomycetes 52 Paecilomyces 61 Proteus vulgaris 6, 7, 12, 44, 48 Pseudomonas aeruginosa 43 fluorescens 9, 43, 50 stutzeri 43, 50 Phytophtora infestans 54 Rhizobium 44 Rhizopus nigricans 50, 55, 56 Rhodospirillum rubrum 13 Saccharomyces cerevisiae 15, 16, 17,18, 19, 54 kefiri 37 Salmonella 62 Danysz 62 decumanicidum 60, 62 typhimurida rodentia 62 typhi spermophilorum 62 Sarcina iutea 58, 59, 60 flava 10, 14 ureae 9, 11 Serratia marcescens 45, 48 Spirohaeta buccalis 9,13, 14 dentium 13, 14 Streptococcus albus 13, 14 lactis 9, 34, 37 Sclerotinia 50,55 Sorangium 35, 40 Sporocytophaga 35, 40 Tarichium 61 Tuberculina 61 Treponema pallidum 13 T richoderma 61 Vibrio buccalis 9, 13, 15 Verticillium 61 Zygomycetes 52, 61 |
