Глутаматдегидрогеназа занимает центральное место
В обмене азота в клетке
Большинство трансаминаз используют в качестве акцептора аминогруппы α-КГ и образуют Глу. Окисленное дезаминирование последней с образованием α-КГ и аммиака катализируется широко распространённой в тканях глутаматдегилрогеназой. Она представляет собой олигомерный фермент с молекулярной массой 312 кДа, состоящий из шести субъединиц. При определённых условиях (под влиянием НАД+ или ГТФ) фермент диссоциирует на субъединицы с потерей глутаматдегидрогеназой активности.
Глутаматдегидрогеназа обладает высокой активностью, локализована в митохондриях и может использовать в качестве кофермента НАД+ или НАДФ+. Работой этого фермента завершается непрямое дезаминирование многих аминокислот, а аммиак, высвобождаемый в этой реакции, протекающей в печени, используется для синтеза мочевины.
Глутаматдегидрогеназа – аллостерический фермент, и его ктивность тщательно регулируется. Аллостерическими ингибиторами фермента являются АТФ, ГТФ и НАДН · Н+, а активатором – АДФ. Этот фермент катализирует и обратную реакцию, обеспечивая аминирование α – кетоглутаровой кислоты свободным аммиаком, что важно в механизмах обезвреживания аммиака и позволяет использовать азот аммиак для синтеза аминокислот.
В клинической практике широко используется определение двух трансаминаз. В диагностике инфаркта миокарда применяют определение активности АсАТ, а для диагностики и оценки эффективности лечения некоторых болезней печени используют определение активности АлАТ, что связано с неравномерным распределением этих ферментов в разных органах и тканях и даже в разных субклеточных фракциях (сердце, печень, почки, эритроциты, легкие, плазма). 2/3 всей активности АсАТ клетки приходятся на митохондрии, а для АлАТ – на цитоплазму. При незначительных нарушениях функций клетки в кровь переходят цитозольные ферменты. При значительных повреждениях в кровь могут переходить митохондриальные ферменты. При инфаркте миокарда активность АсАТ повышается через 2-6 часов после инфаркта, достигает максимума через 24-48 часов и затем в течение недели возвращается к исходным значениям. АсАТ оказывает хорошую помощь в диагностике. При острых поражениях печени типичным будет повышение активности АлАТ, а также АсАТ, ЛДГ, но коэффициент 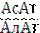 < 1, а при инфаркте
< 1, а при инфаркте 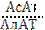 > 1. Повышение активности АлАТ наблюдается при повреждении паренхимы печени.
> 1. Повышение активности АлАТ наблюдается при повреждении паренхимы печени.
ДЕКАРБОКСИЛИРОВАНИЕ – отщепление CO2 от карбоксильной группы аминокислот с образованием соответствующих аминов; фермент декарбоксилаза. Коферментом декарбоксилаз является активная форма Vit B6 - пиридоксальфосфат.
| R – CH – COOH → R – CH2 + CO2 | | NH2 NH2 |
Продукты декарбоксилирования – биогенные амины – обладают высокой биологической активностью. Из триптофана → триптамин – обладает сосудосуживающими свойствами. Из 5-гидрокситриптофана → серотонин – стимулирует сокращения гладкой мускулатуры, влияет на поведение человека, активирует выброс гормонов мозгового вещества надпочечников, фактор, повышающий свертываемостью крови. Из гистидина → гистамин – повышает тонус органов с гладкой мускулатурой, стимулирует секрецию пищеварительных желез, обладает антидиуретическим действием и т.д.
Разрушение биогенных аминов происходит путем их окислительного дезаминирования под влиянием моноаминооксидаз и диаминоксидаз. Изменение активности этих ферментов при помощи специфических ингибиторов широко применяется в медицинской практике при лечении аллергических заболеваний, расстройств психики и т.д.
Образование NH3 – обязательный этап распада аминокислот. NH3 подлежит обезвреживанию в организме. Образующийся в процессе дезаминирования аммиак используется в небольших количествах в процессах внутриклеточного метаболизма.
Основная масса NH3 должна выводиться из организма, так как попадание его в кровь оказывает токсическое действие. Особенно чувствительны к действию NH3 нервные клетки. Поэтому в каждой клетке, и особенно в нейронах, должны быть защитные реакции по обезвреживанию NH3. Первая реакция это – восстановительное аминирование с участием α-кетоглутаровой кислоты, катализируемое глутаматдегидрогеназой.
COOH COOH | | CH2 CH2 | глутаматдегидрогеназа |  CH2 + NH3 CH2 | | C =O CH-NH2 | | COOH COOH α – кетоглутаровая кислота Глутаминовая кислота CH2 + NH3 CH2 | | C =O CH-NH2 | | COOH COOH α – кетоглутаровая кислота Глутаминовая кислота |
Вторая реакция – синтез глутамина и аспарагина из глутаминовой и аспарагиновой кислот.
O // COOH С-NH2 | | CH2 CH2 | |  CH2 + NH3 + АТФ CH2 | | CH – NH2 CH – NH2 | | COOH COOH Глу Глутамин O // COOH С-NH2 | | CH2 + NH3 + АТФ CH2 | | CH – NH2 CH – NH2 | | COOH COOH Глу Глутамин O // COOH С-NH2 | |  CH2 + NH3 + АТФ CH2 | | CH – NH2 CH – NH2 | | COOH COOH Аспарагиновая кислота Аспарагин CH2 + NH3 + АТФ CH2 | | CH – NH2 CH – NH2 | | COOH COOH Аспарагиновая кислота Аспарагин |
Эти кислоты всегда имеются в тканях в свободном состоянии, улавливают образующийся NH3 путем реакции амидирования и при участии АТФ синтезируется Глутамин и аспарагин. Глутамин в организме животных выполняет роль и транспортной формы NH3. Попадая в печень или почки, глутамин распадается при участии глутаминазы, высвобождая NH3, который в печени используется для синтеза мочевины, а в почках секретируется при образовании мочи.
O
//
C – NH2 COOH
| |
CH2 CH2
| |
 CH2 + H2O CH2 + NH3
CH2 + H2O CH2 + NH3
| |
CH – NH2 CH – NH2
| |
COOH COOH
Глутамин Глутаминовая кислота
Третья реакция – образования аммонийных солей происходит в почечной ткани, куда аммиак доставляется в виде амидов аспарагиновой и глутаминовой кислот. Здесь амиды гидролизуются под действием глутаминазы и аспарагиназы, образуя аспартат и глутамат и высвобождая аммиак, который нейтрализуется путем образования солей аммония, в частности хлорида аммония. Соли аммония удаляются с мочой.
Лекция № 6.
