Циркуляция возбуждения по замкнутому пути
Кольцевая модель циркуляции. Ранние эксперименты Mayer [72], Garrey [73] и Mines [74, 75] показали существование захвата циркулирующей волны (кольцевое сокращение или круговое движение) в кольцевых препаратах миокардиальных и других тканей различных животных, включая млекопитающих (рис. 7.5, А). Наличие фиксированного анатомического препятствия является важнейшим условием возникновения кругового движения. В гипотезе Mines впервые был поставлен вопрос о возможном существовании связи подобного кругового движения с нарушениями ритма у человека. На основании наблюдений Mines в эксперименте с кольцевыми препаратами Thomas Lewis [76, 77] попытался доказать, что при трепетании предсердий волна возбуждения циркулирует вокруг естественного отверстия в миокарде предсердий (полая вена). Schmitt и Erianger [78] предположили, что замкнутый путь, образованный ветвями периферических волокон Пуркинье и миокардиальными волокнами желудочков, способен поддерживать круговое движение, аналогичное наблюдаемому в мышечных кольцах (рис. 7.5, Б).
Согласно этой концепции, центральную роль в инициации кругового движения волны в кольцевой модели играет однонаправленный блок (см. рис. 7.5, В). При этом стимул блокируется в одном направлении (предположительно вследствие неоднородной рефрактерности), но продолжает проводиться в другом направлении. Круговое движение возникнет в том случае, если волновой фронт подойдет к участку однонаправленного блока после восстановления возбудимости последнего, что обеспечит непрерывность проведения возбуждения. Хотя круговое движение в петле, образованной волокнами Пуркинье и миокардом, вполне возможно, его трудно продемонстрировать в сердце in situ. В настоящее время существует лишь два строго доказанных типа кольцевой модели циркуляции в интактном сердце млекопитающих: 1) синдром преждевременного возбуждения, предположение о котором было высказано Mines [75] вскоре после демонстрации Kent многочисленных мышечных соединений между предсердиями и желудочками у человека [79]; 2) круговое движение волны с участием обеих ножек пучка Гиса (циркуляция в ножках пучках) [80], которое было впервые предсказано в результате экспериментальных наблюдений Мое и соавт. [81] (рис. 7.6). Общим для синдрома преждевременного возбуждения и циркуляции в ножках пучка Гиса является то, что анатомический субстрат замкнутого пути состоит в основном из пучков возбудимых волокон, которые не
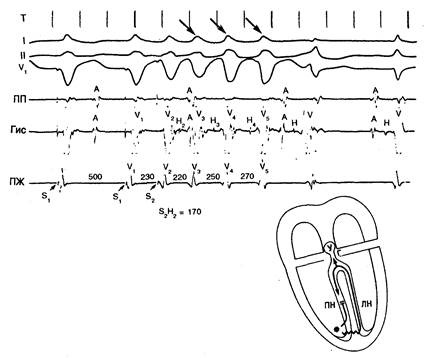
Рис. 7.6. Циркуляция с вовлечением ножки пучка Гиса у человека.
Запись, полученная у больного 55 лет, показывает возникновение циркуляции с захватом ножки пучка при программной преждевременной стимуляции. Представлены ЭКГ в отведениях I, II и V1, ЭГ верхней части правого предсердия (ПП), гисограмма (Гис) и ЭГ правого желудочка (ПЖ). Желудочек (правый) стимулировался в области его верхушки с длительностью основного цикла (S1—S2) 500 мс. Один преждевременный стимул (S2), поданный с интервалом сцепления 320 мс, обусловливает три спонтанных экстравозбуждения (стрелки). Форма комплекса QRS индуцированного ритма аналогична наблюдаемой при основной стимуляции и отражает блокаду левой ножки пучка Гиса. Индуцированный ритм прекращается в результате захвата синусового возбуждения. Схема внизу иллюстрирует механизм развития индуцированного ритма вследствие циркуляции в ножке пучка. Преждевременное стимулированное возбуждение (S2) ретроградно блокируется (две черточки) в правой ножке (ПН), но медленно распространяется по межжелудочковой перегородке и достигает левой ножки (ЛН). Импульс ретроградно проводится по ЛН, активирует пучок Гиса (Г) и возвращается в правую ножку антероградно, активируя ее и завершая таким образом первый цикл циркуляции. Волна активации достигает участка функционального блока проведения в ПН уже после восстановления его возбудимости и продолжает свое движение по кругу. На электрограмме пучка Гиса (Гис) интервалы между QRS преждевременного возбуждения и двумя первыми циркуляторными возбуждениями, а также ретроградная Гис-дефлексия постепенно возрастают, отражая прогрессивное увеличение задержки проведения в ретроградном звене цепи циркуляции. С другой стороны, интервал между ретроградной Гис-дефлексией и комплексами QRS трех циркуляторных возбуждений остается постоянным и равным интервалу Н—V проведенных синусовых возбуждений. Y — АВ-узел.
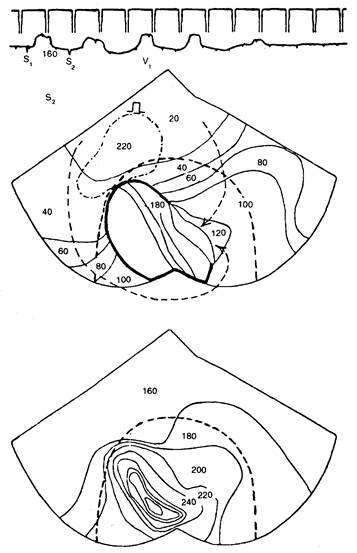
Рис. 7.7 Корреляция изохронной активации и рефрактерности (по данным карт) при циркуляции возбуждения в постинфарктном сердце собаки.
Регистрация осуществлялась через 4 дня после перевязки левой передней нисходящей коронарной артерии. На ЭКГ (вверху) видно, что одиночный преждевременный стимул (S2) с интервалом сцепления 160 мс инициирует короткую пробежку циркуляторного ритма. Представлены карта активации эпикарда при S2 (вверху) и карта рефрактерности при S1 в момент нанесения S (внизу). На обеих картах показаны изохроны с 20-миллисекундным шагом. Пунктирной линией на обеих картах отмечена граница зоны ишемии. Поверхность эпикарда изображена таким образом, как если бы желудочки были рассечены от основания до верхушки и развернуты. Левая и правая границы в верхней части соответствуют правому и левому АВ-соединению. Две криволинейные поверхности справа и слева являются непрерывными и идут от основания задней стенки к верхушке сердца. Желудочки стимулировались со стороны выводящего тракта правого желудочка. Как показано на карте активации, S2 приводит к появлению длинной дуги функционального блока проведения в пределах эпикардиальной границы ишемической зоны (толстая сплошная линия). Волны активации эпикарда огибают дугу блока с обоих концов, сливаясь в единый циркулирующий фронт, который медленно проводится от латеральной до септальной границы ишемической зоны раньше реактивации областей миокарда на проксимальной стороне блока и вызывает первое циркуляторное возбуждение. Карта рефрактерности показывает, что ишемия обусловливает неоднородное распределение рефрактерности, причем участки с эффективными рефрактерными периодами (ЭРП) в 160 и 170 мс располагаются в нормальном эпикарде правого и левого желудочков, тогда как участок с наиболее продолжительным ЭРП в 320 мс находится в центре зоны ишемии. Дисперсия рефрактерности составляет 160 мс при наличии изохрон рефрактерности концентрической формы, что обусловливает постепенное увеличение ЭРП от пограничной зоны к центру ишемической зоны. Дуга функционального блока при нанесении S2 возникает между соседними участками с длительным и коротким рефрактерными периодами, причем участки с большей рефрактерностью находятся теперь дистальнее дуги блока.
контактируют с прилегающим миокардом предсердий и желудочков. Это обеспечивает возникновение единственной простой циркулирующей волны. Замкнутая цепь может быть легко разорвана путем перерезания изолированных возбудимых пучков в любой точке на всем их протяжении, но, вероятнее всего, это лучше сделать на более четко определяемых участках предсердных или желудочковых соединений данных путей.
Модель замкнутого пути в форме восьмерки. Наличие фиксированного анатомического препятствия не является необходимым условием для развития кругового движения возбуждения в предсердиях или желудочках. Это впервые было продемонстрировано Allessie и соавт., которые показали, что преждевременный стимул, нанесенный в определенный момент времени, может вызвать циркуляторную тахикардию в небольших препаратах кроличьего предсердного миокарда [82—84]. Инициация циркуляции обеспечивается здесь существованием различий в рефрактерных периодах соседних волокон. Преждевременный импульс, инициирующий циркуляцию, блокируется в волокнах с продолжительным рефрактерным периодом и распространяется по волокнам с более коротким рефрактерным периодом, возвращаясь в конечном итоге к первоначальному участку блока после восстановления возбудимости последнего. El-Sherif и соавт, продемонстрировали круговое циркуляторное движение в выжившем, но электрофизиологически аномальном ишемизированном слое эпикарда, покрывающем зону инфаркта в сердце собаки [85—87]. Авторы нашли неоднородное распределение длительности рефрактерности, причем в зоне ишемии обычно отмечаются концентрические участки с равной рефрактерностью, величина которой постепенно возрастает по мере продвижения от края ишемической зоны к ее центру [88]. Преж девременное возбуждение, возникшее в определенный момент времени и вызвавшее циркуляцию, приводит к появлению дуги однонаправленного блока проведения, вокруг которого циркулирует волновой фронт. Дуга блока проведения возникает между соседними зонами с большей и меньшей длительностью рефрактерности, причем зона с более продолжительной рефрактерностью располагается дистально по отношению к дугообразному участку блока (рис. 7.7).
Преждевременное возбуждение, успешно инициирующее циркуляцию, создает более протяженный дугообразный участок блока, обусловливая более медленное проведение по сравнению с наблюдаемым при возбуждении, не способном вызвать циркуляцию. Если циркуляцию не удается вызвать с помощью однократной преждевременной стимуляции (S2), может потребоваться повторная преждевременная стимуляция (S3), которая обычно приводит к появлению большей дуги или к замедлению проведения вокруг имеющейся дуги. Чем медленнее волна активации движется по более длинному и извилистому пути, тем больше времени имеет ткань, расположенная с проксимальной стороны однонаправленного блока, для восстановления своей возбудимости. Ее повторное возбуждение инициирует циркуляцию. Возбуждение, инициирующее первый цикл циркуляции (будь то S2 или S3), обусловливает появление непрерывной дуги блока проведения. Фронт волны активации огибает оба конца дуги блока и соединяется на дистальной• стороне дуги прежде, чем пройти по дугообразному участку пути для реактивации области, расположенной проксимальнее блока. Таким образом, первоначально единый дугообразный участок блока разделяется на две дуги. Циркуляторная активация продолжается, причем ее путь по своей форме теперь напоминает восьмерку и два циркулирующих волновых фронта продвигаются по двум отдельным участкам (дугам) блока проведения соответственно по часовой стрелке и против часовой стрелки. При мономорфной циркуляторной тахикардии стабильное существование двух дуг блока и двух циркулирующих волновых фронтов вряд ли возможно (рис. 7.8). При полиморфном же циркуляторном ритме обе дуги блока и циркулирующие фронты волн могут изменять свою конфигурацию, поддерживая, однако, синхронность движения.
Модель ведущего цикла. При циркуляторной тахикардии, вызванной Allessie и соавт, в небольших миокардиальных препаратах кроличьих предсердий, центр замкнутого пути (или вихрь) образован возбудимой тканью [82—84]. Однако эта ткань приобретает здесь функциональную невозбудимость, так как в центр постоянно вторгаются многочисленные центростремительные мелкие волны со стороны основного замкнутого пути, расположенного за пределами вихря (рис. 7.9, В).
Критический анализ предложенной Allessie и соавт, модели ведущего цикла показывает, что это действительно особая модификация модели циркуляции с замкнутым путем в форме восьмерки, которая, вероятно, может существовать только в изоли-
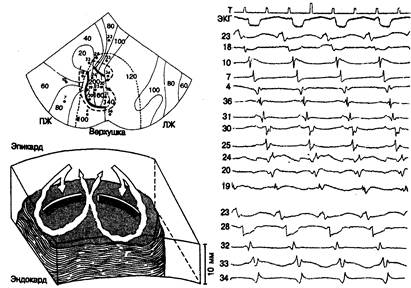
Рис. 7.8. Изохронная карта активации при мономорфной циркуляторной желудочковой тахикардии.
Регистрация осуществлялась в сердце собаки через 4 дня после перевязки левой передней нисходящей коронарной артерии. Изохроны активации показаны с 20-миллисекундным шагом. Цепь циркуляции имеет характерную форму «восьмерки», где два циркулирующих фронта движутся соответственно по и против часовой стрелки вокруг двух зон (дуг) с блоком проведения (толстые сплошные линии). На фрагменте справа некоторые из электрограмм, полученных одновременно вдоль двух дуг функционального блока проведения и на участках прохождения единого фронта циркулирующих волн, показывают присутствие электрической активности между последовательными циркуляторными возбуждениями во время диастолы. Внизу слева — трехмерное схематическое изображение активации желудочков при циркуляторной тахикардии. В данной экспериментальной модели циркуляция возбуждения происходит в тонком слое выжившего эпикарда, покрывающего зону инфаркта. ПЖ — правый желудочек; ЛЖ — левый желудочек.
рованных тканных препаратах, но не в интактном сердце [82—84]. На рис. 7.9 представлена несколько модифицированная версия изохронных карт активации при преждевременном возбуждении, инициирующем циркуляцию с круговым движением (А), а также при первом циркуляторном возбуждении (Б) в миокардиальном препарате предсердия кролика [83]. (Дуги функционального блока обозначены сплошными жирными линиями вместо двойных линий, представленных на оригинальной схеме.) Как видно на карте S2, нанесенный в критический момент времени преждевременный стимул обусловливает появление непрерывной дуги функционального блока проведения. Волны активации огибают оба конца дуги, сталкиваются и затем прорываются в блокированную зону для повторного возбуждения миокарда на проксимальной стороне дуги. На рис. 7.9, Б видно, что циркулирующий волновой фронт
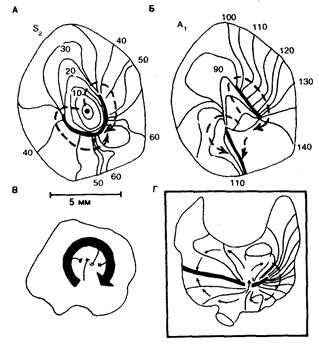
Рис. 7.9. Циркуляция возбуждения (модель ведущего цикла). А и Б — изохронные карты активации при нанесении преждевременного стимула (S2) и при первом циркуляторном возбуждении (A1), полученные in vitro на препарате предсердного миокарда кролика [83]. В — схематическое изображение модели ведущего цикла [84]. Г — изохронная карта предсердной активации in vivo при трепетании предсердий собаки; картина активации аналогична наблюдаемой на фрагменте Б. Подробное обсуждение в тексте [89].
продолжает свое движение вокруг одной из двух дуг. В результате происходит разделение первоначальной дуги на два отдельных дугообразных участка. Однако вторая дуга блока значительно смещается, располагаясь в области с наибольшей плотностью изохронов, которая показана на карте S2. Более существенно то, что эта вторая дуга теперь соприкасается с краем препарата, прерывая таким образом циркулирующий по ней волновой фронт. Если бы препарат, показанный на рис. 7.9, Б, находился бы в сердце in situ, то вторая, прерванная волна циркуляции активировалась бы, обусловив движение по замкнутому пути в форме восьмерки. Только в сердце in situ при ситуации, имитирующей активацию in vitro, показанную на рис. 7.9, Б, одна из двух дуг блока будет контактировать с АВ-соединением. Подобные примеры действительно наблюдаются в некоторых случаях активации in vivo, зарегистрированной Boineau и соавт. [89] в сердце собаки при трепетании предсердий (см. рис. 7.9, Г). На составленной автором карте единственная циркулирующая волна движется по часовой стрелке вокруг зоны (дуги) с функциональным блоком проведения. Движение второго (способного к циркуляции) волнового фронта в модели замкнутого пути в форме восьмерки предупреждается контактом второй дуги блока с АВ-соединением. Таким образом, наличие пути в форме восьмерки представляется основополагающим фактором возникновения возобновляющего циркуляторного возбуждения (короче, фибрилляции) в синцитиальной структуре предсердий и желудочков. Размер замкнутой цепи циркуляции в желудочке весьма невелик — 10 мм; в зависимости от распределения патологических изменений в миокарде такие цепи могут располагаться на эпикардиальных, интрамуральных или субэндокардиальных участках [90]. Таким образом, крупные дуги функционального блока проведения, которые поддерживают большие цепи циркуляции в постинфарктном желудочке собаки, а также описанные Allessie и соавт. [82—84) «мелкие вихри» функционального блока, которые поддерживают небольшие цепи циркуляции возбуждения в предсердном миокарде кролика, могут представлять два края спектра одного и того же электрофизиологического феномена.
Отражение
Термин «отражение» первоначально использовался при описании циркуляции возбуждения в линейном пучке проводящей ткани. В качестве достаточного механизма этого явления предлагалась продольная диссоциация проведения в пучке, обусловливающая возникновение микроциркуляторной цепи [91]. Позднее Antzelevitch и соавт, описали другой механизм, способный вызвать отражение [18, 92—94]. Если какой-либо сегмент пучка волокон Пуркинье невозбудим, то проведение импульсов по пучку блокируется именно в этом сегменте (рис. 7.10.Б). Однако блокируемый потенциал действия способен генерировать аксиальный ток, проходящий через невозбудимый сегмент пучка, который функционирует как пассивный кабель. Если невозбудимый сегмент достаточно мал относительно постоянной его длины, то протекающий ток сможет деполяризовать возбудимые волокна дистальнее невозбудимого участка и инициировать потенциал действия (см. рис. 7.10, В). Этот потенциал действия, если он возникает с достаточной задержкой, способен сам вызвать аксиальный ток, ретроградно проходящий через невозбудимый отрезок. Если общее время, необходимое для прохождения через невозбудимый отрезок (туда и обратно) превышает рефрактерный период ткани, расположенной проксимальнее участка блока, то генерируется «отраженный потенциал действия» (см. рис. 7.10,А). Циркуляция возбуждения по механизму отражения возможна в поврежденных тканях сердца. Однако она ограничивается теми областями, где повреждение миокардиальных волокон носит фокальный характер, ибо в случае обширного повреждения электротоническая передача через невозбудимую область невозможна [95].
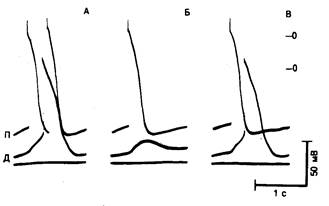
Рис. 7.10. «Отраженная циркуляция», вызванная прохождением электротонического тока через невозбудимый участок.
Трансмембранные потенциалы зарегистрированы в пучке волокон Пуркинье. Верхние и средние кривые получены в проксимальном (П) и дистальном (Д) сегментах, разделенных невозбудимым участком. Нижняя кривая на каждом фрагменте — маркер стимуляции. А — первый потенциал действия в сегменте П возникает при стимуляции и распространяется вплоть до невозбудимого участка. Возбуждение наблюдается дистальнее невозбудимого участка (сегмент Д) вследствие протекания электротонического тока. Задержка перед дистальным сегментом оказывается достаточно большой, что обеспечивает восстановление возбудимости проксимального сегмента и возникновение отраженного потенциала действия. Б — протекание электротонического тока оказывается недостаточным для активации волокна дистальнее возбудимого участка. В — дистальный сегмент активируется слишком быстро, и отражение не возникает, так как проксимальный сегмент не успевает восстановить свою возбудимость [18].
