Диагностика лактазной недостаточности
Для достоверной диагностики лактазной недостаточности характерные клинические данные должны быть обязательно подтверждены дополнительными лабораторными исследованиями.
Так называемая «диетодиагностика» основана на исчезновении клинических признаков лактазной недостаточности (диареи, метеоризма) при исключении лактозы из рациона и появлении симптоматики при употреблении молока. После нагрузки лактозой также увеличивается уровень водорода и метана в выдыхаемом воздухе.
При биохимическом исследовании кала у детей с лактазной недостаточностью определяется снижение pH <5,5, увеличение (у грудных детей) или появление (у детей старше 1 года) содержания лактозы и углеводов в кале. Золотым стандартом диагностики лактазной недостаточности считается определение активности лактазы в биоптатах тонкой кишки, однако сложность и инвазивность метода ограничивают его использование в педиатрической практике. Первичная лактазная недостаточность может быть выявлена в ходе генетического исследования («лактазного генотипирования»).
Лечение лактазной недостаточности
Подход к терапии лактазной недостаточности у детей разного возраста имеет свои особенности. Базовые принципы строятся на организации лечебного питания, оптимизации расщепления лактозы, предупреждении развития осложнений (гипотрофии, поливитаминной и полиминеральной недостаточности).
Грудным детям для сохранения естественного вскармливания назначается заместительная терапия ферментом лактаза. Детей, получающих искусственное вскармливание, переводят на низколактозные и безлактозные смеси либо заменители молока на соевой основе. При введении прикорма в виде каш, овощных пюре, следует использовать безлактозные продукты. Контроль за правильностью диетотерапии осуществляется путем определения содержания углеводов в кале.
Из диеты детей старшего возраста полностью исключаются цельное и сгущенное молоко, кондитерские изделия, содержащие молочные наполнители, некоторые лекарственные препараты (пробиотики) и т. д. При незначительной гиполактазии разрешается употребление кисломолочных продуктов, йогуртов, сливочного масла, если они не вызывают клинических симптомов лактазной недостаточности.
Прогноз лактазной недостаточности
Детям с первичной врожденной лактазной недостаточностью требуется пожизненное соблюдение диеты и проведение ферментной заместительной терапии. У недоношенных детей с транзиторной лактазной недостаточностью созревание ферментных систем позволяет вернуться к молочному вскармливанию к 3-4 месяцам. Вторичная лактазная недостаточность устраняется по мере купирования основного заболевания и восстановления активности лактазы.
Наблюдение ребенка с лактазной недостаточностью проводится педиатром и детским гастроэнтерологом. Критериями эффективности лечения лактазной недостаточности служат исчезновение синдрома диспепсии, соответствующая возрасту прибавка массы тела, нормальные темпы физического развития, снижение уровня углеводов в кале.
Источник: http://www.krasotaimedicina.ru/diseases/children/lactose-intolerance
Экссудативная энтеропатия (ЭЭ) или диарея с потерей белка (рrotein-losing enteropathy – PLE) — клинический синдром, при котором вследствие различных причин происходит потеря сывороточных белков через желудочно-кишечный тракт. Несмотря на то, что термин «энтеропатия» предполагает поражение тонкой кишки, потеря белка при ЭЭ может также происходить через толстую кишку, а также желудок и иногда пищевод. Механизм потери белка при ЭЭ у детей ничем не отличается от такового у взрослых, однако структура причин этого состояния в детском возрасте имеет определенные отличия
ЭЭ может быть как первичным проявлением болезни, так и субклиническим компонентом различных заболеваний. Уже давно было отмечено, что у некоторых пациентов развивается гипоальбуминемия в отсутствие нефротического синдрома, заболеваний печени, потерь белка через кожу или дыхательные пути, а также при достаточном поступлении белка с пищей. В таких случаях ранее ставился диагноз «идиопатическая гипопротеинемия» (также употреблялись термины «отечная болезнь», «нефроз без нефроза»).
И лишь после разработки методов диагностики, позволяющих идентифицировать наличие сывороточных белков в кале, стало возможным выявление истинных причин считавшейся идиопатической гипопротеинемии.
В 1949 году Albright и соавт. продемонстрировали увеличение обмена белка у пациентов с ЭЭ. В 1958 году Citrin и соавт. впервые использовали радиоизотопные методы для подтверждения факта наличия белков сыворотки крови в кале.
В дальнейшем эти методы совершенствовались, было предложено несколько методик с использованием различных веществ, меченых радиоактивными изотопами, но серьезный прогресс в изучении патогенеза ЭЭ стал возможен после того, как Crossley и Elliot в 1977 году доказали, что определение концентрации a1-антитрипсина (A1-AT) в кале является простым и надежным способом идентификации потери белка через ЖКТ. Этот метод позволил выявить целый ряд различных заболеваний и состояний, при которых имеет место явная и субклиническая ЭЭ.
Патофизиология
Известно несколько механизмов потери белка через ЖКТ. Среди них:
1) нарушение оттока лимфы;
2) эрозивно-язвенные поражения слизистой оболочки ЖКТ;
3) дисфункция кишечного эпителия в отсутствие макроскопических изменений.
Обструкция в лимфатических путях любой этиологии может привести к повышению давления в лимфатических сосудах ЖКТ, застою лимфы и пропотеванию белков из расширенных лимфатических капилляров кишечных ворсин в просвет кишечника. Если скорость потери альбумина превышает скорость его синтеза, развивается гипоальбуминемия и, как следствие, – отеки. Помимо альбумина, в просвет кишечника попадают и другие компоненты лимфы, такие как лимфоциты, иммуноглобулины и гидрофобные молекулы типа холестерина, липидов и жирорастворимых витаминов (A, D, E, K). Именно поэтому у пациентов с ЭЭ, развившейся вследствие нарушений лимфооттока, нередко выявляется лимфопения, гипогаммаглобулинемия, стеаторея и симптомы дефицита жирорастворимых витаминов. Несмотря на потерю иммуноглобулинов, иммунный ответ обычно не нарушается, т. к. синтез иммуноглобулинов не страдает.
Множество различных инфекционных и неинфекционных заболеваний, при которых имеет место воспаление и деструкция (эрозивно-язвенные процессы) слизистой оболочки ЖКТ, могут сопровождаться ЭЭ. Но поскольку нарушений лимфоттока в этих случаях нет, то отсутствуют лимфопения и потери иммуноглобулинов.
Роль эпителиальной дисфункции в развитии ЭЭ подтверждена в экспериментальных исследованиях. В частности, показано, что уменьшение количества гепарансульфат-содержащих протеогликанов на базолатеральной поверхности кишечных эпителиоцитов приводит к повышенной проницаемости клеточной мембраны для сывороточных белков. Исследования in vitro также продемонстрировали, что снижение количества этих протеогликанов не только само по себе вызывает ЭЭ, но также потенцирует эффекты других предполагаемых факторов, таких как провоспалительные цитокины и повышенное давление в лимфатических сосудах.
Список возможных причин ЭЭ, сгруппированных по описанному выше принципу, приведен в табл. 1.
Диагностика 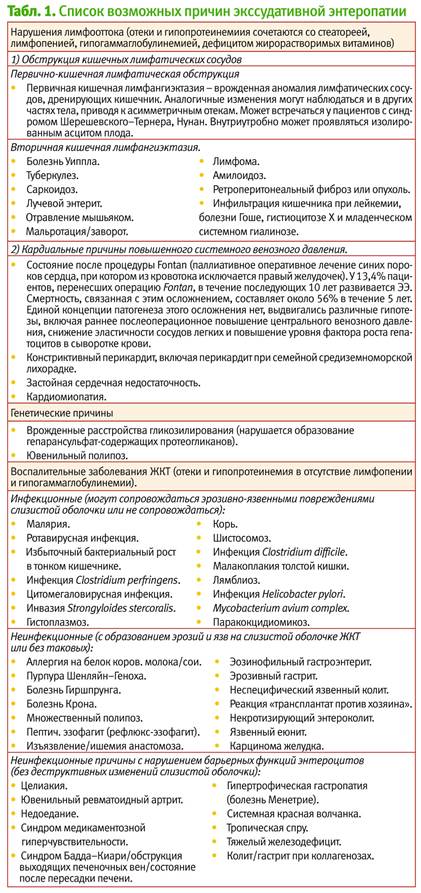
Основными клиническими проявлениями ЭЭ являются отеки и гипопротеинемия. На первом этапе диагностики важно исключить другие причины снижения уровня белка в сыворотке крови. В частности, потеря сывороточных белков через почки имеет место при нефротическом синдроме. Иногда потеря белка происходит через кожу. Почечные потери, в отличие от кишечных и кожных, обычно более селективные, т. е. в наибольшей степни теряются мелкие белки типа альбумина. Кроме того, гипоальбуминемия может быть следствием снижения синтеза белков из-за нарушения белково-синтетической функции печени или в результате недостаточного потребления белка с пищей, а также результатом повышенного катаболизма белков. Второй этап диагностики – выявление причины ЭЭ.
При сборе анамнеза у пациентов с отеками и гипоальбуминемией необходимо получить информацию:
· особенности питания и вскармливания, имеет ли место недоедание, которое может приводить к уменьшению синтеза альбумина (квашиоркор);
· имели ли место ранее документированные заболевания почек или печени (несмотря на то, что нефротический синдром или болезни печени сами по себе могут быть причиной гипоальбуминемии, следует помнить, что они также могут способствовать повышению давления во внутрибрюшной лимфатической системе, и таким образом – потерям белка через ЖКТ);
· отмечались ли у ребенка признаки поражения мочевых путей (изменение частоты и характера мочеиспусканий, цвета мочи, болезненность при мочеиспускании), а также эпизоды повышения АД;
· отмечалась ли у ребенка немотивированная слабость, утомляемость, желтушность кожных покровов;
· имели ли место какие-либо симптомы и признаки заболеваний ЖКТ (диарея, наличие крови в кале, боли в животе или любые другие желудочно-кишечные проблемы);
· не было ли ранее, начиная с периода новорожденности, асимметричных или других отеков (характерно для первичной кишечной лимфангиэктазии);
· имели ли место какие-либо проблемы со стороны сердечно-сосудистой системы (врожденные пороки сердца, перенесенные перикардит, серьезная стрептококковая инфекция, а также операции на сердце).
При физикальном обследовании следует обратить внимание на:
· антропометрические показатели (рост, вес, окружность головы, толщина кожной складки); при оценке массы ребенка делать поправку на возможную задержку жидкости;
· наличие признаков острого заболевания печени (увеличение размеров печени, ее плотная консистенция, бугристость, болезненность при пальпации в правом верхнем квадранте живота);
· наличие признаков хронического заболевания печени (желтуха, спленомегалия, расширенная венозная сеть на животе);
· состояние сердечно-сосудистой системы и наличие таких симптомов как гепатоспленомегалия, асцит, двухсторонние хрипы в нижних отделах легких, набухание яремных вен;
· уровень артериального давления;
· наличие изменений со стороны ЖКТ (болезненность при пальпации живота, вздутие живота, макроскопическая или микроскопическая кровь и/или слизь при пальцевом ректальном исследовании и др.);
· наличие ограниченных отеков.
Лабораторная диагностика
Все пациенты с отеками и документированной гипоальбуминемией, при отсутствии клинических или биохимических данных в пользу заболеваний печени или почек, должны быть обследованы на ЭЭ. Ранее ЭЭ считали диагнозом исключения, однако сегодня верифицировать кишечные потери белка лабораторными методами вполне возможно. В идеале, тест на ЭЭ должен идентифицировать в кале сывороточный белок, который не был секретирован, переварен или реабсорбирован в ЖКТ. Такого «идеального теста» до сих пор нет. Но разработано 3 типа исследований, которые могут подтвердить наличие кишечных потерь белка:
1) внутривенное введение белков, меченых радиоактивными изотопами, с последующим изучением радиоактивности кала;
2) определение концентраций эндогенных белков в кале;
3) методы на основе ядерной сцинтиграфии, позволяющие не только диагностировать ЭЭ, но и определить, в каком именно отделе ЖКТ происходят потери белка. Кроме того, ЯМР был предложен как альтернативный метод диагностики ЭЭ и определения топики поражения.
Радиоизотопные методы – исторически наиболее ранние методы диагностики ЭЭ, они начали применяться еще в 50-х годах. Вначале было предложено использовать альбумин, меченый 131I, однако соединение альбумина и йода было нестабильным, часть молекул распадалась, свободный радиоактивный йод всасывался из ЖКТ и выделялся с мочой, что снижало диагностическую ценность метода. Позднее была разработана методика, предполагающая использование поливинилпирролидон-131йода (131I-ПВП). ПВП – макромолекула, которая не переваривается кишечными ферментами (в отличие от альбумина) и плохо всасывается из ЖКТ. Тем не менее, ПВП не относится к нормальным метаболитам, имеет большую молекулярную массу, а также может частично всасываться и секретироваться. Кроме того, стабильность соединения ПВП с 131І также не была достаточной. Всасывание йода и выделение его с мочой создавало трудности в случаях, когда при сборе кала могло иметь место загрязнение его мочой (например, у детей).
В 1961 г. для диагностики ЭЭ начали использовать альбумин, меченый радиоактивным хромом (51Cr). Данное соединение было более прочным, а потому абсорбция радиоактивного хрома из ЖКТ отсутствовала или была крайне низкой. В целом, радиоизотопные методы диагностики ЭЭ в настоящее время практически не используются из-за ряда неудобств: необходимости сбора кала в течение 48–72 часов в условиях радиологического отделения, исключения загрязнения кала мочой, а также наличия лучевой нагрузки.
В 1977 году Crossley и Elliot продемонстрировали, что в кале пациентов с ЭЭ, подтвержденной выделением альбумина, меченого 51Cr, отмечались также высокие уровни альфа 1-антитрипсина (A1-AT). А1-AT – эндогенный белок, отсутствующий в пище. Его молекулярная масса близка к массе альбумина. В норме А1-АТ не секретируется клетками ЖКТ, не всасывается и не переваривается. A1-AT устойчив в кале при температуре 37°C и не экскретируется с мочой, что значительно упрощает процедуру забора кала. Образцы кала лиофилизируются, а A1-AT извлекается путем солюбилизации. Уровень A1-AT в кале изучается иммунологическим анализом. Возможно как определение концентрации A1-AT в кале, так и вычисление показателя клиренса A1-AT. В многочисленных исследованиях было показано, что определение концентрации фекального A1-AT является надежным методом диагностики ЭЭ и контроля эффективности лечения.
При ядерной сцинтиграфии для диагностики ЭЭ используется несколько белковых субстанций, меченых радиоактивными изотопами, включая индий-111(111In) – трансферрин, технеций-99m(99mTc) – человеческий сывороточный альбумин, и 99mTc – декстран. Последний обладает наилучшими техническими характеристиками. Возможность применения ядерной сцинтиграфии для диагностики ЭЭ была выявлена случайно, когда при проведении сцинтиграфии с Tc-99m MDP для выявления костных метастазов у больных раком также были выявлены потери радиоактивного вещества через кишечник, а позднее подтверждена и ЭЭ. Исследований, в которых бы сравнивалась чувствительность и специфичность ядерной сцинтиграфии в сравнении с определением фекального A1-AT для диагностики ЭЭ, нет. Однако, этот метод может быть чрезвычайно полезным в случаях, когда нужно определить уровень поражения и уточнить локализацию патологического процесса.
МРТ используется для выявления аномалий лимфатической системы, в том числе лимфатической системы кишечника и брюшной полости, приводящих к ЭЭ.
Помимо исследований, позволяющих документировать и локализовать потерю белка в кишечнике, обязательно назначается полное обследование для выявления причины ЭЭ. Как правило, сначала проводят культуральные и другие исследования с целью выявления инфекционных заболеваний и серологические тесты на целиакию. По показаниям проводят КТ, МРТ, сцинтиграфию.
Эндоскопические исследования позволяют выявить такие причины ЭЭ как гипертрофический гастрит, псевдомембранозный колит, воспалительные заболевания кишечника.
Биопсия слизистой оболочки кишечника и, реже – желудка, может понадобиться для диагностики таких причин ЭЭ как болезнь Крона, НЯК, целиакия, болезнь Уиппла, лимфома, болезнь Гиршпрунга, псевдомембранозный колит, эозинофильный гастроэнтерит, аллергическая энтеропатия, а также некоторых инфекционных заболеваний. Первичная лимфангиэктазтазия также является гистологическим диагнозом.
Лечение
Терапевтические подходы при ЭЭ зависят от ее этиологии. При ЭЭ, связанной с нарушениями лимфооттока, в том числе и при первичной лимфангиэктазии, рекомендуется исключение из пищи продуктов, содержащих длинноцепочечные триглицериды.
Поскольку продукты расщепления жирных кислот с длинной цепью всасываются непосредственно в лимфатические капилляры кишечных ворсинок, элиминация их из диеты при ЭЭ способствует снижению давления в лимфатических капиллярах и лимфатической системе кишечника в целом.
Длинноцепочечные триглицериды в пище заменяются на среднецепочечные, абсорбция которых не связана с лимфатическими капиллярами, и соответственно не сопровождается повышением давления в лимфатических сосудах. Кроме того, пища больных ЭЭ должна быть обогащена жирорастворимыми витаминами (A, D, E, K).
Кортикостероиды, в том числе будесонид, использовались при ЭЭ у пациентов с коллагенозами, воспалительными заболеваниями кишечника и у пациентов после процедуры Fontan. У последних также была показана эффективность применения гепарина. Есть спорадические сообщения об успешном использовании циклоспорина при ЭЭ, но следует помнить, что иммуносупрессоры не должны применяться при ЭЭ, связанной с инфекционными заболеваниями.
Заключение
Несмотря на то, что экссудативная энтеропатия нечасто встречается в педиатрической практике, это состояние может представлять серьезные диагностические трудности. Установить факт потери белка с калом, даже при отсутствии возможности проведения специфических исследований, на основании одних лишь клинико-лабораторных данных, в целом несложно. А вот для выяснения причины ЭЭ может потребоваться множество серьезных диагностических процедур. Идентификация причины ЭЭ – ключ к ее лечению, так как способов ограничить потерю белка с калом, не устраняя основной причины, практически нет. Принципиальное значение при ЭЭ имеет разграничение состояний, связанных с нарушением лимфоотока, и различных инфекционных и неинфекционных воспалительных заболеваний кишечника. Главным отличием ЭЭ на фоне нарушений лимфооттока является наличие в клинике помимо отеков и гипоальбуминемии, также стеатореи, лимфопении, гипогаммаглобулинемии, хилезного асцита, дефицита жирорастворимых витаминов.
Энтеропатии
Энтеропатии – это группа заболеваний, развивающихся при нарушении активности и полном отсутствии выработки определенных ферментов, которые участвуют в переваривании или всасывании различных компонентов пищи. Энтеропатии могут быть первичными (врожденными) или вторичными (приобретенными). Первичные формы носят наследственный характер, а их развитие обусловлено генетическими мутациями в одном или нескольких генах. Вторичные формы возникают при наличии воспалительных или дистрофических изменений в слизистом слое тонкой кишки. При прогрессировании патологических процессов в слизистой оболочке тонкого кишечника развиваются воспалительные изменения. В последующем на фоне хронического воспаления может возникать атрофия ворсинчатого слоя и эрозии слизистой.
По сравнению с другими гастроэнтерологическими заболеваниями, энтеропатии являются достаточно редкой патологией. Распространенность различных форм данной патологии весьма варьирует, достоверных эпидемиологических исследований по энтеропатиям в мире не проводилось. Изучением причин развития заболевания, разработкой новых диагностических и лечебных методов занимается гастроэнтерология.
Причины энтеропатий
Большинство причин энтеропатий хорошо известны и изучены. В частности, данная патология может возникать при непереносимости глютена, инфицировании патогенными бактериями, паразитами, грибами, приеме лекарственных препаратов (противовоспалительных средств, антибиотиков), участии пищевых аллергенов. Энтеропатии могут развиваться на фоне токсического и радиационного воздействия, патологии лимфовенозной и артериальной системы кишечника, заболеваний крови, эндокринной системы, болезней соединительной ткани, почек и иммунной сферы. Некоторые формы заболевания могут иметь наследственный характер. Например, целиакия, или глютеновая непереносимость, развивается при генетически обусловленном нарушении выработки ферментов для переваривания глютена в кишечнике. В результате при приеме злаковых продуктов, таких как рожь, пшеница и овес, у больного прогрессирует энтеропатия, сопровождающаяся диареей и нарушением переваривания в тонкой кишке.
Если удается четко установить причину заболевания, то в подавляющем большинстве случаев получается добиться полного выздоровления. При исключении патологического влияния этиологических факторов слизистая кишечника полностью восстанавливает свою структуру и функцию, что сопровождается ремиссией. Однако не все виды энтеропатий имеют четкую причину. Некоторые формы болезни протекают более тяжело и имеют худший прогноз. К подобным заболеваниям относятся коллагеновая спру, аутоиммунная энтеропатия, болезнь Крона, рефрактерная и гипогаммаглобулинемическая спру, гастроэнтерит эозинофильной этиологии, а также экссудативная и посттрансплантационная энтеропатия.
Из представленных выше болезней чаще всего встречается экссудативный вариант патологии тонкого кишечника, который может быть либо первичным, либо вторичным на фоне лимфангиоэктазии. Вторичная экссудативная энтеропатия развивается на фоне нарушения оттока лимфы в кишечнике, обусловленного онкологическими или воспалительными заболеваниями. Как правило, данная патология прогрессирует при поражении сосудов брюшной полости, недостаточности правого желудочка и болезни Уиппла.
Симптомы энтеропатий
Клиника энтеропатий, независимо от их этиологии, включает синдром хронической диареи и синдром нарушения всасывания. При наличии ферментопатии понос возникает на фоне употребления продуктов, к которым имеется непереносимость. При обострении кал приобретает жидкий и пенистый характер. В нем можно обнаружить непереваренные остатки пищи, а также большое количество жиров, белков и углеводов, которые не всосались в тонкой кишке. В зависимости от тяжести заболевания, частота дефекаций может колебаться от 5 до 15 раз в сутки.
Нарушение процессов всасывания (мальабсорбция) со временем приводит к поливитаминной недостаточности. При этом в большей степени нарушается усвоение жирорастворимых витаминов А, Е, D и К. Тяжелое течение заболевания сопровождается нарушением обмена электролитов, ухудшением белкового обмена. Также при энтеропатии может развиваться анемия вследствие недостаточной абсорбции железа в тонкой кишке. Поскольку при этой группе болезней затрудняется поглощение белков и жиров в кишечнике, человек теряет в весе вплоть до развития полного истощения. Боль при данной патологии выражена в незначительной степени, однако на фоне нарушения проходимости кишки именно она является ведущим клиническим синдромом. Болевые ощущения в основном локализуются в околопупочной области и носят эпизодический характер. Они связаны с периодическим спазмом гладкой мускулатуры тонкого кишечника.
Клиническая картина одной из наиболее распространенных врожденных энтеропатий, целиакии, не имеет характерных отличий. Все проявления заболевания возникают при употреблении в пищу злаковых продуктов, в состав которых входит пшеница, овес, рожь и ячмень. Симптомы глютеновой энтеропатии начинают беспокоить в раннем детстве, когда вводится злаковый прикорм. При переходе на диету, не содержащую глютена, происходит обратное развитие клинических проявлений.
Негранулематозная идиопатическая энтеропатия, которая не имеет четкой причины, обычно сопровождается выраженной болью в животе, отсутствием аппетита, снижением веса, повышением температуры, диареей с увеличением количества жиров в кале. Если энтеропатия возникает при артериовенозных аномалиях слизистой оболочки тонкой кишки, то в кале могут выявлять элементы крови. Экссудативная форма заболевания отличается учащенным обильным стулом с большим количеством слизи. Одной из наиболее тяжелых форм является энтеропатия, которая развивается на фоне Т-клеточной лимфомы. Эта серьезная патология проявляется выраженными отеками на фоне нарушения всасывания белков, которые не корригируются введением белковых компонентов.
Диагностика энтеропатий
Для диагностики энеропатий используются лабораторные и инструментальные методы обследования. Из лабораторных исследований проводятся общие и биохимические исследования крови. В клиническом анализе часто выявляется анемия со снижением уровня гемоглобина и эритроцитов. Анемия может быть как железодефицитной (микроцитарной), так и В12-дефицитной (макроцитарной). Эти изменения связаны с нарушением всасывания железа и витамина В12 в тонком кишечнике. Если в общем анализе крови обнаруживается повышение уровня лейкоцитов и ускорение СОЭ, то это часто говорит о воспалительном генезе заболевания.
Информативным также является биохимический анализ крови. При наличии воспалительных изменений отмечается повышение С-реактивного белка и фекального кальпротектина. Вследствие нарушения всасывания в кишечнике определяется снижение концентрации кальция, магния, хлора, калия, белка и холестерина в крови. В большей степени эти изменения наблюдаются при гипогаммаглобулинемической форме спру. При тяжелых формах энтеропатии выявляется снижение уровня альбуминов в биохимическом анализе крови. Для подтверждения специфических форм заболевания используются гистохимические методы исследования слизистой оболочки тонкой кишки.
Из инструментальных исследований используют рентгенографию тонкого кишечника с пассажем бария, которая играет важную диагностическую роль при наличии тяжелых поражений слизистой, например, при болезни Крона. С помощью данного исследования можно обнаружить крупные язвы, наличие сужений и свищей кишечника. Современной методикой обследования при энтеропатиях считается МСКТ органов брюшной полости, с помощью которой оценивают уровень поражения стенки кишечника и степень его выраженности. Важную информацию дает эндоскопия, во время которой визуализируются патологические изменения в слизистой, сужение просвета кишечника, сглаженность складок, а также наличие эрозивных и язвенных поражений. Все эти признаки не являются специфичными для какой-либо конкретной формы болезни. Высокоинформативным современным методом диагностики выступает видеокапсульная эндоскопия, позволяющая детально оценить состояние слизистой оболочки кишечника на всем протяжении.
Существенную роль играют специфические диагностические исследования, которые позволяют дифференцировать между собой различные формы энтеропатии. В частности, для постановки диагноза «целиакия» используются нагрузочные пробы с глиадином. При непереносимости глютена данная проба приводит к быстрому повышению уровня глутамина в крови. Важное значение в дифференциальной диагностике имеет биопсия слизистой оболочки тонкой кишки. Например, при целиакии отмечаются атрофические изменения слизистого слоя. Кроме того, диагностировать глютеновую энтеропатию поможет определение антител к трансглютаминазе. Для выявления аутоиммунной формы заболевания, помимо классических признаков, определяются антитела к энтероцитам. Кроме того, дифференцировать иммунную энтеропатию с целиакией поможет отсутствие ответа на аглютеновую диету.
Лечение энтеропатий
Лечение энтеропатий должно быть направлено в первую очередь на устранение причины, которая привела к возникновению болезни. Этиотропная терапия может быть использована только в том случае, если имеется конкретная причина развития заболевания. Важную роль играет правильно подобранная диета. Например, при целиакии необходимо исключить употребление продуктов, содержащих глютен, таких как пшеница, ячмень, овес и рожь. Их следует заменять рисом, бобовыми, картофелем, овощами, фруктами, мясом и рыбой. При аллергической энтеропатии рекомендуется исключение из рациона аллергенных продуктов. Для лечения болезни Уиппла требуется длительный прием антибиотиков. Терапия тропической спру и инфекционных форм заболевания проводится кишечными антибактериальными препаратами.
Патогенетическое лечение предусматривает коррекцию синдрома мальабсорбции. С этой целью используются ферментные препараты и эубиотики. Они позволяют нормализовать процессы пищеварения в тонком кишечнике и улучшить всасывание питательных веществ и микроэлементов. Больным с мальабсорбцией рекомендуется полноценное белковое питание, прием препаратов железа и кальция, а также употребление поливитаминных препаратов. При снижении уровня белка в крови необходимо внутривенное введение альбумина. Терапия энтеропатий без четкой этиологии предусматривает назначение противовоспалительных препаратов. При этих заболеваниях принимаются иммуносупрессоры, глюкокортикоиды и аминосалицилаты. Они оказывают особый эффект при болезни Крона и других аутоиммунных формах заболевания.
Профилактика энтеропатий заключается в использовании рациональной диеты и грамотном лечении заболеваний тонкого кишечника. В зависимости от формы заболевания прогноз может варьироваться от благоприятного при целиакии на фоне правильного лечения до неблагоприятного при энтеропатии, ассоциированной с Т-клеточной лимфомой.
Источник: http://www.krasotaimedicina.ru/diseases/zabolevanija_gastroenterologia/enteropathy
