Общая теория редокс-процессов. Окислительно- восстановительные процессы в организме.
Дата_________Лабораторная работа
Окислительно-восстановительные свойства веществ. Определение направления редокс-процесса.
Цель работы: Изучить окислительно-восстановительные свойства веществ. Научиться оценивать условия протекания окислительно-восстановительных реакций, прогнозировать направление процесса.
Оборудование и реактивы:Пробирки, газовая горелка. Растворы: серной кислоты, гидроксида натрия, бромида калия, иодида калия, сульфата меди, хлорида железа (III), перманганата калия, дихромата калия, иодата калия, уксусной кислоты (все по 0,1 моль/л); этанол, ацетон, формалин, щавелевая кислота.
Сущность работы:
Пользуясь величинами стандартных редокс-потенциалов, прогнозируют направление самопроизвольного протекания редокс процессов. Чем больше значение редокс–потенциала редокс–системы, тем выше ее окислительная способность, то есть тем сильнее окислитель и слабее сопряженный ему восстановитель.
Для определения направления самопроизвольного протекания редокс -процесса необходимо сравнить величины редокс - потенциалов двух редокс - систем. Окисленная форма той редокс-системы, потенциал которой больше, и будет выполнять роль окислителя в данном процессе. Разность потенциалов Dj = j(ox) - j(red) >0 свидетельствует, что процесс будет протекать самопроизвольно в прямом направлении.
Ход работы:
Отыт1. Определение направления редокс-процесса.
1. В две пробирки наливают по 0,5 мл раствора хлорида железа (III). В одну из них добавляют 10-15 капель иодида калия, в другую 10-15 капель раствора бромида калия.
Уравнения реакций:
Наблюдения:
Справочные данные: jro(Fe3+/Fe2+) = ____________
jro( Br2 /Br-) = ______________ jro( I2/I-) = _____________
Расчеты:
2. В пробирку наливают по 0,5 мл растворов иодата калия и иодида калия, затем добавляют по каплям раствор серной кислоты до изменения окраски раствора. Наблюдают образование иода. К полученному раствору добавляют по каплям 10% раствор гидроксида натрия до исчезновения окраски иода.
Уравнения реакций:
Наблюдения:
Справочные данные:
2IO3- + 6H2O + 10ē ® I2 + 12OH-, jro = +0,21B
2IO3- + 12H+ + 10ē ® I2 + 6H2O, jro = +1,19B
Расчеты:
Опыт 2. Окисление спиртов.
В пробирку помещают по 10 капель этанола и раствора дихромата калия, добавляют 5 капель серной кислоты. Нагревают полученный раствор над пламенем горелки до появления зелено-голубой окраски, одновременно ощущается характерный запах уксусного альдегида, напоминающий запах зеленых яблок.
Уравнения реакций:
Наблюдения:
Опыт 3. Окисление альдегидов.
В две пробирки наливают по 10 капель 10 % раствора гидроксида натрия, добавляют 5 капель раствора сульфата меди. К выпавшему голубому осадку гидроксида меди (II) добавляют в первую пробирку 10 капель раствора формальдегида, а во вторую – 10 капель ацетона.
Пробирки осторожно нагревают до кипения.
Уравнения реакций:
Наблюдения:
Опыт 4. Окисление щавелевой кислоты.
В первую пробирку помещают 1 лопатку щавелевой кислоты, во вторую – 0,5 мл раствора уксусной кислоты. В обе пробирки добавляют по 10 капель раствора перманганата калия и по 5 капель раствора серной кислоты. Нагревают обе пробирки над пламенем горелки.
Уравнения реакций:
Наблюдения:
Выводы
Задания для самостоятельной работы
1) В соответствии с общей схемой окисления тиолов в дисульфиды:
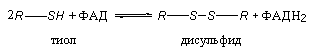
допишите реакцию окисления дигидролипоевой кислоты в липоевую:
 СН2
СН2
Н2С СН¾(СН2)4¾СООН ¾®


SH SH _______________________________
Липоевая кислота
2) Заполните схему окислительного дезаминирования a-аминокислот:
H
| НАД+ Н2О (Н+или ОН-)
R-C-COOH ¾¾¾¾® ¾¾¾¾®
| - НАДН _______________ __________________
NH2
a-аминокислотa a-иминокислотa a-оксокислотa
3) Заполните схемы:
НООС-СН-СН2-СООН + НАД+ ¾® + НАДН + Н+
| ________________________
ОН щавелевоуксусная
яблочная кислота кислота
НООС-СН2 -СН2-СООН + ФАД ¾® + ФАДН2
_____________________
янтарная кислота фумаровая кислота
Занятие 26 Гетероциклические соединения
Задания для самостоятельной работы
1) Приведите структурные формулы гетероциклических соединений:
__________________ ___________________ ____________________
пиррол тиофен фуран
____________________ ____________________
пиразол имидазол
_________________ ____________________ ____________________
пиридин пиримидин хинолин
_______________ ____________________ ____________________
цитозин урацил тимин
_________________ ___________________ ____________________
пурин аденин гуанин
______________________ _____________________________
ксантин барбитуровая кислота
2) Дайте определение понятия «ароматичность». Покажите соответствие критериям ароматичности следующих соединений:
| Соединение | Структурная формула | Соответствие критериям ароматичности |
| Салициловая Кислота | ||
| Нафталин | ||
| Никотиновая кислота | ||
| Гистамин | ||
| Аденин | ||
| 8-гидроксихинолин | ||
| Кофеин | ||
| Имидазол |
Занятие 27 Защита модуля 5 Биологически активные органические соединения неполимерного характера
Дата _________
Ф.И.О. _______________________ группа _______ Билет № ________
Занятие 28
