Определение изменения энтальпии химических реакций
Цель работы:изучить методы экспериментального определения изменения энтальпии важнейших химических процессов: растворения неорганических солей, реакции нейтрализации и осаждения труднорастворимого электролита.
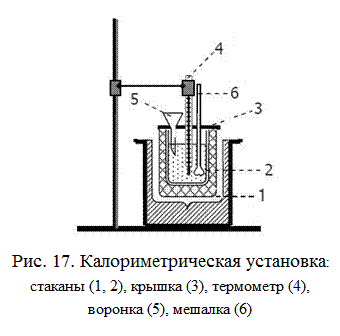 Для опытного определения изменения энтальпии химических процессов используют калориметры (рис. 17). Самый простой из них состоит из двух стаканов, вставленных один в другой. Калориметр закрывается крышкой с отверстиями для термометра с ценой деления 0,1о и воронки. В работе используется магнитная мешалка с металлическим перемешивающим устройством, масса которого известна до 0,1 г.
Для опытного определения изменения энтальпии химических процессов используют калориметры (рис. 17). Самый простой из них состоит из двух стаканов, вставленных один в другой. Калориметр закрывается крышкой с отверстиями для термометра с ценой деления 0,1о и воронки. В работе используется магнитная мешалка с металлическим перемешивающим устройством, масса которого известна до 0,1 г.
Измерение энтальпии химического взаимодействия, происходящего в калориметре, можно вычислить по эмпирической формуле:
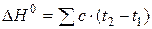
где t1 и t2 – начальная и конечная температуры жидкости в калориметрическом стакане; с – теплоемкость калориметра с веществами, равная
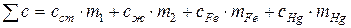 ,
,
где: сст, сж, сFe, cHg – удельные теплоемкости, a m1, m2, mFe, mHg – массы соответственно калориметрического стакана, жидкости в нем, перемешивающего устройства и ртути, находящейся в нижней части термометра. В зависимости от характера изучаемого процесса указанные формулы видоизменяются.
Каждая калориметрическая установка имеет свой инвентарный номер, который следует записать в лабораторный журнал. На калориметрическом стакане указана его точная масса в граммах. Остальные данные, необходимые для расчетов, приведены в табл. 1.
Таблица 1
| Стекло (стакан) | Жидкость (раствор) | Железо (мешалка) | Ртуть | |
| Уд. теплоемкость, Дж/кг-град | сст=750 | сж = 4180 | cFe = 446,34 | cHg = 139,95 |
| Масса, г | m1(на стакане) | m2 = масса (Н2О) + масса (в-ва) | mFе | mHg = 0,8 |
ОПЫТ № 1. Энтальпия растворения неорганических солей.
Изменение энтальпии, происходящее при растворении одного моля вещества в воде нетрудно измерить экспериментально, определив изменение температуры при растворении определенной массы вещества. Процесс растворения соли состоит из нескольких стадий: во-первых, при растворении должны быть разорваны химические связи между частицами, которые удерживают их вместе в кристаллической решетке в твердом состоянии. Эта реакция всегда эндотермическая,
т.е. DН°кр. реш. > 0. Во-вторых, образовавшиеся частицы, в случае электролитов — ионы, могут реагировать с молекулами воды, образуя новые химические связи, что является уже экзотермическим процессом; энтальпия этой реакции называется теплотой гидратации DН°гидр. < 0. В зависимости от соотношения DН°кр. реш и DН°гидр. растворение может быть как экзо-, так и эндотермическим процессом. Например, если растворяется хлорид натрия в воде, то этот процесс сопровождается результирующим поглощением энергии, т.е. является эндотермическим, что можно описать термохимическим уравнением:

DНораств. = +4,27 кДж/моль
Поэтому DНораств. часто называют интегральной теплотой растворения.
ВЫПОЛНЕНИЕ ОПЫТА. У преподавателя получите образец соли, энтальпию растворения которой предстоит определить. На технических весах взвесьте 5 г исследуемой соли. Во внутренний стакан калориметра налейте 100 мл дистиллированной воды, осторожно опустите в воду перемешивающее устройство и соберите калориметрическую установку. Через отверстие в крышке в воду поместите термометр так, чтобы он не касался перемешивающего устройства. Закрепите термометр на штативе и включите магнитную мешалку. В другое отверстие поместите СУХУЮ воронку. Перемешивание необходимо для выравнивания температуры, на что требуется несколько минут. С точностью до 0,1° запишите температуру воды – t1 °C.
При работающей мешалке через сухую воронку быстро, но так, чтобы не забилось отверстие воронки, высыпьте навеску соли в калориметрический стакан и отметьте самую высокую (или самую низкую) температуру раствора — t2 оС и запишите ее в лабораторный журнал. Изменение энтальпии растворения соли рассчитайте но эмпирической формуле:
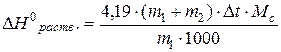 кДж/моль, где
кДж/моль, где
m1 – масса растворенной соли, г;
m2 – масса воды в калориметре, г;
Dt = t2 - t1 – изменение температуры;
Мс – молярная масса соли, г/моль.
Запишите термохимическое уравнение растворения соли.
Определите ошибку опыта в процентах, сравнив результат с теоретической интегральной теплотой растворения исследуемого вещества.
ОПЫТ №2. Определение изменения энтальпии реакции нейтрализации.
Согласно теории электролитической диссоциации, нейтрализация сильной кислоты сильным основанием в разбавленном растворе отвечает уравнению:
Н+(ж.) + ОН-(ж.) = Н2О(ж);
DН° = – 57,32 кДж/моль.
В опыте применяют обычно одномолярные растворы, причем равные объемы растворов кислоты и щелочи.
Получите у преподавателя задание и запишите в лабораторном журнале объемы и концентрации кислоты и щелочи. Во внутренний стакан калориметра налейте заданный объем 1М раствора щелочи и соберите калориметр как при выполнении предыдущего опыта. Поместите чистую воронку в отверстие крышки, включите магнитную мешалку и через несколько минут запишите температуру раствора щелочи tm °C с точностью до 0,1°.
Налейте в мерный цилиндр такой же объем 1М раствора кислоты и измерьте другим термометром с той же точностью температуру раствора кислоты – tK °C. Определите начальную температуру смеси: t1=0,5×(tm + tK). При работающей мешалке через воронку быстро (но аккуратно) влейте кислоту в калориметрический стакан и отметьте самую высокую температуру t2, которую покажет термометр после сливания растворов. Данные опыта запишите в виде таблицы:
1. Масса калориметрического стакана – m1;
2. Масса жидкости в нем: m2 = mк + mщ. (Плотность раствора принимается равной 1 г/мл).
3. Масса перемешивающего устройства – mFе;
4. Масса ртути в термометре – mHg;
5. Температура раствора кислоты – tK;
6. Температура раствора щелочи – tщ;
7. Начальная температура t1=0,5×(tm + tK);
8. Конечная температура Dt =t1 - t2.
Расчет изменения энтальпии реакции нейтрализации DН°нейтр. можно выполнить по формуле:
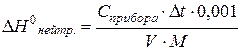 кДж/моль, где
кДж/моль, где
V – объем кислоты, л;
М – молярная концентрация кислоты, моль/л;
Сприбора – теплоемкость прибора.
Сприбора = m1×сст + m2×сж + mFe×сFe + mHg×сHg.
Расшифровка и величины для расчета в таблице №1.
Теплоемкость прибора проще рассчитывать по эмперической формуле: Сприбора = m1×сст + m2×сж + 3,5; поскольку опытным путем установлено, что произволение массы перемешивающего устройства и ртути на их теплоемкости не превышает 3,5. При расчете Сприбора помните: m1, m2, mFe, mHg следует брать в кг!
Определите ошибку опыта в процентах, сравнив полученный результат с теоретическим изменением энтальпии
DН°нейтртеор.= -57,32 кДж/моль.
ОПЫТ№ З. Определение изменения энтальпии осаждения труднорастворимого электролита.
Труднорастворимое вещество - сульфат бария можно получить сливанием растворов сульфата натрия и хлорида бария. В ионном виде процесс можно представить термохимическим уравнением:
Ва2+(водн.) + SО42-(водн.) = BaSO4(кр.); DНо = - 19,13 кДж/моль.
Для опыта используйте реактивы - Na2SO4×10H2O и ВаСl2×2Н2О. Составьте уравнение реакции и рассчитайте массы сульфата натрия и хлорида бария, необходимые для осаждения приблизительно 10 г сульфата бария. При расчете следует учесть, что исходные вещества - кристаллогидраты, содержащие 10 и 2 молекулы воды (табл 2.).
Таблица 2
| Вещество | Na2SO4×10H2O | ВаСl2×2Н2О | Na2SO4 | ВаСl2 |
| m, г/моль | 322,19 | 244,28 | 142,04 | 208,25 |
Массу сульфата натрия целесообразно взять с избытком 5%.
Рассчитанные массы взвесьте на технических весах, массы запишите. В стакан емкостью 200 мл налейте дистиллированной воды и растворите в ней сульфат натрия, перемешивая стеклянной палочкой. Растворение кристаллогидрата сульфата натрия сопровождается разогревом, поэтому раствор необходимо выдержать, чтобы он остыл. В раствор опустите термометр и измерьте температуру. Желательно, чтобы она не превышала комнатную более чем на 2 - 3 градуса. Температуру запишите.
Для приготовления раствора хлорида бария в калориметрический стакан налейте 75 мл воды и растворите навеску реактива, затем осторожно положите перемешивающее устройство и, собрав калориметрическую установку, включите магнитную мешалку. После установления постоянной температуры раствора хлорида бария запишите ее. При работающей мешалке влейте через воронку раствор сульфата натрия в калориметр и отметьте максимальную температуру смеси после прохождения реакции.
Данные опыта запишите по форме:
1. Масса калориметрического стакана – m1, (кг);
2. Масса жидкости – m2 = m3 +m4 + m5, (кг) ;
3. Масса хлорида бария – m3;
4. Масса сульфата натрия – m4;
5. Общая масса воды – m5;
6. Масса перемешивающего устройства – mFe, (кг) ;
7. Масса ртути в термометре – mHg = 0,008 кг;
8. Температура раствора сульфата натрия – t';
9. Температура раствора хлорида бария – t";
10. Начальная температура t1 =0,5×(t' + t");
11. Изменение температуры Dt =t1 - t2.
Изменение энтальпии осаждения сульфата бария может быть рассчитано по формуле
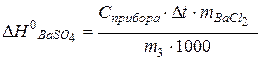 кДж/моль
кДж/моль
Сприбора имеет другое значение, поскольку массы веществ иные, чем в опыте № 2.
Сприбора = m1×сст + m2×сж + mFe×сFe + mHg×сHg.
Часть данных в таблице №1. При расчете помните, что m1, m2, mFe, mHg в кг!
Рассчитайте относительную погрешность опыта в процентах, сравнив  с теоретическим значением энтальпии осаждения сульфата бария, равным DН°нейтртеор.= - 19,13 кДж/моль.
с теоретическим значением энтальпии осаждения сульфата бария, равным DН°нейтртеор.= - 19,13 кДж/моль.
Приведите в порядок свое рабочее место. Взвесь сульфата бария - в раковину не выливайте!
В лабораторном журнале приведите эскиз калориметрической установки.
Контрольные вопросы
1. Исходя из стандартной энтальпии образования газообразного CO2 и термохимического уравнения
C(графит) + 2N2O(г) = CO2(г) + 2N2(г); DН°298 = - 557,5 кДж
Вычислить энтальпию образования N2O
2. Не производя вычислений, указать, для каких из перечисленных процессов изменение энтропии положительно:
а) MgO(к) + H2(г) = Mg(к) + H2O(ж);
б) C(графит) + СO2(г) = 2CO(г) ;
3. В каком из следующих случаев реакция возможна при любых температурах:
а) DН° > 0, DS° > 0;
б) DН° > 0, DS° < 0;
в) DН° < 0, DS° > 0;
г) DН° < 0, DS° < 0.
Лабораторная работа № 6
КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов - природы реагирующих веществ, концентрации, температуры, наличия катализатора, а также исследование влияния концентрации на положение химического равновесия.
