Тема 7. Последовательные реакции и их общие закономерности
7.1. Кинетика последовательных реакций
Последовательные реакции встречаются в органической технологии еще чаще, чем параллельные, и являются главной причиной образования побочных продуктов и снижения селективности. Их можно подразделить на две группы:
собственно последовательные реакции с разными реагентами на каждой стадии (1) и последовательно-параллельные реакции с общим реагентом во всех стадиях (2). Иногда вторые реагенты может отсутствовать. Каждому реагенту и продукту последовательных реакций соответствует свое кинетическое уравнение:
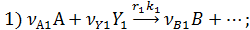 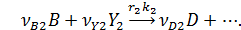 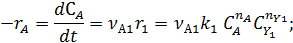 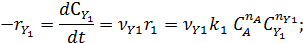 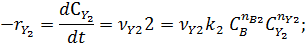 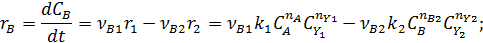 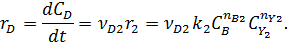 |
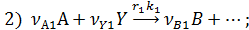 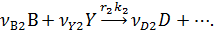 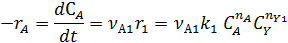 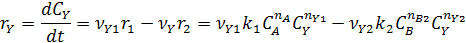 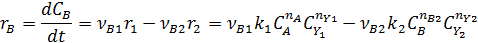 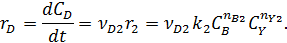 |
Реагенты А и Y расходуются во время реакции. Графически в координатах С‒t их кинетические уравнения изображаются падающими кривыми (рис. 7.1).
Промежуточный продукт В образуется на первой стадии и расходуется на второй. Скорость первой реакции снижается по мере расходовании реагентов, а скорость второй растет по мере накопления продукта В. Поэтому образование продукта В постепенно замедляется, а при 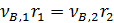 производная становится равной нулю и появляется максимум с последующим снижением концентрации продукта В (рис.7.1). Такие же максимумы характерны для всех промежуточных продуктов последовательных реакций.
производная становится равной нулю и появляется максимум с последующим снижением концентрации продукта В (рис.7.1). Такие же максимумы характерны для всех промежуточных продуктов последовательных реакций.
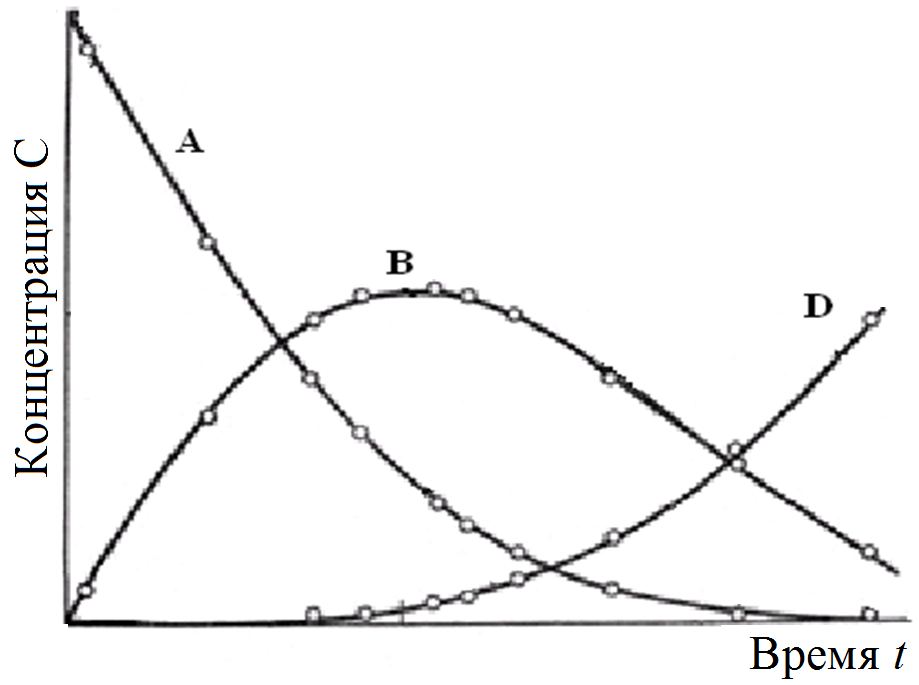 | Рис. 7. 1. Кинетические кривые последовательных реакций 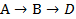 |
Для конечного продукта D, образующегося только на одной стадии, но не расходуемого при дальнейших превращениях, в координатах С‒t соответствует возрастающей кривой, так как вещество D во время реакции постепенно накапливается. При t = 0 скорость rD = 0, но затем продукт D по мере накопления продукта В начинает образовываться с ускорением, типичным для автокаталитических реакций.
7.2. Качественный анализ состава реакционной смеси.
Рассмотрим два способа проведения фотохимического процесса:
1) вся масса, содержащаяся в реакторе, непрерывно освещается;
2) часть массы отбирается из реактора в виде небольшого потока и непрерывно пропускается через колонку, в которой подвергается действию света, и затем возвращается обратно в реактор.
Скорость поглощения световой энергией в обоих случаях одинакова. По ходу процесса вещество А переходит в продукты реакции.
Необходимо ответить на вопрос о том, одинаково ли соотношение продуктов В и D в каждый момент времени при указанных способах проведения процесса.
При первом способе освещение прежде всего воздействует только реагент А, так как в начале процесса в реакторе содержится лишь это вещество. В результате образуется продукт В. На следующей этапе процесса свет действует и на исходное вещество, и продукт В. Однако, поскольку реагент А содержится в избытке, большая доля энергии поглощается исходным веществом, которое переходит в продукт В, вследствие чего его концентрация возрастает.
Процесс продолжается до тех пор, пока концентрация продукта В не увеличится настолько, что он начнет поглощать больше энергии, чем исходное вещество. В данный момент концентрация продукта В достигнет максимума. После этого превращение продукта В в продукт D будет протекать быстрее, чем его образование из реагента А, и следовательно, концентрация продукта В в массе снизится. Типичные кривые изменения концентраций реагента А, продуктов В и D в реакционной массе в ходе реакции показаны на рис. 7.2.
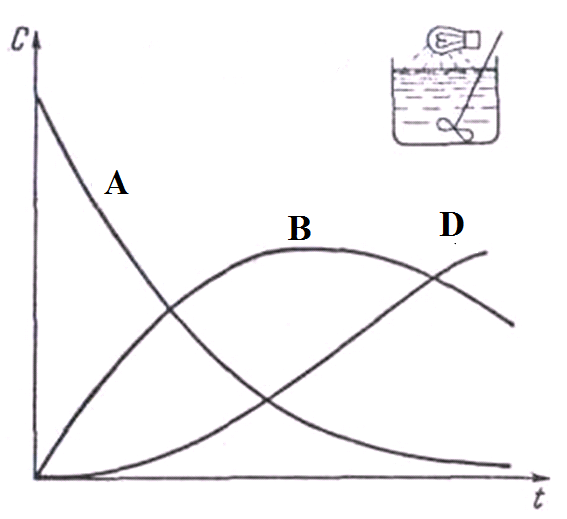 | Рис. 7.2. Кривые изменения концентраций веществ в реакторе периодического действия при непрерывном освещении всей реакционной массе |
При втором способе полная величина поглощенной энергии равна соответствующей величине энергии при непрерывном освещении всей реакционной массы. Однако при относительно небольших скоростях протекания жидкости через колонку, интенсивность облучения массы больше, и, следовательно, процесс химического превращения протекает значительно глубже.
Поэтому из реактора в колонку поступает реагент А, а выходит продукт D. Таким образом, концентрация реагента А в реакторе непрерывно снижается, а концентрация продукта D возрастает, причем промежуточный продукт в реакторе практически отсутствует. Типичные кривые изменения концентраций реагента А, продуктов В и D в реакторе при освещении части реакционной массы представлены на рис.7.3.
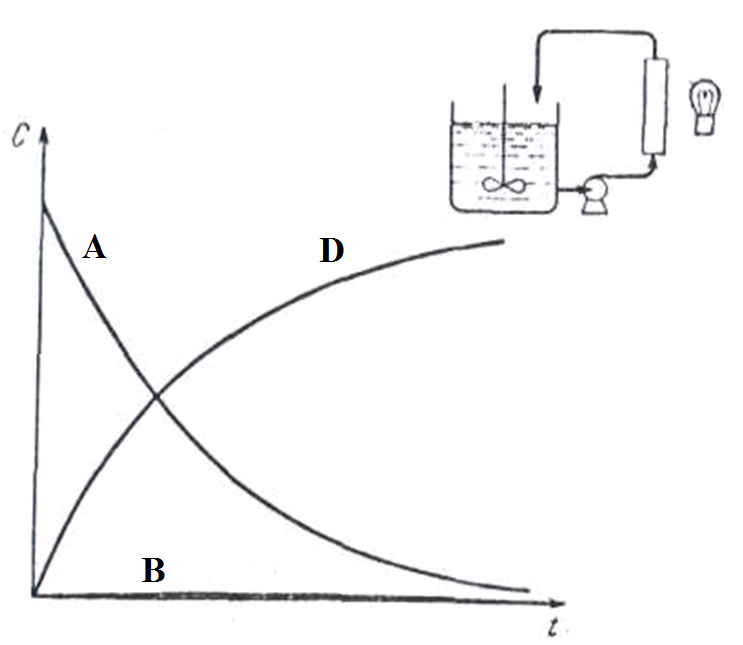 | Рис. 7.3. Кривые изменения концентраций веществ в реакторе периодического действия при освещении части реакционной массы, непрерывно проходящей перед осветителем |
Описанные способы осуществления процесса дают предельно различные соотношения продуктов реакции: максимальную концентрацию промежуточного продукта, в первом случае, и минимальную ‒ во втором. При первом способе мгновенный состав реакционной массы одинаков во всем объеме реактора и может изменяться вовремени; при втором же способе поток прореагировавшего вещества непрерывно смешивается с исходным веществом.
Таким образом, можно сформулировать следующий основной принцип управления составом продуктов, полученных в результате последовательных реакций. Для данной степени превращения реагентов максимальное количество промежуточного продукт образуется при однородности смеси по составу в каждый момент времени или при отсутствии смешения порций реакционной массы с различной степенью превращения реагентов. Другой путь процесса приводит к низкому выходу промежуточного продукта и в пределе дает возможность проводишь процесс вообще без его заметного присутствия.
Поскольку часто именно промежуточный продукт является целевым, изложенный принцип позволяет правильно выбрать тип реактора.
Теперь можно дать сравнительную оценку эффективности различных способов организации процесса. ИПР и РИВ обеспечивают максимальный выход промежуточного продукта В, поскольку в этих реакторах не происходит смешения потоков с различными концентрациями веществ, участвующих в реакциях. В РИС нельзя получить сколько-нибудь высокий выход промежуточного продукта В, так как исходный поток реагентов постоянно смешивается с продуктами реакции. Приведенный ниже пример иллюстрирует эти положения.
Пример 1. Для каждой из трех пар аппаратов, показанных на рис. 7.4, выбрать способ проведения процесса, обеспечивающий получение по реакции
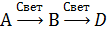
максимальной концентрации промежуточного продукта В, и кратко пояснить преимущества выбранного способа. Во всех случаях принимается одна и та же степень конверсии реагента А,
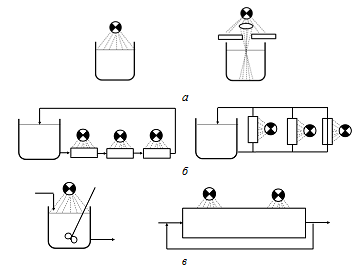 Рис. 7.4. К примеру 1. Рис. 7.4. К примеру 1. | Решение Схема «а». Для относительно медленных реакций каждый из этих двух аппаратов удовлетворительно обеспечивает максимальную концентрацию продукта В. Для быстро протекающих реакций, особенно при плохом смешении, концентрация продукта В в луче света (второй реактор) может значительно отличаться от концентрации, получаемой внеосвещенной части реактора. Вследствие такой неоднородности состава выход промежуточного продукта окажется ниже, чем впервом реакторе. |
Схема «б». Для реакции настолько медленных, что количество исходного вещества, превращаемого в течение одного прохода через выносное устройство, очень мало, каждый из этих двух реакторов является удовлетворительным. Однако для более быстрых реакций второй аппарат предпочтительнее потому, что указанное количество превращаемого реагента приблизительно втрое меньше, чем в первом реакторе. При смешении потоков, выходящих из освещаемых элементов, с реакционноймассой концентрации веществ в этих потоках отличаются незначительно.
Схема «в». Для оценки данной пары реакторов рассмотрим сначала влияние рецикла на работу реактора идеального вытеснения. При отсутствии рецикла смешения потоков с различными концентрациями продуктов реакции не происходит. Поэтому в реакторе обеспечивается максимальный выход промежуточного продукта В. По мере увеличения рециркулируемого количества реакционной массы аппарат приближается к проточному реактору идеального смешения и, следовательно, процесс в таком аппарате протекает с низким выходом промежуточного продукта. Таким образом, в описываемой паре реакторов более предпочтительным является второй аппарат без рецикла.
7.3. Селективность последовательных реакций
При общей схеме последовательных реакций
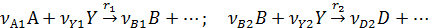
дифференциальная селективность превращения реагента А в промежуточной продукт В равна:
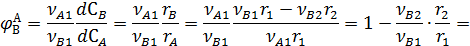

Из уравнения (7.1) видно, что дифференциальная селективность по промежуточному продукту зависит от концентраций реагентов и промежуточного продукта, а также от порядков прямой и побочной реакций.
Рассмотрим влияния на селективность начальной концентрации реагентов.
1. При отсутствии второго реагента
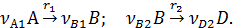
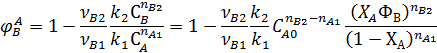
Следовательно, при прочих равных условиях для повышения селективности надо увеличивать концентрацию СА0 при nА1>nВ2 и снижать СА0 при nА1<nВ2.
Если nА1 = nВ2, то концентрация СА0 не влияет на селективность.
2. При одинаковых вторых реагентах
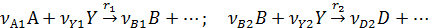
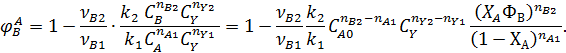
Обозначим мольное соотношение реагентов в исходной смеси через 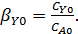
Учитывая, что 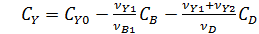 , получаем
, получаем
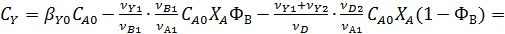
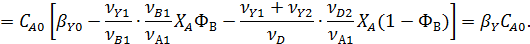
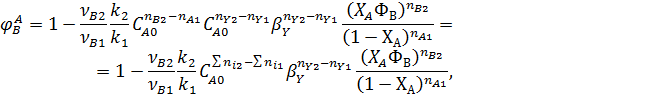
где 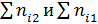 ‒ сумма порядков побочной и основной реакции соответственно.
‒ сумма порядков побочной и основной реакции соответственно.
Селективность последовательной реакции с участием 2-х одинаковых реагентов зависит от начальной концентрации реагента Aв степени равной разнице суммарных порядков побочной и основной реакции и, кроме того, от текущего мольного соотношения реагентов в степени равной разнице порядков побочной и основной реакции по второму реагенту.
Если nY2 = nY1, то 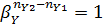 и селективность не зависит от мольного соотношения реагентов.
и селективность не зависит от мольного соотношения реагентов.
Если nY2 < nY1, то при увеличении βY0 значение 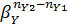 убывает и, следовательно, селективность возрастает при возрастании мольного соотношения реагентов βY0 в исходной смеси.
убывает и, следовательно, селективность возрастает при возрастании мольного соотношения реагентов βY0 в исходной смеси.
Если nY2 > nY1, то при увеличении βY0 значение 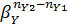 возрастает, а селективность уменьшается.
возрастает, а селективность уменьшается.
3. При разных вторых реагентах
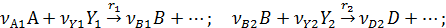
или 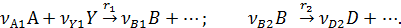
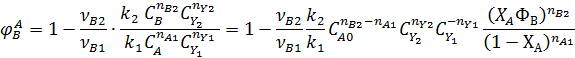
В данном случае селективность зависит от концентрации реагентов. При прочих равных условиях для повышения селективности надо увеличивать концентрацию реагента А при nA1 > nВ2, и снижать при nA1 < nВ2. Если же порядки реакций одинаковы nA1 = nВ2, то концентрация реагента А не влияет на селективность. При увеличении концентрации второго реагента Y1, участвующего в целевой реакции, селективность возрастает, а при увеличении концентрации второго реагента Y2, участвующего в побочной реакции, селективность убывает.
Например, при парофазном синтезе ацетальдегида из ацетилена

протекает побочная реакция образования кротонового альдегида:

Дифференциальная селективность превращения ацетилена в ацетальдегид выражается уравнением:
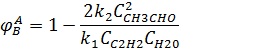
из которого видно, что применения избытка водяного пара способствует повышению селективности продукта В.
Следовательно, при последовательных реакциях для повышения селективности можно повышать начальную концентрацию того реагента, который участвует только в целевой реакции или по которому она имеет более высокий порядок, чем побочная реакция.
С другой стороны, селективность по ацетальдегиду увеличивается при снижении концентрации ацетальдегида или снижению степени конверсии ацетилена.
Сильное влияние на селективность степени конверсии реагента является характерным для последовательных реакций. При ХА→0 селективность по первому промежуточному продукту В равна 1, т.к. в смеси отсутствует продукт В и поэтому скорость r2 = 0. При ХА→1 селективность по первому промежуточному продукту В стремиться к нулю.
Для подтверждения этого решим уравнение (7.1) для РИС, когда вторые реагенты отсутствуют и все стехиометрические коэффициенты равны 1( nА1 = nВ2 = 1).
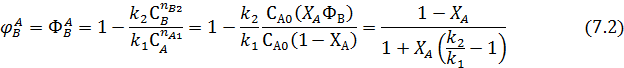
Из полученного выражения видно, что при ХА=0 ФВ = 1, при ХА=1 ФВ =0. Это справедливо для любых типов реакторов и любых последовательных реакциях.
Решая уравнение (7.5) при различных соотношениях констант скоростей последовательных реакций получим кривые, представленные на рис.7.5.
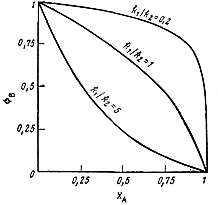 | Рис. 7.5. Зависимость селективности последовательных реакций первого порядка по продукту В от степени конверсии реагента А |
Чем больше отношение k2/k1, тем более резко падает селективность с увеличением степени конверсии, что во многом определяет выбор ХА для определенной системы реакции. Очевидно, что при k2/k1<< 1, допустима высокая степень конверсии, а при k2/k1>1 она должна быть низкой.
Как правило, степень конверсии регулируют временем реакции или условным временем контакта.
7.4 Исследование кинетики последовательных реакций
Методика исследования последовательных реакций остается прежней и состоит в постановке ряда опытов с варьированием всех необходимых параметров процесса (Сi.0; Р i.0 ,t или V/FA,0)вначале при постоянной температуре, чтобы выявить концентрационную форму кинетических уравнений и соответствующие зависимости в составе продуктов и селективности.
При необратимых последовательных реакциях наиболее просто найти кинетическое уравнение и его параметры для первой стадии процесса, так как расходование вещества А подчиняется кинетике простой реакции.
Рассмотрим двух стадийную систему последовательных реакций, протекающих без изменения объема:
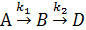 ,
,
кинетика которой описывается уравнениями (1-2)



В ИПР реагент А расходуется по уравнению:
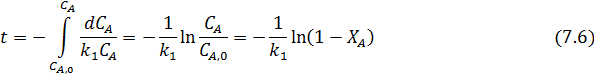
В РИВ имеем:
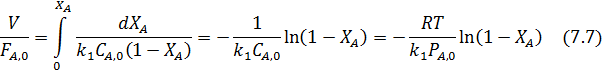
По уравнениям (7.6 и 7.7) из экспериментальных данных легко найти константу k1, что дает возможность математического выражения одной из составляющих материального баланса:
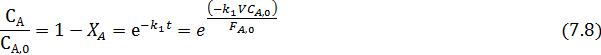
Уравнение (7.8) соответствует постепенному расходованию исходного реагента А, линейно зависящему от степени конверсии, и экспоненциально ‒ от t или V/FA,0. При этом все точки укладываются на одну кривую, когда по оси абсцисс откладывают k1t или (k1VCA,0)/FA,0.
Рассмотрим теперь закономерности для первого промежуточного продукта В необратимой последовательности реакции.
Подстановка выражение (7.8) в дифференциальное уравнение скорости реакции (2) приводит к уравнению

При интегрировании уравнения (7.9) при начальных условиях СА= СА0, СВ = 0, t = 0 получаем зависимость накопления продукта В во времени.

или
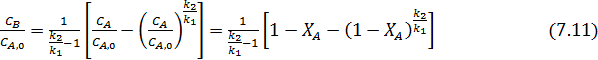
Из уравнения (7.11) видно, что при ХА= 0 и ХА= 1 СВ/СА,0= 0, что говорит о наличии максимума. Его положение можно найти приравнивая к нулю производную
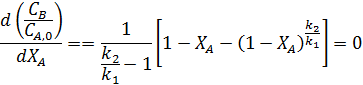
Отсюда находим степень конверсии 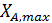 , при которой достигается максимум СВ/СА0.
, при которой достигается максимум СВ/СА0.

Поскольку 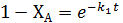 , то время
, то время 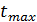 , при котором достигается максимум СВ/СА0:
, при котором достигается максимум СВ/СА0:

Подставляя XA,max в уравнение (7.11), получаем значение максимума Св/СA,0

На рис. 7. 6 приведены кинетические кривые последовательной реакции для промежуточного продукта В при различных значениях k2 /k1. Эти кривые наглядно показывают, как с увеличением k2 /k1 точка максимума выхода промежуточного продукта смещается к началу координат и выход его уменьшается.
В начальный период процесса скорость образования промежуточного продукта В больше скорости его расходования, поэтому при малых временах контакта концентрация и соответственно выход промежуточного продукта В увеличивается. При t max скорости образования и расходования промежуточного продукта В становятся равными, концентрация (выход) его достигает максимума и затем снижается. Соответственно дифференциальная селективность процесса по промежуточному продукту в начальный период положительна (вещество B образуется); при t max она равна нулю и при больших временах контакта в РИВ и ИПР имеет отрицательное значение.
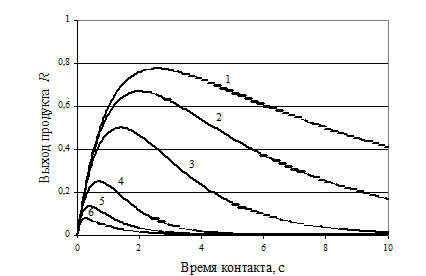
Рис. 7.6. Кинетические кривые накопления промежуточного продукта для последовательной реакции при различных отношениях констант скорости расходования ( k2 ) и образования ( k1 =1,0 с-1) k2 /k1 =1 - 0,1; 2 - 0,2; 3 - 0,5;4 – 2,0; 5 - 5,0; 6 -10,0.
Полученные уравнения легко использовать для вывода уравнения интегральной селективности по первому промежуточному продукту для ИПР и РИВ:
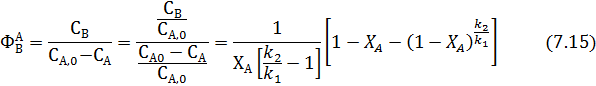
Пример 2. При изучении в периодических условиях эпоксидирования аллилового спирта в водном растворе при катализе вольфраматной кислотой H2WO4
 при постоянной концентрации канализатора и температуре были получены следующие результаты (моль/л):
при постоянной концентрации канализатора и температуре были получены следующие результаты (моль/л):
| CA,0=CY,0 | t=10 мин | t=20 мин | t=40 мин | t=60 мин | t=100 мин | |||||
| СА | СВ | СА | СВ | СА | СВ | СА | СВ | СА | СВ | |
| 0,5 | 0,436 | 0,065 | 0,373 | 0,12 | 0,27 | 0,21 | 0,202 | 0,265 | 0,107 | 0,325 |
| 0,3 | 0,253 | 0,038 | 0,221 | 0,082 | 0,165 | 0,133 | 0,121 | 0,159 | 0,064 | 0,194 |
Найти уравнения кинетики, состава продуктов и селективности, положение и величину максимума в содержании глицидилового спирта.
Решение
В соответствии с механизмом реакции первая стадия включает быстрое образование надвольфрамовой кислоты и последующее медленное эпоксидирование аллилового спирта:

Можно ожидать, что при постоянной концентрации катализатора первая стадия имеет первый порядок по аллиловому спирту. Поэтому обрабатываем данные для СА по уравнению (2) табл. 5.1.
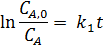
Методом наименьших квадратов находим k1= 0,0153 ± 0,0007 мин-1.
Вторая стадия образования глицерина в водном растворе также имеет первый порядок по глицидиловому спирту, что позволяет воспользоваться уравнением (7.11). Поскольку оно неразрешимо для отношения k2/k1находим эту величину путем подбора на вычислительной машине. Это дает среднее значение k2/k1= 0,203 ± 0,02, откуда:
k2 = 0,0153 · 0,203 = 0,0031 ± 0,0003 мин
Таким образом, имеем уравнения скорости:
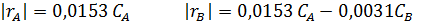
Уравнения состава продуктов
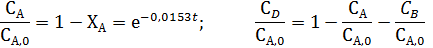
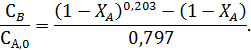
Селективность по продукту В
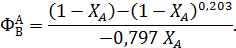
Максимум мольной доли глицидилового спирта
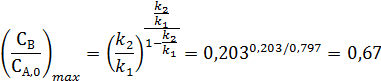
может быть достигнута при степени конверсии аллилового спирта равной
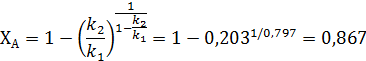
Соответствие опытных и рассчитанных по найденным уравнениям значений 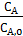 и
и 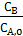 свидетельствуют об адекватности выведенной модели.
свидетельствуют об адекватности выведенной модели.
Вопросы для самопроверки
1. Выведите кинетическое уравнение для последовательных реакций с разными реагентами на всех стадиях.
2. Обоснуйте основной правило о составе смеси продуктов последовательных реакций.
3. Проанализируйте влияние на селективность промежуточного продукта В степени конверсии реагента А при последовательных реакциях.
4. Выведите уравнение дифференциальной селективности для первого промежуточного продукта В последовательных реакций.
5. Расскажите последовательность исследования кинетики последовательной реакции 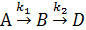 .
.
6. Жидкофазная реакция 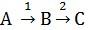 протекает в непрерывном РИВ объемом V = 1,8 м3 без изменения плотности реакционной массы. Константы скорости k1 = 0,0016 c –1; k2 = 0,0024 c –1.
протекает в непрерывном РИВ объемом V = 1,8 м3 без изменения плотности реакционной массы. Константы скорости k1 = 0,0016 c –1; k2 = 0,0024 c –1.
Определить степень конверсии реагента А, при которой наблюдается максимальная относительная концентрация продукта Bна выходе из реактора; скорость подачи вещества Aв реактор при этих условиях.
7. В РИВ объемом V = 1,8 м3 проходит реакция
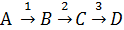
Константы скорости реакций (c –1): k1 = 0,0016; k2 = 0,0024; k3=0,0008.
На входе в реактор концентрации веществ B,C и Dравны нулю. Изменения плотности реакционной массы не происходит.
Определить максимальную относительную концентрацию продукта C; степень превращения исходного вещества Аи скорость подачи вещества Aв реактор при этих условиях.
