Частичный дефицит спектрина
Наследственный сфероцитоз (болезнь Минковского-Шоффара).
Наследственный сфероцитоз (НС) (болезнь Минковского-Шоффара) — генетическое заболевание, сопровождающееся гемолизом различной интенсивности, снижением осмотической резистентности эритроцитов (нормальная максимальная осмотическая резистентность эритроцитов составляет 0.34— 0,32 %), сфероцитозом, спленомегалией и желтухой. Наследственный сфероцитоз передается по аутосомно-доминантному типу. Как правило, у 1-го из родителей выявляют признаки гемолитической анемии. Возможны спорадические случаи заболевания (в 25%), представляющие собой новейшие мутации. Является широко распространенным заболеванием (2-3 случая на 10000 населения) и встречается у лиц большинства этнических групп, однако чаще болеют жители северной части Европы.
Этиология наследственного сфероцитоза.
Аутосомно-доминантное наследование.
Повышенная деструкция эритроцитов является результатом дефицита или патологии одного, либо нескольких белков мембраны эритроцитов.
Структурные и метаболические нарушения эритроцитов при наследственном сфероцитозе:
1. Дефект мембраны:
1.1. Частичный дефект спектрина
1.2. Комбинированный дефект спектрина и анкирина
1.3. Частичный дефект цепи протеина 3
1.4. Дефицит протеина 4.2 и другие дефекты
2. Измененные свойства мембраны эритроцитов:
2.1. Потеря клеточной поверхности
2.2. Изменения липидов мембраны
2.3. Изменение содержания кальция
2.4. Изменения структуры белков мембраны
2.5. Повышение содержания мембран-связанной каталазы Hb
2.6. Нарушение фосфорилирования белков
2.7. Дефект белковой агрегации
2.8. Дефект присоединения протеина 4.1
3. Изменение клеточного катаболизма
3.1. Повышение проницаемости натрия
3.2. Усиление гликолиза
3.3. Сниженный транспорт фосфоенолпирувата
В патогенезе наследственного сфероцитоза бесспорны 2 положения:
1. Наличие генетически детерминированной аномалии белков, или спектринов, мембраны эритроцитов;
2. Элиминирующая роль селезенки в отношении сфероидальноизмененных клеток.
Классификация.
1. По течению:
- хроническое – характеризуется обострениями (кризами) и ремиссией – клинической и клинико-гематологической;
- латентное – течение субклиническое за счёт компенсаторных реакций костного мозга;
- гемолитические кризы (регенераторные - с нормальной реакцией костного мозга) и (арегенераторные - с истощением компенсаторных возможностей).
2. По степени тяжести:
- легкая форма – гемолиз и спленомегалия выражены умеренно; уровень спектрина 75-90% от нормы;
- среднетяжелая форма – умеренная анемия + желтуха + спленомегалия; уровень спектрина 35-50%;
- тяжелая – тяжелая анемия + желтуха + спленомегалия, костные деформации, задержка физического развития; уровень спектрина менее 35%, больные трансфузионно-зависимы.
У всех пациентов с НС отмечен дефицит спектринов в эритроцитарной мембране, а у некоторых - нарушение их функциональных свойств, причем установлено, что степень дефицита спектрина может коррелировать с тяжестью заболевания.
Двояковогнутая форма эритроцитов имеет большую площадь поверхности по сравнению с клетками сферической формы такого же размера. Это облегчает газообмен между клеткой и внеклеточной средой. Кроме того, такая форма, а также особенности строения мембраны и цитоскелета обеспечивают большую пластичность эритроцитов при прохождении ими мелких капилляров.
Важную роль в сохранении формы и способности к обратимой деформации эритроцитов играют липиды и белки плазматической мембраны.
Методом электрофореза в мембране эритроцитов обнаруживают около 15 основных мембранных белков с молекулярной массой от 15 до 250 кД. Около 60% массы мембранных белков приходится на спектрин, гликофорин и белок полосы 3 (называется так по расположению этой белковой фракции на электрофореграмме относительно других белков). Интегральный гликопротеин гликофорин присутствует только в плазматической мембране эритроцитов (рис. 1). К N-концевой части белка, расположенной на наружной поверхности мембраны, присоединено около 20 олигосахаридных цепей. Олигосахариды гликофорина - антигенные детерминанты системы групп крови АВО.
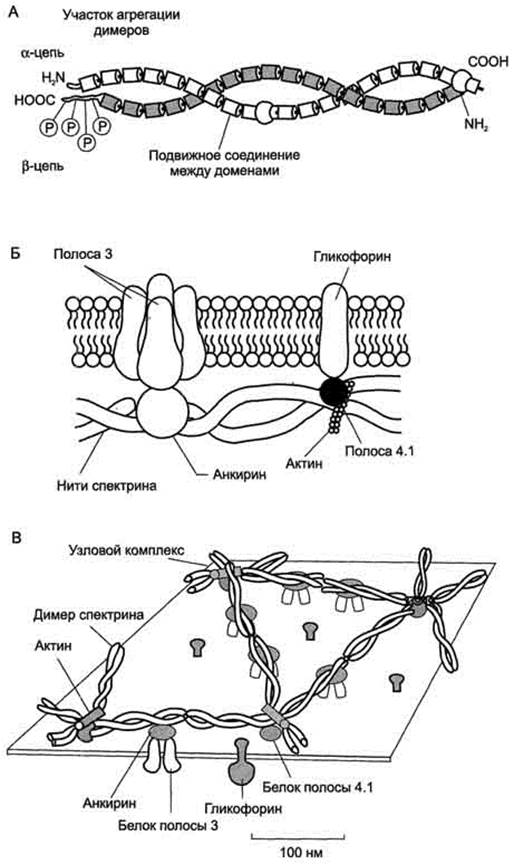
Рис. 1. Строение спектрина (А), околомембранного белкового комплекса (Б) и цитоскелета эритроцитов (В). Каждый димер спектрина состоит из двух антипараллельных, нековалентносвязанных между собой α- и β-полипептидных цепей (А). Белок полосы 4.1 образует со спектрином и актином "узловой комплекс", который посредством белка полосы 4.1 связывается с цитоплазматическим доменом гликофорина. Анкирин соединяет спектрин с основным интегральным белком плазматической мембраны - белком полосы 3 (Б). На цитоплазматической поверхности мембраны эритроцита имеется гибкая сетеобразная структура, состоящая из белков и обеспечивающая пластичность эритроцита при прохождении им через мелкие капилляры (В).
Спектрин - периферический мембранный белок, нековалентно связанный с цитоплазматической поверхностью липидного бислоя мембраны. Он представляет собой длинную, тонкую, гибкую фибриллу и является основным белком цитоскелета эритроцитов. Спектрин состоит из α- и β-полипептидных цепей, имеющих доменное строение; α- и β-цепи димера расположены антипараллельно, перекручены друг с другом и нековалентно взаимодействуют во многих точках. Спектрин может прикрепляться к мембране и с помощью белка анкирина. Этот крупный белок соединяется с β-цепью спектрина и цитоплазматическим доменом интегрального белка мембраны - белка полосы 3. Анкирин не только фиксирует спектрин на мембране, но и уменьшает скорость диффузии белка полосы 3 в липидном слое. Таким образом, на цитоплазматической поверхности эритроцитов образуется гибкая сетевидная структура, которая обеспечивает сохранение их формы при прохождении через узкие капилляры сосудов.
Считается, что основными функциями мембранного цитоскелета является поддержание формы клеток и обеспечение их устойчивости к деформации, а также контроль латеральной диффузии интегральных мембранных белков. В последние годы получены данные о том, что мембранный цитоскелет может использоваться также для передачи сигнала к белкам мембраны [ Cowin P. and Burke B., 1996 ]. Кроме актина и спектрина в состав мембранного цитоскелета эритроцитов входят и другие белки, которые обеспечивают прикрепление сети цитоскелета к мембране. Это прикрепление осуществляется за счет вертикальных взаимодействий двух типов:
· В первом случае молекула спектрина (точнее, бета-субъединица спектрина) взаимодействует с белком анкирином в участке, расположенном в средней части молекулы спектрина. Анкирин в свою очередь взаимодействует с интегральными белками мембраны, такими, как белок полосы 3 , АТРазы Р-типа, ионные каналы и рецепторы. Кроме того, в это взаимодействие вовлечен, по-видимому, белок полосы 4,2 , который связывается с анкирином и цитоплазматическими доменами мембранных белков, влияя на взаимодействие с ними анкирина.
· Другим участком прикрепления сети цитоскелета к мембране является концевая часть молекулы спектрина: в этом случае связь с интегральными белками мембраны, включая перечисленные выше, а также гликофорин С, обеспечивается за счет белка полосы 4,1.
Кроме того, во взаимодействие актина со спектрином, обеспечивающее формирование двумерной сети примембранного цитоскелета, могут быть вовлечены и другие белки, обладающие спектринсвязывающей активностью: аддуцин, тропомиозин , тропомодулин , дематин.
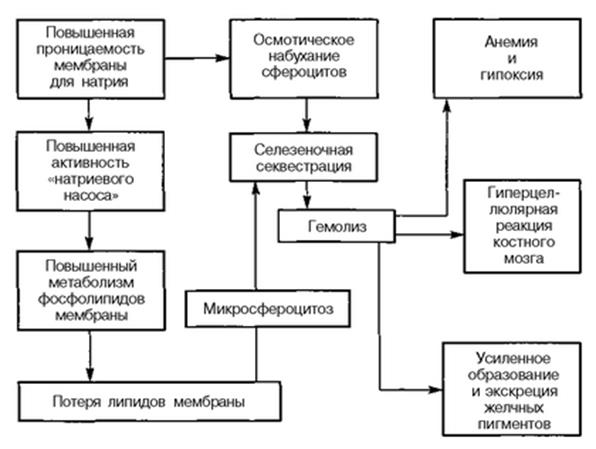
Наследственно измененные протеины клеточной мембраны обуславливают нарушение формирования нормальных контрактильных фибрилл. Это, в свою очередь, приводит к патологическому изменению формы эритроцита. Белок, подвергшийся мутационным изменениям, нарушает транспорт катионов, что способствует возникновению сфероцитоза, снижению осмотической резистентности, преждевременной гибели эритроцитов. Мембрана таких эритроцитов обладает повышенной проницаемостью для ионов натрия. Это приводит к их набуханию. Сферическая форма эритроцитов и особенности структуры белка их мембраны нарушают способность эритроцитов изменять свою форму в узких местах кровотока, что приводит к их повреждению и разрушению. Основным местом гемолиза является селезенка. Исследования показали, что продолжительность жизни эритроцитов у таких больных составляет 8—15 дней вместо 90—120 у здоровых людей.
Изменение белка в мембране эритроцита — первопричина дефекта красных кровяных клеток; нарушение транспорта катионов — вторично. Этой точки зрения в настоящее время придерживается преобладающее число исследователей. Существует мнение, что изменения белка вторичны, поскольку они обнаруживаются не только при наследственном сфероцитозе, но и при аутоиммунной гемолитической анемии.
Обобщая данные литературы, основные патогенетические звенья наследственного микросфероцитоза можно представить в следующем виде.
Наследственный дефект мембраны эритроцита приводит к повышенной проницаемости ее для ионов натрия, что, в свою очередь, содействует возрастанию интенсивности гликолиза, повышению интенсивности метаболизма липидов, потере поверхностных субстанций, изменению объема клетки, формированию стадии макроцита.
Макроциты при движении на уровне селезенки начинают испытывать механическое затруднение, в связи с чем они длительно задерживаются в красной пульпе, подвергаясь всем видам неблагоприятных воздействий (гемоконцентрация, изменение рН, активная фагоцитарная система). Неблагоприятные условия обмена в селезенке способствуют повреждению мембраны, что еще более увеличивает сферичность клетки и содействует формированию стадии микроцитов. Уменьшенный внутриклеточный рН микросфероцитов способствует торможению их гликолитической активности в условиях недостаточного снабжения глюкозой в микрососудах селезенки, что сопровождается снижением активности транспорта ионов, повышением осмотического содержания клетки и осмотическим лизисом.
Селезенка при данном заболевании, по мнению ряда авторов, активно наносит эритроцитам повреждение, содействуя еще большей фрагментации эритроцитарной мембраны и сферуляции. Этот факт нашел подтверждение в электронно-микроскопических исследованиях, которые обнаружили в эритроците ультраструктурные изменения, выражающиеся утолщением клеточной мембраны, ее разрывами и образованием вакуолей.
Через 2—3 пассажа через селезенку микросфероцит подвергается лизису и фагоцитозу. Фагоцитарная гиперактивность селезенки, в свою очередь, вызывает прогрессирующую гиперплазию органа и дальнейшее повышение его фагоцитарной активности. Нормализация срока жизни эритроцитов после операции свидетельствует о том, что только фагоцитарная активность селезенки опасна для сфероцита, печень же в этом отношении остается интактной. То же самое подтверждается и исследованиями с радиоактивным хромом, выявляющими резкое повышение радиоактивности печени и селезенки при аутоиммунных гемолитических анемиях и только селезенки — при сфероцитозе. Следовательно, при сфероцитозе гемолиз зависит в основном от формы эритроцита. Селезенка является местом деформации и гибели эритроцитов.
Частичный дефицит спектрина.
При доминантно-наследуемом НС мутация локализуется в конверсируемой области β- цепи спектрина, который в норме присоединяется к протеину 4.1, но вследствие дефицита спектрина этот процесс нарушается.
При рецессивно-наследуемом НС мутация локализуется в области α-цепи спектрина.
