Вопрос № 4. Понятие водородного показателя pH (20 мин).
Вода представляет собой очень слабый электролит, и реакция диссоциации воды по уравнению Н2О ⇄ H+ + ОН− протекает в очень незначительной степени.
Константа равновесия этого процесса
 1,8×10−16.
1,8×10−16.
Степень диссоциации воды очень мала, и концентрация недиссоциированных молекул воды практически равна общей концентрации воды, т.е. 55,55 моль/л. (Величина эта получается в результате следующего расчета. 1 л воды имеет массу 1000 г. Молярная концентрация составляет:
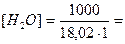 55,55 моль/л).
55,55 моль/л).
Тогда произведение ионов водорода и гидроксид-ионов составит
[Н+]×[ОН−] = Кр× [Н2О] = 1,8×10−16 × 55,55 = 10−14
Полученное уравнение показывает, что для воды и разбавленных водных растворов произведение концентраций ионов водорода и гидроксид-ионов есть величина постоянная.
Эта величина называется ионным произведением воды КН2О :
при 250С КН2О = 10−14.
Для нейтральныхрастворов [H+] = [OH-] = 10-7 моль/л
В кислых растворах [H+] > 10-7 моль/л, а [OH-] < 10-7 моль/л.
В щелочных растворах [H+] < 10-7 моль/л, а [OH-] > 10-7 моль/л.
Но какова бы ни была реакция раствора, произведение концентраций ионов водорода и гидроксид-ионов остается постоянным.
На практике реакцию среды (кислотность) принято выражать через концентрацию ионов водорода Н+.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов выражают через водородный показатель, обозначаемый символом рН.
Водородным показателем рН называется десятичный логарифм концентрации водородных ионов, взятый с обратным знаком.
pН = - lg[H+], где
[H+] – концентрация ионов водорода в растворе, моль/л.
Из этого соотношения ясно, что
в нейтральныхрастворах рН = 7;
в кислых растворах рН < 7;
вщелочных растворах рН > 7.
Понятие “водородный показатель” было введено датским химиком Сёренсеном в 1909 году. (Буква “р” – начальная буква датского слова potenz – степень, буква “H” – символ водорода).
Наглядно зависимость между концентрацией ионов водорода, величиной рН и реакцией раствора можно выразить схемой:
100 10−3 10−7 10−10 10−14
[Н+] моль/л ┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-
∶ ∶ ∶
рН -┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-┼-
0 3 7 10 14
сильно ∶ слабо ∶ слабо ∶ сильно
кислая кислая щелочная щелочная
Из схемы видно, что чем меньше рН, тем больше концентрация ионов водорода, и тем выше кислотность среды.
Для многих явлений и процессов – и в природе, и в технике – роль рН исключительно велика. Многие производственные процессы протекают лишь при определенной реакции среды. Например, растения могут развиваться только при определенных значениях рН почвенного раствора. Чаще всего растения страдают от повышенной кислотности, для устранения которой применяется известкование почв – внесение в них известняка СаСО3 и MgСО3.
Приведем значения рН некоторых наиболее известных растворов:
| рН | Растворы |
| желудочный сок | |
| 2,3 | лимоны |
| 2,6 | винный уксус |
| газированная вода | |
| 3,5 | апельсины |
| 4,2 | помидоры |
| 6,2 | дождевая вода |
| 6,5 | молоко |
| 7,0 | чистая вода, слезы |
| 7,4 | кровь |
| 7,8 | куриное яйцо |
| 8,2 | мыло |
| 8,5 | морская вода |
| 10,8 | стиральный порошок |
(Все определения, формулы, графики даются под запись).
