Эквиваленты простых и сложных веществ
Химический факультет
Кафедра неорганической химии
“Основные понятия и законы химии ”
Методическое пособие по неорганической химии для студентов 1-го курса
Химического факультета
Барнаул 2010
Эквиваленты простых и сложных веществ
Эквивалент – это реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода или в окислительно-восстановительной реакции эквивалентна одному электрону. Единица количества эквивалента – моль. Например, в кислотно-основной реакции
3H2SO4 + 2Al(OH)3 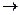 Al2(SO4)3 + 6 H2O
Al2(SO4)3 + 6 H2O
шести ионам водорода (в трех реагирующих частицах H2SO4) соответствуют две частицы Al(OH)3, следовательно, одному иону водорода эквивалентна одна треть частицы Al(OH)3, т. е. 1 эквивалент Al(OH)3 равен 1/3 Al(OH)3. В реакции окисления-восстановления с участием перманганат-ионов, происходящей в кислой среде
MnO4- + 8H+ + 5e- 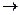 Mn2+ + 4H2O
Mn2+ + 4H2O
один эквивалент MnO4- равен 1/5 этого иона. Числа 1/3 и 1/5 (в этих примерах) называют фактором эквивалентности, его обозначают fэкв.
Масса одного эквивалента вещества Мэкв равна
Mэкв = fэкв∙M (М – молярная масса).
Для определения эквивалента достаточно знать состав соединения данного элемента и его валентность. По существу, эквивалент – это выраженная в углеродных единицах масса вещества, приходящаяся на одну проявленную валентность или основность (кислотность):
Мэкв = А/n, Мэкв = М/n,
где Э – химический эквивалент; А – атомная масса элемента; М – молекулярная масса кислоты (основания); n – валентность в первой формуле, основность (кислотность) – во второй.
Закон эквивалентов – основная работа немецкого химика Иеремии Вениамина Рихтера (1793 г.); формулируется ученым таким образом: все вещества реагируют в эквивалентных отношениях.
Математическое выражение закона имеет вид:
mA / mB = MЭ(А) / MЭ(В) ,
где mA , mB – массы взаимодействующих веществ А и В; MЭ(А) , MЭ(В) - эквивалентные массы этих веществ. Либо для случая, когда одно или оба вещества находятся в газообразном состоянии:
mA / VB = MЭ(А) / VЭ(В); VА/ VB = VЭ(А) / VЭ(B) ,
где VА, VB – объемы взаимодействующих веществ А и В; VЭ(А), VЭ(B) – эквивалентные объемы этих веществ (л/моль).
Пример 1. Определите эквивалентное количество хлорида бария (моль), участвующее в обменной реакции с серной кислотой (образуется сульфат бария), если в реакцию вступило 0,125 моль H2SO4.
Решение:


 nЭ(B) = ? H2SO4 + BaCl2 = BaSO4
nЭ(B) = ? H2SO4 + BaCl2 = BaSO4  + 2HCl
+ 2HCl
 nA = 0,125 моль SO42- + Ba2+ = BaSO4
nA = 0,125 моль SO42- + Ba2+ = BaSO4 
zA = 2 nЭ(В) = nЭ(А) = 2∙0,125 = 0,25 моль.
Ответ. Эквивалентное количество хлорида бария, участвующее в данной реакции, равно 0,25 моль.
Пример 2. 0,304 г Mg вытеснили 0,0252 г Н. Вычислить эквивалентную массу магния.
 Решение
Решение
МЭ(Mg) =? Mg + 2HCl = MgCl2 + H2 
mMg = 0,304 г mM g/ mH = MЭ(Mg)/ MЭ(H)
 mH = 0,0252 г MЭ(Mg) =
mH = 0,0252 г MЭ(Mg) = 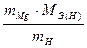 =
=  = 12,16 г/моль
= 12,16 г/моль
MЭ(Н) = 1,008 г/моль
Ответ. Эквивалентная масса магния равна 12,16 г/моль.
Пример 3. Кислородные соединения хрома содержат 48,0, 31,58 и 23,53 % кислорода. Каковы значения эквивалентных масс хрома в каждом отдельном соединении?
 Решение
Решение
МЭ(Сr)1 =?
МЭ(Cr)2 =? MЭ(Cr)1 =  =
= 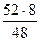 = 8,67 г/моль
= 8,67 г/моль
МЭ(Cr)3 =? МЭ(Cr)2 = 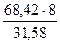 = 17,33 г/моль
= 17,33 г/моль
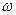 (О)1 = 48 % МЭ(Cr)3 =
(О)1 = 48 % МЭ(Cr)3 = 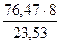 = 26,0 г/моль
= 26,0 г/моль
 = 31,58 %
= 31,58 %

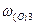 = 23,53 %
= 23,53 %
МЭ(О) = 8 г/моль
Ответ. Значения эквивалентных масс хрома в каждом отдельном соединении равны 8,67, 17,33 и 26,0 г/моль.
