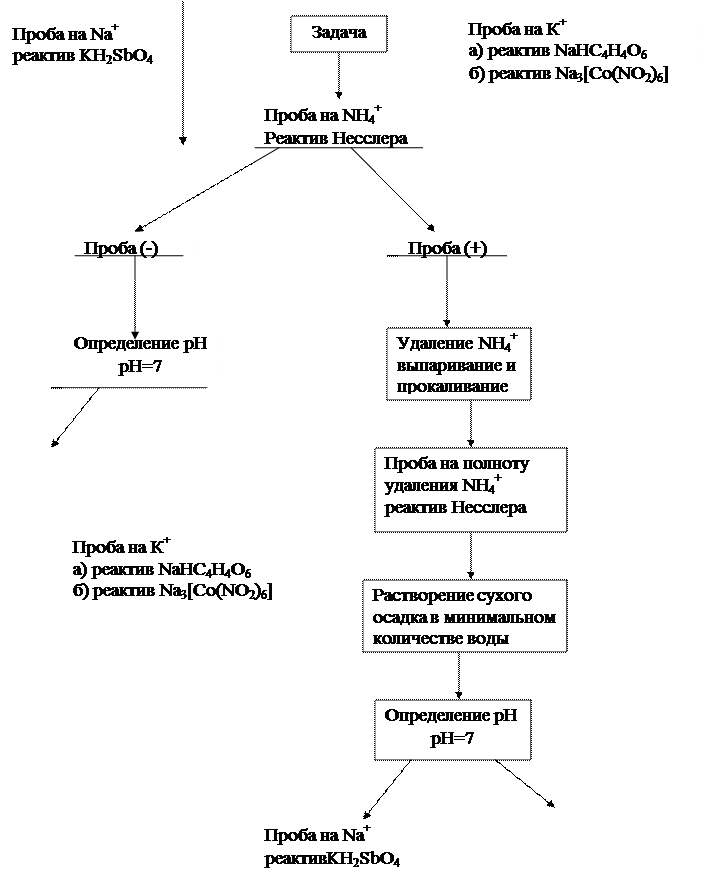
Катионы I аналитической группы
Занятие 1-2
Катионы I аналитической группы
Задачи
1. Освоить технику выполнения качественных реакций на Na+, K+, NH4+.
2. Научиться выполнять систематический ход анализа смеси катионов I группы.
3. Научиться делать заключения, результаты анализа оформлять протоколом.
Продолжительность занятия: 90 минут (2 академических часа) + 180 минут (4 академических часа).
Вопросы самоподготовки:
- строение атомов калия, натрия;
- строение и механизмы образования связей в катионе аммония;
- реакция среды в растворах солей аммония, натрия, калия;
- качественные реакции на Na+, K+, NH4+.
- применение в медицине соединений натрия, калия, аммония.
Материальное обеспечение:
а) реактивы:
- растворы кислот (HCl, HNO3, CH3COOH)
- растворы щелочей (KOH, NaOH)
- раствор KH2SbO4 - дигидроантимоната калия
- раствор гидротартрата натрия
- раствор гексанитро кобальтата (III) натрия
- реактив Несслера
б) посуда, оборудование
- пробирки
- стеклянные палочки
- тигли
- предметные стекла
- водяные бани
- песчаные бани
в) наглядные пособия, таблицы
- Периодическая система элементов Д.И. Менделеева
- таблица растворимости
Катионы I аналитической группы.
Реакции катиона Na+:
1. Реактив KH2SbO4 – дигидроантимонат калия К 2-3 каплям раствора соли натрия прибавляют 2-3 капли реактива. На холоде, при потирании стеклянной палочкой образуется белый мелкокристаллический осадок. NaCl + KH2SbO4 ® NaH2SbO4 ¯ + KCl
(бел. кр.)
Реакция исследуемого раствора должна быть нейтральной, так как в кислой среде идет разложение реактива с образованием белого аморфного осадка м-сурьмяной кислоты HSbO3.
KH2SbO4 + HCl ® H3SbO4 + KCl
H3SbO4 ® HSbO3¯ + H2O
(бел. аморфн.)
В щелочной среде осадок растворяется: NaH2SbO4 ¯ + NaOH® Na3SbO4 + 2 H2O
Обнаружению Na+ мешают соли аммония: NH4+ + HOH Û NH4OH + H+ pH< 7
H+ + H2SbO4- ® HSbO3¯ + H2O
2. Крупинка соли Na+, внесенная в бесцветное пламя, окрашивает его в желтый цвет.
Реакции катиона К+:
1. Реактив NaHC4H4O6 К 2-3 капли раствора соли калия прибавляют 2-3 капли реактива. На холоде, при потирании стеклянной палочкой образуется белый мелкокристаллический осадок. KCl + NaHC4H4O6 ® KHC4H4O6¯ + NaCl
(белый)
При нагревании, добавлении сильных минеральных кислот и щелочей осадок растворяется:
KHC4H4O6¯ + HCl ® KCl + H2C4H4O6
KHC4H4O6¯ + KOH ® K2C4H4O6 + H2O
KHC4H4O6¯ + NaOH ® KNaC4H4O6 + H2O
Если вместо NaHC4H4O6 используют свободную кислоту H2C4H4O6, то для предотвращения растворения осадка реакцию ведут в присутствии ацетата натрия CH3COONa:
KCl + H2C4H4O6 CH3COONa KHC4H4O6¯ + HCl
 HCl + CH3COONa ® NaCl + CH3COOH
HCl + CH3COONa ® NaCl + CH3COOH
KCl + H2C4H4O6 + CH3COONa ® KHC4H4O6¯ + NaCl + CH3COOH
2. Реактив кобальти нитрит натрия или гексанитрокобальтат (III) натрия Na3[Co(NO2)6] К 2-3 каплям раствора соли калия прибавляют равный объем реактива. При стоянии образуется осадок желтого цвета. KCl + Na3[Co(NO2)6] ® KNa2[Co(NO2)6]¯ + NaCl
В щелочной среде реактив разлагается
Na3[Co(NO2)6] + 3NaOH ® Co(OH)3¯ + 6NaNO2
(бурый)
3. Крупинка соли К+, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет.
Реакции катиона NH4+:
1. Едкие щелочи NaOH или KOH . При действии на 2-3 капли раствора соли аммония раствором щелочи при нагревании выделяется газообразный аммиак. NH4Cl + KOH ® NH3 + H2O + KCl
Выделяющийся аммиак определяют по запаху или по: - посинению влажной красной лакмусовой бумаги; - покраснению белой фенолфталеиновой бумаги;
NH3 + H2O Û NH4+ + OH- pH >7
2. Реактив Несслера - K2[HgI4] в KOH К 1 капле раствора соли аммония прибавляют 1 каплю раствора реактива Несслера. Образуется осадок красно-бурого цвета.

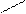 Hg
Hg

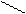 NH4Cl + 2K2[HgI4] + 4KOH ® [O NH2]I¯ + KCl + 7KI + 3H2O
NH4Cl + 2K2[HgI4] + 4KOH ® [O NH2]I¯ + KCl + 7KI + 3H2O
Hg
(кр.-бур.)
При очень малых количествах солей аммония появляется желтое окрашивание.
 | |||
| |
