Термодинамические параметры состояния
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
«Уфимский государственный нефтяной технический университет»
Кафедра «Промышленная теплоэнергетитка»
В.В.Кузнецова, О.В.Смородова
ТЕПЛОТЕХНИКА
Курс лекций специальности
по направлению 657300 (ОКСО 130600)
УФА 2007
СОДЕРЖАНИЕ
| ВВЕДЕНИЕ........................................................................................................................... | |
| ЛЕКЦИЯ 1. Предмет и метод термодинамики..................................................................... | |
| Термодинамическая система............................................................................. | |
| Термодинамические параметры состояния..................................................... | |
| Уравнение состояния......................................................................................... | |
| Термодинамический процесс.......................................................................... | |
| Теплоемкость газов........................................................................................... | |
| ЛЕКЦИЯ 2. Смеси идеальных газов.................................................................................... | |
| Аналитическое выражение первого закона термодинамики............................ | |
| ЛЕКЦИЯ 3. Внутренняя энергия........................................................................................... | |
| Работа расширения.......................................................................................... | |
| Теплота................................................................................................................ | |
| Энтальпия.............................................................................................................. | |
| Энтропия.............................................................................................................. | |
| ЛЕКЦИЯ 4. Общая формулировка второго закона.............................................................. | |
| Прямой цикл Карно.............................................................................................. | |
| Обратный цикл Карно......................................................................................... | |
| Изменение энтропии в неравновесных процессах........................................... | |
| ЛЕКЦИЯ 5. Термодинамические процессы идеальных газов в закрытых системах......... | |
| Эксергия................................................................................................................ | |
| ЛЕКЦИЯ 6. Термодинамические процессы реальных газов................................................ | |
| Уравнение состояния реальных газов............................................................... | |
| ЛЕКЦИЯ 7. Уравнение первого закона термодинамики для потока................................... | |
| Истечение из суживающегося сопла.................................................................. | |
| Основные закономерности течения газа в соплах и диффузорах................... | |
| Расчет процесса истечения с помощью h-s диаграммы.................................... | |
| Дросселирование газов и паров.......................................................................... | |
| ЛЕКЦИЯ 8. Термодинамическая Эффективность циклов теплосиловых установок......... | |
| Циклы поршневых двигателей внутреннего сгорания.................................... | |
| Циклы газотурбинных установок....................................................................... | |
| Циклы паротурбинных установок.................................................................... | |
| Циклы Карно и Ренкина насыщенного пара. Регенерация теплоты............... | |
| Цикл Ренкина на перегретом паре...................................................................... | |
| Термический КПД цикла.................................................................................... | |
| Теплофикация....................................................................................................... | |
| ЛЕКЦИЯ 9. Основные понятия и определения.................................................................... | |
| Теория теплопроводности................................................................................... | |
| Задачи.................................................................................................................... | |
| ЛЕКЦИЯ 10. Теплопередача.................................................................................................... | |
| Плоская стенка.................................................................................................... | |
| Цилиндрическая стенка...................................................................................... | |
| Интенсификация теплопередачи....................................................................... | |
| Тепловая изоляция.............................................................................................. | |
| Задачи по теплопередаче.................................................................................... | |
| ЛЕКЦИЯ 11. Конвективный теплообмен. Основной закон конвективного теплообмена. | |
| Пограничный слой.............................................................................................. | |
| Числа подобия..................................................................................................... | |
| Массообмен.......................................................................................................... | |
| ЛЕКЦИЯ 12. Частные случаи конвективного теплообмена. Поперечное обтекание одиночной трубы и пучка труб.......................................................................... | |
| Течение теплоносителя внутри труб................................................................. | |
| Теплоотдача при естественной конвекции........................................................ | |
| Теплоотдача при конденсации............................................................................ | |
| Ориентировочные значения коэффициентов теплоотдачи.............................. | |
| ЛЕКЦИЯ 13. Описание процесса излучения. Основные определения............................... | |
| Теплообмен излучением системы тел в прозрачной среде.............................. | |
| Перенос лучистой энергии в поглощающей и излучающей среде................. | |
| ЛЕКЦИЯ 14. Теплообменные аппараты................................................................................ | |
| Типы теплообменных аппаратов....................................................................... | |
| Расчетные уравнения.......................................................................................... | |
| ЛЕКЦИЯ 15. Термодинамический анализ топливосжигающих устройств....................... | |
| Полезная тепловая нагрузка печи....................................................................... | |
| Расчет процесса горения топлива в печи............................................................ | |
| Тепловой баланс печи, коэффициент полезного действия, расход топлива... | |
| ЛЕКЦИЯ 16. Котельные установки. Общие сведения........................................................ | |
| Устройство парового котла.................................................................................. | |
| Тепловой баланс парового котла. Коэффициент полезного действия............. | |
| ЛЕКЦИЯ 17. Состав и основные характеристики жидкого топлива................................... | |
| Состав и основные характеристики газообразного топлива............................. | |
| Теплота сгорания топлива.................................................................................... | |
| Количество воздуха, необходимого для горения. Теплота «сгорания» воздуха................................................................................................................. | |
| Объемы и состав продуктов сгорания.................................................................. | |
| ЛЕКЦИЯ 18. Вторичные энергоресурсы. Классификация ВЭР.......................................... | |
| Методы использования тепловых ВЭР................................................................ | |
| Установки для внутреннего теплоиспользования............................................... | |
| Котлы-утилизаторы.............................................................................................. | |
| СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ.............................................................. |
ВВЕДЕНИЕ
В последние годы ученые всего мира со все большим беспокойством говорят о повышении концентрации СО2 в атмосфере. Если эти опасения подтвердятся, человечеству в не таком уж отдаленном будущем придется резко ограничить потребление углеродсодержащих топлив. Кроме выбросов СО2 топливосжигающие и теплоэнергетические установки производят тепловые загрязнения (выбросы нагретой воды и газов), химические (оксиды серы и азота), золу и сажу, которые с увеличением масштаба производства также создают серьезные проблемы.
Однако экономические факторы стимулируют резкое увеличение степени использования добываемого топлива. Вместе с тем пока еще энергетическая эффективность многих технологических процессов чрезвычайно низка, ибо технологи, разрабатывая соответствующие процессы, зачастую не ставили во главу угла вопросы экономии топлива.
Высокие цены на топливо (прежде всего нефть) на мировом рынке стимулируют разработку энергосберегающих технологий. Главная роль в разработке менее энергоемких технологий принадлежит технологам. Эту задачу невозможно решить без глубоких знаний основных законов теплотехники.
Сегодня выгоднее вкладывать средства не в увеличение добычи топлива, чтобы продолжать расходовать его с низкой эффективностью, а в разработку технологических процессов, обеспечивающих более экономное его использование. В целом более 90 % всей используемой человечеством энергии приходится на ископаемые органические топлива. Это определяет роль теплотехники – общеинженерной дисциплины, изучающей методы получения, преобразования, передачи, и использования теплоты и связанных с этим аппаратов и устройств.
ЛЕКЦИЯ 1
 Раздел 1 Техническая термодинамика. Основные понятия и определения
Раздел 1 Техническая термодинамика. Основные понятия и определения
Термодинамика изучает законы превращения энергии в различных процессах, происходящих в макроскопических системах и сопровождающихся тепловыми эффектами. Макроскопической системой называется любой материальный объект, состоящий из большого числа частиц. Размеры макроскопических систем несоизмеримо больше размеров молекул и атомов.
В зависимости от задач исследования рассматривают техническую или химическую термодинамику, термодинамику биологических систем и т. д. Техническая термодинамика изучает закономерности взаимного превращения тепловой и механической энергии и свойства тел, участвующих в этих превращениях. Вместе с теорией теплообмена она является теоретическим фундаментом теплотехники. На ее основе осуществляют расчет и проектирование всех тепловых двигателей, а также всевозможного технологического оборудования.
Рассматривая только макроскопические системы, термодинамика изучает закономерности тепловой формы движения материи, обусловленные наличием огромного числа непрерывно движущихся и взаимодействующих между собой микроструктурных частиц (молекул, атомов, ионов).
Физические свойства макроскопических систем изучаются статистическими термодинамическим методами. Статистический метод основан на использовании теории вероятностей и определенных моделей строения этих систем и представляет собой содержание статистической физики. Термодинамический метод не требует привлечения модельных представлений о структуре вещества и является феноменологическим (т. е. рассматривает «феномены» — явления в целом).
При этом все основные выводы термодинамики можно получить методом дедукции, используя только два основных эмпирических закона термодинамики.
В дальнейшем исходя из термодинамического метода мы будем для наглядности использовать молекулярно-кинетические представления о структуре вещества.
Термодинамическая система
Термодинамическая система представляет собой совокупность материальных тел, находящихся в механическом и тепловом взаимодействиях друг с другом и с окружающими систему внешними телами («внешней средой»).
 Выбор системы произволен и диктуется условиями решаемой задачи. Тела, не входящие в систему, называют окружающей средой. Систему отделяют от окружающей среды контрольной поверхностью (оболочкой). Так, например, для простейшей системы — газа, заключенного в цилиндре под поршнем, внешней средой является окружающий воздух, а контрольными поверхностями служат стенки цилиндра и поршень.
Выбор системы произволен и диктуется условиями решаемой задачи. Тела, не входящие в систему, называют окружающей средой. Систему отделяют от окружающей среды контрольной поверхностью (оболочкой). Так, например, для простейшей системы — газа, заключенного в цилиндре под поршнем, внешней средой является окружающий воздух, а контрольными поверхностями служат стенки цилиндра и поршень.
Механическое и тепловое взаимодействия термодинамической системы осуществляются через контрольные поверхности. При механическом взаимодействии самой системой или над системой совершается работа. (В общем случае на систему могут действовать также электрические, магнитные и другие силы, под воздействием которых система будет совершать работу. Эти виды работ также могут быть учтены в рамках термодинамики, но нами в дальнейшем рассматриваться не будут). В нашем примере механическая работа производится при перемещении поршня и сопровождается изменением объема. Тепловое взаимодействие заключается в переходе теплоты между отдельными телами системы и между системой и окружающей средой. В рассматриваемом примере теплота может подводиться к газу через стенки цилиндра.
В самом общем случае система может обмениваться со средой и веществом (массообменное взаимодействие). Такая система называется открытой. Потоки газа или пара в турбинах и трубопроводах — примеры открытых систем. Если вещество не проходит через границы системы, то она называется закрытой. В дальнейшем, если это специально не оговаривается, мы будем рассматривать закрытые системы.
Термодинамическую систему, которая не может обмениваться теплотой с окружающей средой, называют теплоизолированной или адиабатной. Примером адиабатной системы является газ, находящийся в сосуде, стенки которого покрыты идеальной тепловой изоляцией, исключающей теплообмен между заключенным в сосуде газом и окружающими телами. Такую изоляционную оболочку называют адиабатной. Система, не обменивающаяся с внешней средой ни энергией, ни веществом, называется изолированной (или замкнутой).
Простейшей термодинамической системой является рабочее тело, осуществляющее взаимное превращение теплоты и работы. В двигателе внутреннего сгорания, например, рабочим телом является приготовленная в карбюраторе горючая смесь, состоящая из воздуха и паров бензина.
Термодинамические параметры состояния
Свойства каждой системы характеризуются рядом величин, которые принято называть термодинамическими параметрами. Рассмотрим некоторые из них, используя при этом известные из курса физики молекулярно-кинетические представления об идеальном газе как о совокупности молекул, которые имеют исчезающе малые размеры, находятся в беспорядочном тепловом движении и взаимодействуют друг с другом лишь при соударениях.
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней. В соответствии с молекулярно-кинетической теорией давление газа определяется соотношением
 , (1.1)
, (1.1)
где n — число молекул в единице объема;
т — масса молекулы; с2— средняя квадратическая скорость поступательного движения молекул.
В Международной системе единиц (СИ) давление выражается в паскалях (1 Па=1 Н/м2). Поскольку эта единица мала, удобнее использовать 1 кПа = 1000 Па и 1 МПа=106 Па.
Давление измеряется при помощи манометров, барометров и вакуумметров.


 Жидкостные и пружинные манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением р измеряемой среды и атмосферным давлением pатм, т.е.
Жидкостные и пружинные манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением р измеряемой среды и атмосферным давлением pатм, т.е. 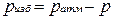
Приборы для измерения давлений ниже атмосферного называются вакуумметрами; их показания дают значение разрежения (или вакуума):
 , т. е. избыток атмосферного давления над абсолютным.
, т. е. избыток атмосферного давления над абсолютным.
Следует отметить, что параметром состояния является абсолютное давление. Именно оно входит в термодинамические уравнения.
Температурой называется физическая величина, характеризующая степень нагретости тела. Понятие о температуре вытекает из следующего утверждения: если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениваться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано с величиной средней кинетической энергии молекул вещества:
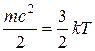 , (1.2)
, (1.2)
где k — постоянная Больцмана, равная 1,380662•10ˉ23 Дж/К. Температура T, определенная таким образом, называется абсолютной.
В системе СИ единицей температуры является кельвин (К); на практике широко применяется градус Цельсия (°С). Соотношение между абсолютной Т и стоградусной I температурами имеет вид
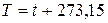 .
.
В промышленных и лабораторных условиях температуру измеряют с помощью жидкостных термометров, пирометров, термопар и других приборов.
Удельный объем v — это объем единицы массы вещества. Если однородное тело массой М занимает объем v, то по определению
v= V/М.
В системе СИ единица удельного объема 1 м3/кг. Между удельным объемом вещества и его плотность существует очевидное соотношение:

Для сравнения величин, характеризующих системы в одинаковых состояниях, вводится понятие «нормальные физические условия»:
p=760 мм рт.ст.= 101,325 кПа; T=273,15 K.
В разных отраслях техники и разных странах вводят свои, несколько отличные от приведенных «нормальные условия», например, «технические» ( p= 735,6 мм рт.ст.= 98 кПа , t=15˚C) или нормальные условия для оценки производительности компрессоров (p=101,325 кПа, t=20˚С ) и т. д.
Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным.
Если между различными точками в системе существуют разности температур, давлений и других параметров, то она является неравновесной. В такой системе под действием градиентов параметров возникают потоки теплоты, вещества и другие, стремящиеся вернуть ее в состояние равновесия. Опыт показывает, что изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно выйти из него не может. В классической термодинамике рассматриваются только равновесные системы.
Уравнение состояния
Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния. Опыт показывает, что удельный объем, температура и давление простейших систем, которыми являются газы, пары или жидкости, связаны термическим уравнением состояния вида  .
.
Уравнению состояния можно придать другую форму: 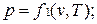


Эти уравнения показывают, что из трех основных параметров, определяющих состояние системы, независимыми являются два любых.
Для решения задач методами термодинамики совершенно необходимо знать уравнение состояния. Однако оно не может быть получено в рамках термодинамики и должно быть найдено либо экспериментально, либо методами статистической физики. Конкретный вид уравнения состояния зависит от индивидуальных свойств вещества.
Уравнение состояния идеальных газов
Из уравнений (1.1) и (1.2) следует, что 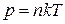 .
.
Рассмотрим 1 кг газа. Учитывая, что в нем содержится N молекул и, следовательно,  , получим:
, получим:  .
.
Постоянную величину Nk, отнесенную к 1 кг газа, обозначают буквой R и называют газовой постоянной. Поэтому
 , или
, или  . (1.3)
. (1.3)
Полученное соотношение представляет собой уравнение Клапейрона.
Умножив (1.3) на М, получим уравнение состояния для произвольной массы газа М: 
 . (1.4)
. (1.4)
Уравнению Клапейрона можно придать универсальную форму, если отнести газовую постоянную к 1 кмолю газа, т. е. к количеству газа, масса которого в килограммах численно равна молекулярной массе μ. Положив в (1.4) М=μ и V=V μ, получим для одного моля уравнение Клапейрона — Менделеева:
 .
.
Здесь 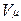 — объем киломоля газа, а
— объем киломоля газа, а 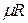 — универсальная газовая постоянная.
— универсальная газовая постоянная.
В соответствии с законом Авогадро (1811г.) объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м3, поэтому

Газовая постоянная 1 кг газа составляет  .
.
Уравнение состояния реальных газов
В реальных газах вотличие от идеальных существенны силы межмолекулярных взаимодействий (силы притяжения, когда молекулы находятся на значительном расстоянии, и силы отталкивания при достаточном сближении их друг с другом) и нельзя пренебречь собственным объемом молекул.
Наличие межмолекулярных сил отталкивания приводит к тому, что молекулы могут сближаться между собой только до некоторого минимального расстояния. Поэтому можно считать, что свободный для движения молекул объем будет равен 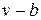 , где b — тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается и число ударов о стенку в единицу времени, а следовательно, и давление увеличивается по сравнению с идеальным газом в отношении
, где b — тот наименьший объем, до которого можно сжать газ. В соответствии с этим длина свободного пробега молекул уменьшается и число ударов о стенку в единицу времени, а следовательно, и давление увеличивается по сравнению с идеальным газом в отношении 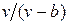 , т. е.
, т. е.
 .
.
Силы притяжения действуют в том же направлении, что и внешнее давление, и приводят к возникновению молекулярного (или внутреннего) давления. Сила молекулярного притяжения каких-либо двух малых частей газа пропорциональна произведению числа молекул в каждой из этих частей, т. е. квадрату плотности, поэтому молекулярное давление обратно пропорционально квадрату удельного объема газа: рмол = а/v2, где а — коэффициент пропорциональности, зависящий от природы газа.
Отсюда получаем уравнение Ван-дер-Ваальса (1873 г.):
 ,
,

 или
или
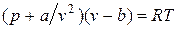 .
.
При больших удельных объемах и сравнительно невысоких давлениях реального газа уравнение Ван-дер-Ваальса практически вырождается в уравнение состояния идеального газа Клапейрона, ибо величина a/v2
(по сравнению с p) и b (по сравнению с v) становятся пренебрежимо малыми.
Уравнение Ван-дер-Ваальса с качественной стороны достаточно хорошо описывает свойства реального газа, но результаты численных расчетов не всегда согласуются с экспериментальными данными. В ряде случаев эти отклонения объясняются склонностью молекул реального газа к ассоциации в отдельные группы, состоящие из двух, трех и более молекул. Ассоциация происходит вследствие несимметричности внешнего электрического поля молекул. Образовавшиеся комплексы ведут себя как самостоятельные нестабильные частицы. При столкновениях они распадаются, затем вновь объединяются уже с другими молекулами и т. д. По мере повышения температуры концентрация комплексов с большим числом молекул быстро уменьшается, а доля одиночных молекул растет. Большую склонность к ассоциации проявляют полярные молекулы водяного пара.
Термодинамический процесс
Изменение состояния термодинамической системы во времени называется термодинамическим процессом. Так, при перемещении поршня в цилиндре объём, а с ним давление и температура находящегося внутри газа будут изменяться, будет совершаться процесс расширения или сжатия газа.
Как уже отмечалось, система, выведенная из состояния равновесия, и предоставленная при постоянных параметрах окружающей среды самой себе, через некоторое время вновь придет в равновесное состояние, соответствующее этим параметрам. Такое самопроизвольное (без внешнего воздействия) возвращение системы в состояние равновесия
называется релаксацией, а промежуток времени, в течение которого система возвращается в состояние равновесия, называется временем релаксации. Для разных процессов он различно: если для установления равновесного давления в газе требуется всегда, то для выравнивания температуры в объеме того же газа нужны десяти; минут, а в объеме нагреваемого твердой тела — иногда несколько часов.
Термодинамический процесс называется равновесным, если все параметры системы при его протекании меняются достаточно медленно по сравнению с соответствующим процессом релаксации. В этом случае система фактически все время находится в состоянии равновесия с окружающей средой, чем и определяется название процесса.
Чтобы процесс был равновесным, скорость изменения параметров системы  должна удовлетворять соотношению
должна удовлетворять соотношению
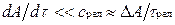
где А — параметр, наиболее быстро изменяющийся в рассматриваемом процессе; срел — скорость изменения этого параметра в релаксационном процессе; τрел — время релаксации.
Рассмотрим, например, процесс сжатия газа в цилиндре. Если время смещения поршня от одного положения до другого существенно превышает время релаксации, то в процессе перемещения поршня давление и температура успеют выровняться по всему объему цилиндра.
Это выравнивание обеспечивается непрерывным столкновением молекул, в результате чего подводимая от поршня к газу энергия достаточно быстро и равномерно распределяется между ними. Если последующие смещения поршня будут происходить аналогичным образом, то состояние системы в каждый момент времени будет практически равновесным. Таким образом, равновесный процесс состоит из непрерывного ряда последовательных состояний равновесия, поэтому в каждой его точке состояние термодинамической системы можно описать уравнением состояния данного рабочего тела. Именно поэтому классическая термодинамика в своих исследованиях оперирует только равновесными процессами. Они являются удобной идеализацией реальных процессов, позволяющей во многих случаях существенно упростить решение задачи. Такая идеализация вполне обоснована, так как условие (1.8) выполняется на практике достаточно часто. Поскольку механические возмущения распространяются в газах со скоростью звука, процесс сжатия газа и цилиндре будет равновесным, если скорость перемещения поршня много меньше скорости звука.
Процессы, не удовлетворяющие условию 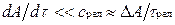 , протекают с нарушением равновесия, т. е. являются неравновесными. Если, например, быстро увеличит температуру окружающей среды, то газ в цилиндре будет постепенно прогреваться через его стенки, релаксируя к состоянию равновесия, соответствующему новым параметрам окружающей среды. В процессе релаксации газ не находится в равновесии с окружающей средой и его нельзя характеризовать уравнением состояния хотя бы потому, что в разных точках объема газа температура имеет различные значения.
, протекают с нарушением равновесия, т. е. являются неравновесными. Если, например, быстро увеличит температуру окружающей среды, то газ в цилиндре будет постепенно прогреваться через его стенки, релаксируя к состоянию равновесия, соответствующему новым параметрам окружающей среды. В процессе релаксации газ не находится в равновесии с окружающей средой и его нельзя характеризовать уравнением состояния хотя бы потому, что в разных точках объема газа температура имеет различные значения.
Теплоемкость газов
Отношение количества теплоты  , полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела
, полученного телом при бесконечно малом изменении его состояния, к связанному с этим изменению температуры тела  , называется теплоемкостью тела в данном процессе:
, называется теплоемкостью тела в данном процессе:
 .
.
Обычно теплоемкость относят к единице количества вещества и в зависимости от выбранной единицы различают:
удельную массовую теплоемкость c , отнесенную к 1 кг газа,
Дж/(кг·К);
удельную объемную теплоемкость c´, отнесенную к количеству газа, содержащегося в 1 м3 объема при нормальных физических условиях, Дж/(м3·К);
удельную мольную теплоемкость  , отнесенную к одному киломолю, Дж/(кмоль·К).
, отнесенную к одному киломолю, Дж/(кмоль·К).
Зависимость между удельными теплоемкостями устанавливается очевидными соотношениями: 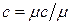 ;
; 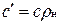
Здесь 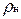 — плотность газа при нормальных условиях.
— плотность газа при нормальных условиях.
Изменение температуры тела при одном и том же количестве сообщаемой теплоты зависит от характера происходящего при этом процесса, поэтому теплоемкость является функцией процесса. Это означает, что одно и то же рабочее тело в зависимости от процесса требует для своего нагревания на 1 К различного количества теплоты. Численно величина с изменяется в пределах от +∞ до -∞.
В термодинамических расчетах большое значение имеют:
теплоемкость при постоянном давлении
 ,
,
равная отношению количества теплоты 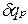 , сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT
, сообщенной телу в процессе при постоянном давлении, к изменению температуры тела dT
теплоемкость при постоянном объеме
 , (1.5)
, (1.5)
равная отношению количества теплоты , подведенной к телу в процессе при постоянном объеме, к изменению температуры тела .
В соответствии с первым законом термодинамики для закрытых систем, в которых протекают равновесные процессы  , и
, и
 .
.
Для изохорного процесса (v=const) это уравнение принимает вид 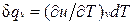 , и, учитывая (1.5), получаем, что
, и, учитывая (1.5), получаем, что
 ,
,
т. е. теплоемкость тела при постоянном объеме равна частной производной от его внутренней энергии по температуре и характеризует темп роста внутренней энергии в изохорном процессе с увеличением температуры.
Для идеального газа 

Для изобарного процесса () из уравнения (2.16) и (2.14) получаем
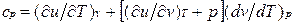
или
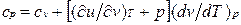
Это уравнение показывает связь между теплоемкостями ср и сv. Для идеального газа оно значительно упрощается. Действительно, внутренняя энергия идеального газа определяется только его температурой и не зависит от объема, поэтому 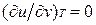 и, кроме того, из уравнения состояния следует
и, кроме того, из уравнения состояния следует  , откуда
, откуда
 .
.
Это соотношение называется уравнением Майера и является одним из основных в технической термодинамике идеальных газов.
В процессе v=const теплота, сообщаемая газу, идет лишь на изменение его внутренней энергии, тогда как в процессе р = const теплота расходуется и на увеличение внутренней энергии и на совершение работы против внешних сил. Поэтому ср больше сv на величину этой работы.
Для реальных газов 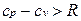 , поскольку при их расширении (при p=const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
, поскольку при их расширении (при p=const) совершается работа не только против внешних сил, но и против сил притяжения, действующих между молекулами, что вызывает дополнительный расход теплоты.
Обычно теплоемкости определяются экспериментально, но для многих веществ их можно рассчитать методами статистической физики.
Числовое значение теплоемкости идеального газа позволяет найти классическая теория теплоемкости, основанная на теореме о равномерном распределении энергии по степеням свободы молекул. Согласно этой теореме внутренняя энергия идеального газа прямо пропорциональна числу степеней свободы молекул и энергии kТ/2, приходящейся на одну степень свободы. Для 1 моля газа
 ,
,
где Nо — число Авогадро; i — число степеней свободы (число независимых координат, которые нужно задать для того, чтобы полностью определить положение молекулы в пространстве) .
Молекула одноатомного газа имеет три степени свободы соответственно трем составляющим в направлении координатных осей, на которые может быть разложено поступательное движение. Молекула двухатомного газа имеет пять степеней свободы, так как помимо поступательного движения она может вращаться около двух осей, перпендикулярных линии, соединяющей атомы (энергия вращения вокруг оси, соединяющей атомы, равна нулю, если атомы считать точками). Молекула трехатомного и вообще многоатомного газа имеет шесть степеней свободы: три поступательных и три вращательных.
Поскольку для идеального газа  , то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно:
, то мольные теплоемкости одно-, двух- и многоатомных газов равны соответственно:
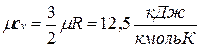 ;
;  ;
; 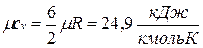 .
.
Результаты классической теории теплоемкости достаточно хорошо согласуются с экспериментальными данными в области комнатных температур (табл. 2.1), однако основной вывод о независимости от температуры эксперимент не подтверждает. Расхождения, особенно существенные в области низких и достаточно высоких температур, связаны с квантовым поведением молекул и находят объяснения в рамках квантовой теории теплоемкости.
Теплоемкость некоторых газов при t= 0°С в идеально-газовом состоянии
| Газ | Число степеней свободы | Мольная теплоемкость, кДж/кмольК | k = ср /сv |
| Гелий Не | 12,60 | 1,660 | |
| Аргон Аг | 12,48 | 1,660 | |
| Кислород 02 | 20,96 | 1,397 | |
| Водород Н2 | 20,30 | 1,410 | |
| Азот М2 | 20,80 | 1,400 | |
| Метан СН4 | 26,42 | 1,315 | |
| Аммиак ЫН3 | 26,67 | 1,313 | |
| Диоксид угле- рода СО2 | 27,55 | 1,302 |
Эта теория устанавливает, прежде всего, несправедливость теоремы о равномерном распределении энергии по степени свободы в области низких и высоких температур. С уменьшением температуры газа происходит «вымораживание» числа степеней свободы молекулы. Так, для двухатомной молекулы происходит «вымораживание» вращательных степеней свободы и она вместо пяти имеет три степени свободы, а следовательно, и меньшую внутреннюю энергию и теплоемкость. С увеличением температуры у многоатомных молекул происходит возбуждение внутренних степеней свободы за счет возникновения колебательного движения атомов молекулы (молекула становится осциллятором). Это приводит к увеличению внутренней энергии, а следовательно, и теплоемкости с ростом температуры.
Теплоемкость реального газа зависит от давления, правда, очень слабо.
Поскольку теплоемкость реального газа зависит от температуры, в термодинамике различают истинную и среднюю теплоемкости.
Средней теплоемкостью сср данного процесса в интервале температур от t1 до t2 называется отношение количества теплоты, сообщаемой газу, к разности конечной и начальной температур:

Выражение
 *
*
определяет теплоемкость при данной температуре или так называемую истинную теплоемкость. Из * следует, что

поэтому
 .
.
Для практических расчетов теплоемкости всех веществ сводят в таблицы, причем с целью сокращения объема таблиц средние теплоемкости приводят в них для интервала температур от 0 до t.
ЛЕКЦИЯ 2
