Энтропия необратимых процессов
Введенное в подразд. 2.3 понятие энтропии как функции состояния имеет в дифференциальной форме следующее выражение:
ds = dq / T. (3.10)
 Параметр состояния s, отнесенный к 1 кг рабочего тела (в качестве которого принимался идеальный газ), оказался весьма важной характеристикой, позволяющей широко пользоваться тепловой диаграммой Т, s, что облегчает и углубляет анализ процессов и циклов.
Параметр состояния s, отнесенный к 1 кг рабочего тела (в качестве которого принимался идеальный газ), оказался весьма важной характеристикой, позволяющей широко пользоваться тепловой диаграммой Т, s, что облегчает и углубляет анализ процессов и циклов.
Рассмотрим изменение энтропии термодинамических систем, в которых происходят необратимые процессы.
Пусть изолированная система состоит из двух тел, имеющих различную температуру, причем T1 > T2 (рис. 3.7). Процесс теплообмена будет происходить при конечной разности температур, следовательно, он будет необратимым. Тепло будет передаваться от тела с большей температурой Т1 к телу с меньшей температурой Т2. Энтропия первого тела при передаче тепла dQ уменьшится в соответствии с формулой (3.10) на величину
ds1 = – dQ / T1, (3.11)
а энтропия второго тела возрастет на
ds2 = – dQ / T2. (3.12)
Изменение же энтропии всей рассматриваемой системы
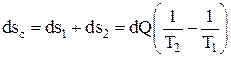 . (3.13)
. (3.13)
Так как по условию T1 > T2, то
dsc > 0. (3.14)
Следовательно, в результате необратимого процесса теплообмена между телами замкнутой изолированной системы энтропия последней возрастает.
Необратимый перенос тепла от горячего тела к холодному может быть осуществлен также посредством совершения необратимого цикла. Для этого термодинамическая система кроме источников тепла (или тел с различной температурой) должна включать в себя рабочее тело. Однако введение рабочего тела не должно повлиять на изменение энтропии системы, так как за цикл рабочее тело возвращается в исходное состояние и изменения его энтропии не происходит: Δsр.т = 0.
Поэтому не только при непосредственном теплообмене между телами, но и в случае совершения изолированной системой необратимого цикла энтропия ее возрастает.
Изменение энтропии изолированных систем, в которых протекают обратимые процессы, равно нулю (из соотношения ds = dQ / T при dsc = 0), тогда в общем случае для любых процессов
dsc … 0. (3.15)
Таким образом, какие бы процессы ни протекали в изолированной системе, ее энтропия не может уменьшаться. Другими словами, энтропия изолированных систем стремится к максимуму. Достижение максимума энтропии соответствует полному тепловому равновесию элементов системы. Самопроизвольные процессы становятся невозможными, система становится неспособной к самопроизвольному изменению состояния.
С этих позиций можно дать следующее определение энтропии. Энтропия есть физическая величина, характеризующая обесценивание, рассеяние, деградацию энергии. Энтропия – мера работоспособности системы.
С принципом возрастания энтропии в замкнутых системах связана теория «тепловой смерти Вселенной», выдвинутая Клаузиусом. «Энтропия мира стремится к максимуму, – заявил Клаузиус, – что достигается при наступлении полного равновесия за счет односторонне протекающих в природе процессов, после чего прекращаются всякие тепловые процессы и наступает «тепловая смерть».
Ошибочность его концепций состояла в том, что он принимал Вселенную в качестве конечной изолированной системы, в то время как она бесконечна.
