Предельные углеводороды. Алканы
Московский государственный технический университет
Имени Н.Э.Баумана
Методические указания
РЕШЕНИЕ ТИПОВЫХ ЗАДАЧ ПО ОРГАНИЧЕСКОЙ ХИМИИ ДЛЯ РАЗЛИЧНЫХ КЛАССОВ СОЕДИНЕНИЙ
Для студентов специальностей
«Безопасность жизнедеятельности в техносфере» и «Охрана окружающей среды и рациональное использование природных ресурсов»
(кафедра Э-9)
Составители:
М. Б. Степанов
Л. А. Хмарцева
Е. А. Якушева
Е.В. Быстрицкая
А.М. Голубев
Москва
Издательство МГТУ им. Н.Э.Баумана
Предисловие
Методические указания к решению задач по органической химии содержат их основные типы по различным классам органических соединений в соответствии с утвержденной в МГТУ им. Н.Э. Баумана программой для студентов специальности «Экология и промышленная безопасность» (кафедра Э-9).
В указаниях подробно рассмотрены примеры решения различных типов задач по органической химии, предлагаемых на кафедре химии при защите лабораторных работ, выполнении домашнего задания.
Учащимся необходимо показать знание химии в различных областях практической деятельности: в профессиональной, бытовой, при решении экологических проблем. Задачи содержат информацию о свойствах веществ, явлениях и процессах, реально проявляющихся в окружающей человека среде.
Задачи для самостоятельной работы могут быть различной сложности, что способствует повышению познавательной активности студентов.
Приведенный список литературы поможет при решении задач и усвоении теоретического материала.
В курсе органической химии рассматривают задачи следующих типов:
1. нахождение плотности паров органических веществ и относительной плотности одного вещества по другому и обратные;
2. вычисление массовых долей и (или) массового отношения элементов в органическом веществе и обратные – вывод формул по массовому отношению или массовым долям элементов в веществе, если дана молярная плотность паров или относительная плотность паров вещества по некоторому газу;
3. вывод формулы органического вещества по массам, количествам или объемам продуктов сгорания или иной реакции;
4. вывод формулы органического соединения с последующим написанием его изомеров и гомологов;
5. вывод массового или объемного состава газовой смеси по известным значениям (количеству, массе, объему) продуктов горения или иной реакции;
6. вывод состава газовой смеси по изменению давления в реакционном сосуде или изменению средней молярной массы смеси;
7. расчет равновесных концентраций газов, исходя из исходных концентраций и константы равновесия, и обратная задача;
8. расчет массы, количества или объема одного из продуктов реакции, если одно из исходных веществ дано в избытке и указан объемный или массовый выход продукта, и обратные задачи;
9. вычисление степени полимеризации, исходя из массы мономера и выхода реакции, и обратная задача – вычисление числа макромолекул по степени полимеризации и выходу реакции.
Задачи подразделяются по основным классам органических соединений.
Предельные углеводороды. Алканы
Общая формула CnH2n+2
Номенклатура представляет собой систему правил, позволяющих дать однозначное название каждому индивидуальному соединению. В настоящее время общепринятой является систематическая номенклатура ИЮПАК (IUPAC - Международный союз теоретической и прикладной химии). Первые четыре представителя углеводородов имеют названия: метан, этан, пропан, бутан. Начиная с пентана названия углеводородов образуют от греческих числительных* с добавлением суффикса – ан: пентан, гексан, гептан, октан, нонан, декен и т.д.
*Греческие числительные (до десяти): 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта, 9 – нона, 10 – дека.
Если, например, необходимо назвать соединение, поступают следующим образом:
1) выбираем главную цепь (самую длинную и разветвленную).
2) нумеруем атомы углерода С с того конца, где больше заместителей, чтобы радикалы получили наименьшие номера. (Сумма цифр заместителей – локантов – должна быть наименьшая).
3) заместители называем по старшинству или в алфавитном порядке.
4) затем даем название углеводорода по главной цепи.
Пример:
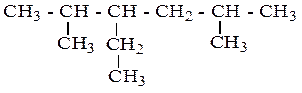
2,5 – диметил – 3 – этилгексан
Изомерия. Основной вид – структурная изомерия углеродного скелета.
Строение. Все атомы углерода - в sp3 гибридном состоянии, угол связи между атомами С составляет - 109,50. В молекулах имеются только δ связи, которые достаточно прочные.
Физические свойства. При содержании в молекуле числа атомов углерода 1…4 – углеводороды находятся в газообразном состоянии, 5…17 - (нормального, т.е. неразветвленного строения) – жидком, равном или более 18 – твердом. Разветвленные углеводороды имеют более низкие температуры кипения.
В воде алканы нерастворимы. Однако они хорошо растворяются в органических растворителях и друг в друге.
Газообразные алканы не имеют запаха и цвета, легче воды.
Основные способы получения алканов.
1. Из природных источников (угля, нефти, газа).
2. Каталитическим гидрированием органических соединений (циклоалканов, алкенов, алкинов, диенов, аренов):
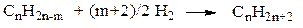
3. По реакция Вюрца:

4. Из галогенопроизводных при замещении галогена водородом:

5. По реакция Гриньяра:
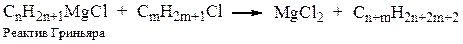
6. Декарбоксилированием солей органических кислот (реакция Дюма):
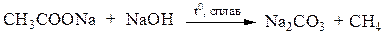
7. Из синтез-газа:
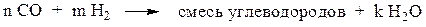
Химические свойства.
Алканы - малоактивные соединения, реагируют в жестких условиях (при нагревании или при освещении УФ – светом (hν), а также в присутствии катализаторов). Возможными для них являются реакции замещения, в которых участвуют, обладающие высокой энергией весьма реакционноспособные радикальные частицы (реакции радикального замещения - SR). 
1. Замещение

2. Термическое разложение алканов – крекинг
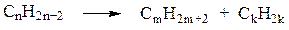
3. Гетерогенно-каталитическое дегидрирование. Катализаторы Pt, алюмосиликаты.
C2 - C5 → алкены (смесь),
C6 - C8 → ароматические углеводороды.
4. Изомеризация в присутствии катализаторов (AlCl3; AlBr3) для углеводородов с числом атомов С ≥ 4
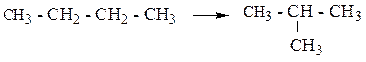
5. Горение
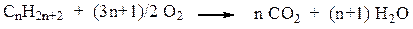
6. Газофазное каталитическое окисление

Задачи
1. Для производства румян используют вазелиновое масло, состоящее, в основном, из смеси алканов С20Н42 и С22Н46. Определите процентный состав этой смеси, если при сгорании массы 155,35 г образуется 185,17 л углекислого газа (н.у), объемный выход по реакции горения 75 %. (Тип № 5).
Решение:
В результате реакций сгорания алканов образуются углекислый газ и вода:


Найдем число молей углекислого газа (СО2) по формуле:
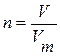 ; где Vm = 22,4 л/моль (молярный объем газа при нормальных условиях: Т = 273 К, р = 1 атм (760 мм. рт. ст. )).
; где Vm = 22,4 л/моль (молярный объем газа при нормальных условиях: Т = 273 К, р = 1 атм (760 мм. рт. ст. )).
Тогда количество вещества углекислого газа составит:
n(CO2)реальное = 185,17/22,4 = 8,267 моль.
С учетом 75% - ного выхода n(CO2)теоретическое = 8,267/0,75 = 11,022 моля
Пусть число молей С20Н42 будет - х, а число молей С22Н46 = y, следовательно, первое уравнение имеет вид:
20 х + 22 у = 11,022 (1)
Молярные массы алканов: М(С20Н42) = 282 г/моль; М(С22Н46) = 310 г/моль. Так как  , то тогда, второе уравнение имеет вид:
, то тогда, второе уравнение имеет вид:
282 х + 310 у = 155,35 (2)
Решаем систему из двух уравнений. Из уравнения (1) найдем значение х:
х = 0,551 – 1,1 у (3)
Подставляем это выражение в уравнение (2) и находим значение у:
155,41 – 0,2 у = 155,35
Отсюда у = 0,3 моль. Из уравнения (3) х = 0,22 моль.
Найдем массу С20Н42:  г; тогда по формуле
г; тогда по формуле  определим процентный состав С20Н42:
определим процентный состав С20Н42: 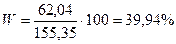 . Следовательно W(С22Н46) = 60,06 %
. Следовательно W(С22Н46) = 60,06 %
Замечание: при расчетах следует брать значения чисел с точностью до третьего знака после запятой, что связано с большими коэффициентами в стехиометрических уравнениях.
2. Перед городским праздником на нефтеперегонном заводе решили заполнить шарики различными предельными углеводородами, полученными при перегонке нефти, чтобы поднять их в воздух. Шарики, заполненные какими углеводородами, могут подняться в воздух? Молярная масса воздуха 29 г/моль. Тип № 1.
Решение:
Запишем первые два члена гомологического ряда алканов и их молярные массы. Определим плотности алканов по воздуху:
М(СН4) = 16 г/моль; М(С2Н6) = 30 г/моль;
Относительная плотность первого газа по второму обозначается D и представляет собой отношение массы определенного объема одного газа к массе такого же объема другого газа (взятого при тех же условиях):  , где М2 – молярная масса воздуха. Часто плотность газа определяют по отношению к воздуху. Хотя воздух является смесью газов, все же говорят о его средней молярной массе. Она рана 29 г/моль.
, где М2 – молярная масса воздуха. Часто плотность газа определяют по отношению к воздуху. Хотя воздух является смесью газов, все же говорят о его средней молярной массе. Она рана 29 г/моль.
Тогда: Dвозд = 16/29 = 0,55 < 1 – шар полетит;
Dвозд = 30/29 = 1,1 > 1 – шар не полетит, поэтому проверять остальные алканы бесполезно.
Ответ: Метан. Не следует забывать о его горючести, поэтому надежнее пользоваться гелием.
3. Выведите формулу углеводорода – основного компонента газовой смеси, используемой для ремонты дорог, если его относительная плотность по кислороду  и он является алканом. (Тип № 1, обратная задача).
и он является алканом. (Тип № 1, обратная задача).
Решение: Относительная плотность вещества рассчитывается по формуле:  , где М1 – молярная масса неизвестного углеводорода, М2 – молярная масса кислорода (32 г/моль). Отсюда:
, где М1 – молярная масса неизвестного углеводорода, М2 – молярная масса кислорода (32 г/моль). Отсюда:
М1 = 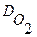 ∙ 32 = 1,375 ∙ 32 = 44 г/моль;
∙ 32 = 1,375 ∙ 32 = 44 г/моль;
Так как неизвестное вещество относится к алканам, их общая формула C2nH2n+2, то, таким образом, М(C2nH2n+2) = 12n + 2n + 2 = 14n + 2 = 44
Из уравнения n = 3, т.е. искомое вещество – пропан.
Ответ: С3Н8.
4. Синтез этилена чаще всего проводится крекингом этана. Этилен, как известно, является мономером в реакции полимеризации для получения полиэтилена. При крекинге этана происходит следующая обратимая реакция:
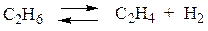
Пусть равновесные концентрации участников реакции составляют
[C2H6] = 6 моль/л; [C2H4] = 4 моль/л.
Определить константу равновесия Кс дегидрирования этана и его начальную концентрацию. Начальные концентрации продуктов раны нулю. (Тип № 7).
Решение: Выражение константы равновесия для реакции имеет вид:

В условии задачи не дана равновесная концентрация водорода, однако из стехиометрического уравнения реакции очевидно, что [H2] = [C2H4] = 4 моль/л.
Тогда найдем выражение КС из уравнения:

Исходная концентрация этана составит: С0(С2Н6) = [C2H6]равн + Спрорег.
С учетом стехиометрического уравнения, этана прореагировало 4 моль/л. Таким образом: С0(С2Н6) = 6 + 4 = 10 моль/л.
Ответ: КС = 2, 667; С0(С2Н6) = 10 моль/л.
5. В каком массовом соотношении используют смесь пропана и бутана для заправки садовых газовых баллонов вместимостью 5 кг, если при использовании газа из одного такого баллона образуется 7,653 м3 углекислого газа (н.у)?
Решение: Найдем количество вещества углекислого газа (СО2) по формуле:
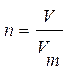 ; где Vm = 22,4 л/моль (молярный объем газа при нормальных условиях: Т = 273 К, р = 1 атм (760 мм. рт. ст. )).
; где Vm = 22,4 л/моль (молярный объем газа при нормальных условиях: Т = 273 К, р = 1 атм (760 мм. рт. ст. )).
Отсюда: n(CO2) = 7653/22,4 = 341,65 моль.
Уравнения сгорания углеводородов:


Пусть масса пропана будет х г, тогда масса бутана - (5000 – х) г.
Молярные массы алканов равны:
M(C3H8) = 36 + 8 = 44 г/моль; М(С4Н10) = 58 г/моль.
Рассчитаем число моль веществ по формуле  , тогда:
, тогда:
n(C3H8) = x/44; n(C4H10) = (5000 – x)/58
Найдем общее количество углекислого газа, выделившегося в результате реакций горения алканов:
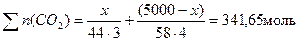
Видно, что х = 4000 г (масса пропана), следовательно, m(C4H10) = 1000 г.
Ответ: массовое соотношение газов 4 : 1.
6. Выведите формулу добавки к моторному топливу и укажите меры предосторожности при работе с ним, если в этом веществе 64,09 % по массе занимает четырехвалентный элемент, порядковый номер которого численно равен молярной массе диена с плотностью паров 3,661 г/л. Добавка включает предельный углеводородный радикал с долей водорода 17,24 %. (Тип № 2).
Решение: Определим четырехвалентный элемент.
Общая формула алкадиенов - CnH2n-2. Рассчитаем молярную массу диенов по формуле:  , где ρ – плотность паров (г/л), V = 22,4 л/моль (н.у).
, где ρ – плотность паров (г/л), V = 22,4 л/моль (н.у).
Тогда М(CnH2n-2) = 3,661 г/л ∙ 22,4 л/моль = 82 г/моль.
Элемент имеет порядковый номер 82. Это свинец – Pb, находится в IV А подгруппе. Далее определим массу предельного радикала CnH2n+1. Составим пропорцию:
14n + 1 - 100 %
2n + 1 - 17,24 %
Из этой пропорции находим n = 2, т.е. R = С2Н5 – этил.
Добавка – тетраэтилсвинец (С2Н5)4Pb.
Ответ: (С2Н5)4Pb.
Свинец и его соединения - ядовитые вещества. Желательно избегать попадания бензина на кожу и уж ни в коем случае не переливать его из бака автомобиля шлангом.
Алкены. Олефины
Общая формула СnH2n. Эта формула совпадает с общей формулой циклоалканов, поэтому алкены и циклоалканы являются межклассовыми изомерами.
Номенклатура. В неразветвленных алкенах нумерацию начинают с того конца, где ближе двойная связь. В разветвленных алкенах главная цепь обязательно включает двойную связь, даже если она не самая длинная. Перед названием главной цепи помещают номер атома углерода С, при котором есть заместитель, и его название. Номер после названия главной цепи указывает положение двойной связи. Названия отдельных гомологов производят заменой суффикса – ан в соответствующих алканах на суффикс – ен (этан – этен, пропан – пропен и т.д.)
Пример:
 СН3 – СН = СН – СН - СН3
СН3 – СН = СН – СН - СН3
СН3
4 – метил – пентен - 2
Изомерия:
1) Структурная изомерия углеродного скелета;
2) Пространственная (геометрическая) цис - транс – изомерия обусловлена различным положением заместителей относительно плоскости двойной связи:
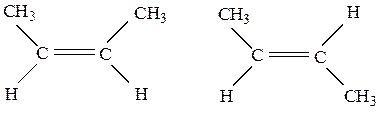
цис – бутен – 2 транс – бутен – 2
Строение: атом углерода при двойной связи находится в sp2 - гибридном состоянии.
Физические свойства. Имеют более низкие температуры кипения и плавления, чем соответствующие алканы: С2...С4 - газы; С5…С15 – жидкости; С ≥ 16 – твердые вещества.
В воде алкены нерастворимы, хорошо растворяются в органических растворителях. Пары алкенов имеют характерный резкий запах.
Получение.
1. Крекингом алканов, из нефти и газа.
2. Каталитическим дегидрированием алканов, катализаторы Cr2O3, Pt при to:
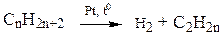
3. Мономолекулярной дегидратацией спиртов (катализаторы: концентрированная H2SO4 или Al2O3 в газовой фазе):
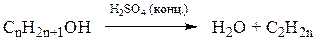
4. Дегалогенированием дигалогенопроизводных:
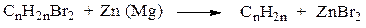
5. Дегалогенированием галогенпроизводных алканов в спиртовых растворах щелочей при нагревании по правилу А.М. Зайцева:
Правило А.М. Зайцева: при отщеплении воды от спиртов, HBr и HCl от алкилгалогенидов атом водорода преимущественно отщепляется от того из соседних атомов углерода, который связан с наименьшим числом атомов водорода (от наименее гидрогенизированного атома углерода).
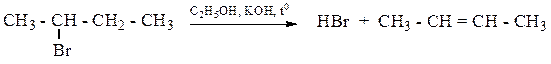
Химические свойства. Для алкенов характерны реакции электрофильного присоединения по двойной связи (АЕ), идущие легко по ионному механизму через стадию образования наиболее устойчивого карбокатиона.
Электрофильные реагенты (электрофилы) – частицы, образующие новую ковалентную связь за счет электронной пары реакционного партнера. Такие частицы могут нести положительный заряд (Н+, Br+) или быть электронейтральными (AlCl3).
1. Присоединение галогенов (качественная реакция на алкены) и водорода:
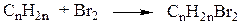
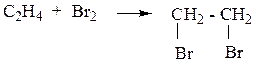
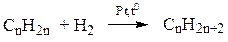
2. Присоединение Hhal и Н2О по правилу В.В. Марковникова:
Правило В.В. Марковникова: при присоединении протонных кислот и воды к несимметричным алкенам водород присоединяется по месту двойной связи к наиболее гидрогенизированному (связанному с наибольшим числом атомов водорода) атому углерода, а галоген – к наименее гидрогенизированному.
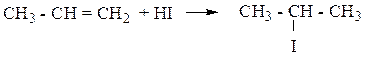
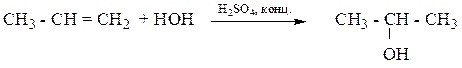
3. Окисление водным раствором KMnO4 при низкой температуре (качественная реакция).

4. Окисление алкенов KMnO4 или K2Cr2O7 с разрывом двойной связи в кислых растворах при нагревании:
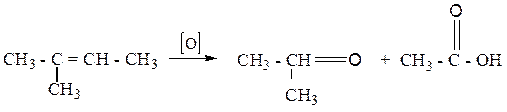
5. Горение:

6. Полимеризация:
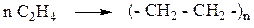
Задачи
7. Определите объем кислорода (н.у), необходимый для сгорания этиленпропиленовой смеси массой 100 г, если в смеси было 1,5 моль С3Н6.
Решение: Найдем массу пропилена по формуле  , где М(C3H6) = 42 г/моль. Тогда m(C3H6) = 1,5 ∙ 42 = 63 г; m(C2H4) = 100 – 63 = 37 г.
, где М(C3H6) = 42 г/моль. Тогда m(C3H6) = 1,5 ∙ 42 = 63 г; m(C2H4) = 100 – 63 = 37 г.
Зная молярную массу этилена М(C2H4) = 28 г/моль, найдем его количество вещества по формуле:
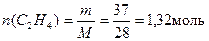
Реакции горения смеси алкенов:


Из уравнений реакций находим общее число молей кислорода:
n(O2) = 1,32 ∙ 3 + 1,5 ∙ 4,5 = 10,71 моль.
Тогда рассчитаем объем кислорода по формуле: 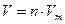 , где Vm = 22,4 л/моль (молярный объем газа при нормальных условиях).
, где Vm = 22,4 л/моль (молярный объем газа при нормальных условиях).
V(O2) = 1,71 ∙ 22,4 = 240 л.
Ответ: потребуется 240 л О2.
Примечание: Задача немного усложняется, если для сжигания используют воздух, что и происходит на практике. В воздухе содержится 21 объемный (или мольный) процент О2.
Vвозд. = 240/0,21 = 1143 л
Ответ: потребуется 1143 л воздуха.
8. В 1938 г. Планет, проводивший опыты с галагенопроизводными углеводородов, случайно получил вещество чрезвычайной прочности. Повторение опытов дало аналогичные результаты. Определите состав молекулы этого вещества и укажите область применения, если его средняя молярная масса 20000 – 30000 г/моль, доля фтора в нем 76 %, остальное - углерод. (Тип № 3, 9).
Решение: Пусть молярная масса вещества будет 30000 г/моль. Так как в веществе находится 76% фтора, то тогда масса фтора составит: m(F) = 30000 ∙ 0,76 = 22800 г.
Зная молярную массу фтора M(F) = 19 г/моль, найдем число его молей по формуле:
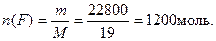
Тогда масса углерода составит: m(C) = 30000 – 22800 = 7200 г. Молярная его масса М(С) = 12 г/моль.
Найдем число молей углерода: n(C) = 7200/12 = 600 моль; следовательно, n(F) : n(C) = 1200 : 600 = 2 : 1. Наше вещество – тефлон.
Ответ: тефлон ( - CF2 - CF2 -)n.
9. Бехер случайно открыл «маслородный газ, активнее чем метан», когда, проводя опыты с серной кислотой, добавил в нее этанол. Затем эту смесь ученый принес над пламенем горелки и увидел «иной тип, чем горит спирт». Определите вещество, полученное Бехером и его количество, если реакция в данных условиях равновесна, количество взятого спирта было 3 моль, константа равновесия реакции КС = 1,4. (Тип № 7).
Решение: В системе идут следующие реакции:
C2H5OH + H2SO4(конц). → С2Н5 – О – SO3H + H2O

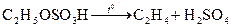
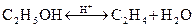
Пусть прореагировало х моль спирта. Равновесные концентрации веществ определяются по формуле: [Сравн] = С0 – Спрореаг., где С0 – начальная концентрация вещества.
Тогда равновесная концентрация этилового спирта равна [C2H5OH] = 3 – х. С учетом стехиометрических коэффициентов, равновесные концентрации этилена и воды будут составлять [C2H4] = х; [H2O] = х. Отсюда выражение константы равновесия примет вид:
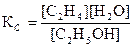 ;
; 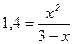
Из уравнения значение x о= 2,87 моль.
Ответ: полученное вещество – этилен, n(C2H4) = 2,87 моль.
10. Каковы массовые доли элементов в этилене, используемом в качестве мономера для производства полиэтилена? (Тип № 2).
Решение: Формула этилена – C2H4. Его молярная масса: М(C2H4) = 12 ∙ 2 + 4 = 28 г/моль. Следовательно, массы углерода и водорода будут:
m(C) = 24 г; m(Н) = 4 г.
Найдем массовые доли элементов по формуле:
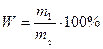 , где m1 – масса определенного элемента в этилене, m2 – масса этилена. Тогда,
, где m1 – масса определенного элемента в этилене, m2 – масса этилена. Тогда, 

Ответ: W(C) = 85,7%; W(H) = 14,3%.
11. Определите массу и объем этилена, необходимого для производства полиэтилена высокого давления при давлении 8 атм, и температуре 250 0С для покрытия 30 км труб диаметром 2,5 м с толщиной полимерной пленки 2 – 4 мм, если выход по реакции полимеризации около 70 %. (Тип № 8).
Решение: Уравнение полимеризации этилена: nC2H4 → (- CH2 – CH2 -)n
Переведем давление в кПа, объем в литры, температуру в Кельвин: р = 101,3 ∙ 8 = 810,4 кПа; V = 30 ∙ 103 м ∙ 2,5 м ∙ 4 ∙ 10-3 м = 300 м3 = 3 ∙ 105 л, T = 273 + 850 = 1123 К.
Для расчета количества вещества этилена воспользуемся уравнением Менделеева – Клайперона: pV = nRT:
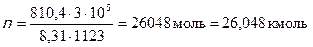
Рассчитаем массу этилена по формуле:  , молярная масса М(С2Н4) = 28 г/моль. Тогда m(C2H4) = 26,048∙28 = 729,3 г.
, молярная масса М(С2Н4) = 28 г/моль. Тогда m(C2H4) = 26,048∙28 = 729,3 г.
С учетом 70 % - ного выхода полимеризации, масса и объем этилена будут равны:
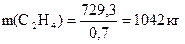

Ответ: m(C2H4) = 1042 кг; V(C2H4) ≈ 43 м3.
Диеновые углеводороды (диены)
Рассмотрим сопряженные диены.
Общая формула CnH2n-2.
Наиболее важные члены гомологического ряда:
1,3 – бутадиен (дивинил) СН2 = СН – СН = СН2 и
 2 – метил – 1,3 – бутадиен (изопрен) СН2 = С – СН = СН2
2 – метил – 1,3 – бутадиен (изопрен) СН2 = С – СН = СН2
СН3
Номенклатура. По систематической номенклатуре обе двойные связи находятся в главной цепи. Нумерация атомов углерода С - с того конца, где ближе двойные связи. Окончание – диен.
Изомерия:
1) углеродного скелета;
2) положения двойных связей;
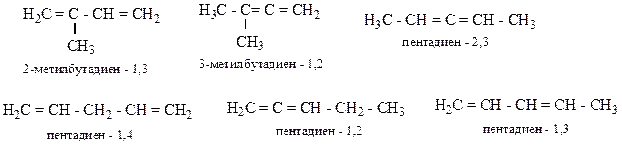
3) цис ↔ транс;
4) межклассовая (с алкинами).
Строение. Все атомы углерода С находятся в одной плоскости, углы между связями 1200, sp2 – гибридизация.
Возникает такое влияние атомов в молекуле, когда перекрывание π – элктронных облаков двойных связей приводит к образованию общего π -электронного облака, которое охватывает всю систему сопряжения (π, π – сопряжение или мезомерный эффект).
Физические свойства: Бутадиен – 1,3 - легко сжижающийся газ с нейтральным запахом. Изопрен – жидкость с tкип. = 340 С.
Получение.
1. Дегидрированием алканов (условия: 500…600 0С, катализаторы – Al2O3, ZnO, Cr2O3).
2. Синтезом из этанола (метод С.В. Лебедева):

(катализаторами могут быть MgO, Cr2O3).
3. Дегидратацией 1,3 - или 1,4 бутандиола (t0; концентрированная H2SO4):

Химические свойства.
Характерны реакции присоединения, которые приводят к образованию смеси двух продуктов 1,2 и 1,4 – присоединение (основной) с перемещением двойной связи. Электрофильное присоединение - АЕ.
1. Присоединение Hal2, H2, Hhal (правило В.В. Марковникова)
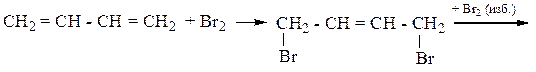
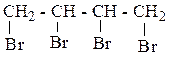


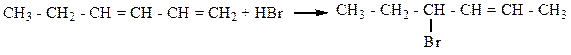
2. Горение

3. Полимеризация – получение каучуков
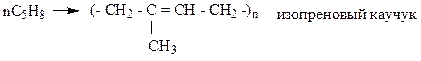
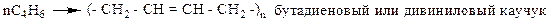
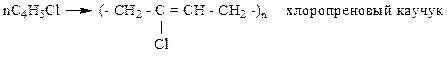
Сополимеризация 1,3–бутадиена со стиролом в соотношении 4:1 дает бутадиен-стирольный каучук:

Сополимеризация 1,3–бутадиена с акрилонитрилом дает бутадиен-нитрильный каучук:

Резины получают из каучука «смешиванием макромолекул за счет большинства оставшихся С=С связей S ― S мостиками. Полное смешивание макромолекул приводит к образованию твердого, неэластичного эбонита.
Задачи
12. Определите выход реакции С.В. Лебедева, если на изготовление одной пары резиновых сапог пошла резина, полученная из 850 г бутадиенового каучука, для чего потребовалось в 1985 г. 96 % этанола, выход реакции полимеризации 80%. Тип № 8.
Решение:
Практическая масса 1,3 – бутадиена составляла: m(C4H6) = 850/0,8 = 1062,5 г.
Найдем массу этилового спирта: m(C2H5OH) = 1985 ∙ 0,96 = 1905,6 г.
Молярная масса этилового спирта: M(C2H5OH) = 24 + 6 + 16 = 46 г/моль. Найдем количество вещества этилового спирта: 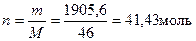 .
.
Реакция С.В. Лебедева:

Из уравнения реакции следует, что число молей 1,3 – бутадиена будет равно: n(C4H6) = 41,43/2 = 20,71моль.
Молярная масса 1,3 – бутадиена: М(C4H6) = 48 + 6 = 54 г/моль.
Теоретическая масса 1,3 – бутадиена: 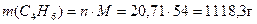 .
.
Выход реакции С.В. Лебедева: 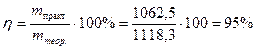
Ответ: η = 95 %.
13. В бытовом радиоприемнике произошло возгорание от перепада напряжения в сети, воспламенилась изоляционная резина. Не отравятся ли члены семьи, если войдут в комнату, площадью 12 м2, с высотой потолка 2,5 м. ПДК(SO2) = 3 мг/л, а сгоревшая резина была получена из 40 г этанола с выходом 80%, содержание серы в ней 5…19 %? (ПДК – предельно допустимая концентрация данного вещества.) Тип № 8.
Решение:
Объем комнаты составит: V = 12 ∙ 2,5 = 30 м3 = 30 ∙ 103 л.
Уравнение реакции получения дивинила из этилового спирта (метод С.В Лебедева):
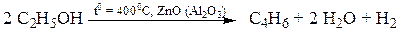
Найдем число молей этилового спирта:  , тогда из уравнения реакции следует, что число молей дивинила с учетом его 80% выхода, составит: n(C4H6)факт. = 0,87/2 ∙ 0,8 = 0,35 моль.
, тогда из уравнения реакции следует, что число молей дивинила с учетом его 80% выхода, составит: n(C4H6)факт. = 0,87/2 ∙ 0,8 = 0,35 моль.
Считаем, что m(C4H6) ≈ mрезины. Найдем массу резины:  .
.
Масса серы в резине составит: m(S) = 18,9 ∙ 0,1 (10 %) = 1,89 г.
Уравнение реакции горения серы:
S + O2 → SO2
Молярные массы серы: M(S) = 32 г/моль; сернистого газа: М(SO2) = 64 г/моль. Определим количество вещества серы: 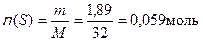 , из уравнения реакции следует, что число молей сернистого газа составит тоже 0,059 моль. Тогда его масса будет:
, из уравнения реакции следует, что число молей сернистого газа составит тоже 0,059 моль. Тогда его масса будет: 
Концентрация SO2 в комнате: С(SO2) = 3,78/0,03 = 0,126 мг/л, что ниже ПДК.
Ответ: Отравления не будет.
14. Выберите название вещества СН2 = СCl – C(CH3) = CCl – CH3
1) 2,4 – дихлор - 3- метилпентадиен – 2,4;
2) 2,4 – дихлор - 3- метилпентен – 2;
3) 3 – метил - 2,4 – дихлор - пентадиен – 2,4;
4) 2,4 – дихлор- 3- метилпентадиен – 1,3.
Ответ: правильно 4 - ый.
