Изотермы реальных газов. Понятие о фазовых переходах
Переход из одного состояния вещества в другое называется фазовым переходом. Испарение и конденсация являются примерами фазовых переходов.
Все реальные газы (кислород, азот, водород и т. п.) при определенных условиях способны превращаться в жидкости. Однако такое превращение может происходить только при температурах ниже определенной, так называемой критической температурыTкр. Например, для воды критическая температура равна 647,3 K, для азота 126 K, для кислорода 154,3 K. При комнатной температуре (≈ 300 K) вода может находиться и в жидком, и в газообразном состояниях, а азот и кислород существуют только в виде газов.
Испарением называется фазовый переход из жидкого состояния в газообразное. С точки зрения молекулярно-кинетической теории, испарение – это процесс, при котором с поверхности жидкости вылетают наиболее быстрые молекулы, кинетическая энергия которых превышает энергию их связи с остальными молекулами жидкости. Это приводит к уменьшению средней кинетической энергии оставшихся молекул, т. е. к охлаждению жидкости (если нет подвода энергии от окружающих тел).
Конденсация – это процесс, обратный процессу испарения. При конденсации молекулы пара возвращаются в жидкость.
В закрытом сосуде жидкость и ее пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара, т. е. когда скорости процессов испарения и конденсации одинаковы. Такую систему называют двухфазной. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным.
Число молекул, вылетающих с единицы площади поверхности жидкости за одну секунду, зависит от температуры жидкости. Число молекул, возвращающихся из пара в жидкость, зависит от концентрации молекул пара и от средней скорости их теплового движения, которая определяется температурой пара. Отсюда следует, что для данного вещества концентрация молекул пара при равновесии жидкости и ее пара определяется их равновесной температурой. Установление динамического равновесия между процессами испарения и конденсации при повышении температуры происходит при более высоких концентрациях молекул пара. Так как давление газа (пара) определяется его концентрацией и температурой, то можно сделать вывод: давление насыщенного параp0данного вещества зависит только от его температуры и не зависит от объема. Поэтому изотермы реальных газов на плоскости (p, V) содержат горизонтальные участки, соответствующие двухфазной системе.
При повышении температуры давление насыщенного пара и его плотность возрастают, а плотность жидкости уменьшается из-за теплового расширения. При температуре, равной критической температуре Tкр для данного вещества, плотности пара и жидкости становятся одинаковыми. При T > Tкр исчезают физические различия между жидкостью и ее насыщенным паром.
№31. Второе начало термодинамики
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Формулировки:
1.невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому
2.невозможно превратить теплоту в работу, не производя никакого другого действия
3.вечный двигатель второго рода невозможен
Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
2 начало ТД можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
№32. Прямой и обратный циклы Карно
Цикл Карно — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов. Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении, при этом энтропия адиабатически изолированной (без теплообмена с окружающей средой) системы не меняется.
Пусть тепловая машина состоит из нагревателя с температурой TH, холодильника с температурой TX и рабочего тела. Цикл Карно состоит из четырёх стадий:
- Изотермическое расширение. В начале процесса рабочее тело имеет температуру TH, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты QH. При этом объём рабочего тела увеличивается.
- Адиабатическое (изоэнтропическое) расширение. Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
- Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру TX, приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты QX.
- Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
При изотермических процессах температура остаётся постоянной, при адиабатических отсутствует теплообмен, а значит, сохраняется энтропия:
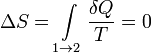 при δQ = 0
при δQ = 0
№33. Теорема Клаузиуса. Понятие об энтропии.
Теорема Клаузиуса: Энтропия замкнутой системы стремится к максимуму.
Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. Возможность протекания эндотермических процессов обусловлена изменением энтропии, ибо в изолированных системах энтропия самопроизвольно протекающего процесса увеличивается ΔS > 0 (второй закон термодинамики).
Энтропия есть параметр состояния, характеризующий свойства макроскопической системы в условиях равновесия. Энтропия системы может изменяться, но переходить из тела в тело она не в состоянии. Переходит только теплота. Таким образом, энтропия приобретает смысл удобного расчетного параметра, который получается, если количество тепла разделить на температуру.
Формула для нахождения энтропии:
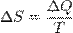
№34. Основное уравнение термодинамики.
1. Основное ур-ние ТД (для равновесных процессов)
dE = TdS – PdV
2. для необратимых процессов - основное термодинамическое неравенство
TdS=TdE + PdV
Основное уравнение термодинамики позволяет ввести характеристические функции (термодинамические потенциалы), изменение которых при изменении состояния системы является полным дифференциалом, т.е. не зависит от способа (пути) перехода от одного состояния к другому.
№35. Изменение энтропии в адиабатных процессах, при теплообмене и расширении газа в пустоту.
Адиабатический процесс – процесс, при котором система не обменивается энергией.
Согласно второму началу термодинамики, при обратимом адиабатическом процессе энтропия постоянна, dS=dQ/T=0, а при необратимом - возрастает. Адиабатический процесс называют изоэнтропийным процессом, т.к.  .
.
Если расширению в пустоту подвергнуть неидеальный газ, температура такого (реального) газа при расширении уменьшается. Дело в том, что в реальных газах заметную роль играет притяжение между молекулами и связанная с этим притяжением потенциальная энергия взаимодействия между молекулами газа. При расширении среднее расстояние между молекулами увеличивается, силы притяжения совершают отрицательную работу, я потенциальная энергия увеличивается. А поскольку полная внутренняя энергия остается постоянной, кинетическая энергия молекул, а значит, и температура газа, уменьшаются.
№36. Свойства энтропии
Энтропия есть параметр состояния, характеризующий свойства макроскопической системы в условиях равновесия. Энтропия системы может изменяться, но переходить из тела в тело она не в состоянии. Переходит только теплота. Таким образом, энтропия приобретает смысл удобного расчетного параметра, который получается, если количество тепла разделить на температуру. Энтропия- величина аддитивная: энтропия макросистемы равна сумме энтропий ее отдельных частей. Одно из важнейших свойств энтропии заключается в том, что энтропия замкнутой (т.е. теплоизолированной) макросистемы не уменьшается - она либо возрастает, либо остается постоянной. Если же система не замкнута, то ее энтропия может как увеличиваться, так и уменьшаться.
