GCP – правила организации клинических испытаний
Билет 13
1) Быстро усваиваемые источники углерода и энергии (прежде всего глюкоза) вызывают значительное и быстрое накопление биомассы у микроорганизмов. Однако биосинтез многих целевых продуктов биотехнологического производства, таких как вторич ные метаболиты и ряд ферментов, при этом резко снижается. Яв ление, вначале называвшееся «глюкозным эффектом», в дальней шем получило название катаболитной репрессии. Применительно к этому явлению введено понятие транзиен- тной репрессии, когда при внесении глюкозы в микробную куль туру, растущую на источнике углерода и энергии, который ас симилируется медленнее глюкозы, происходит временное, но резкое подавление синтеза соответствующего катаболического фермента. Позднее, поскольку в среде присутствует глюкоза, фер мент снова начинает синтезироваться, но с невысокой скоро стью. Другое понятие, которым оперируют применительно к ката болитной репрессии, — исключение индуктора. Глюкоза предот вращает поступление индуктора (менее эффективно используе мого субстрата) в клетку. Еще одно понятие — катаболитное ин- 65гибирование, которое относится к подавлению активности ряда ферментов продуктами быстрого катаболизма глюкозы. Установлено, что катаболитная репрессия наступает в резуль тате быстрого снижения в клетках содержания циклического 3,5- аденозинмонофосфата (цАМФ) под влиянием внесения глюкозы в среду. И наоборот, при удалении глюкозы из среды количество цАМФ в клетках увеличивается. Поскольку образование цАМФ из АТФ катализируется ферментом аденилатциклазой, поэтому для того чтобы изменить активность этого фермента, необходимо по лучить мутации в гене, кодирующем данный фермент. Катаболитная репрессия — неблагоприятное явление, с кото рым приходится считаться биотехнологам, работающим в анти биотической промышленности, при получении методом микро биологического синтеза ферментов медицинского назначения, некоторых рекомбинантных белков. Несмотря на обилие накоп ленных фактов, связь катаболитной репрессии со многими мета болическими процессами, в частности, транспортом углеводов в клетку и экскрецией их из клетки, до конца не изучена. Поэтому помимо подбора сред с ограниченным содержанием глюкозы много внимания уделяется работе с продуцентами, когда, используя методы мутагенеза, селекции и генетической инженерии, полу чают мутанты, нечувствительные к катаболитной репрессии
2)Антибиотиками называют продукты жизнедеятельности организмов, обладающие антибактериальным действием. Большинство известных в настоящее время антибиотиков являются веществами, выделяемыми различного вида микроорганизмами – бактериями, дрожжами, плесенями, актиномицетами. Антибиотики получены также из животных тканей и высших растений (фитонциды).
2) 
14 билет
1) Наиболее общим компонентом клеточной оболочки, прису щим клеткам микроорганизмов, растений и животных, является цитоплазматическая мембрана — двухслойная фосфолипидная субклеточная структура с включенными в нее разнообразными по функциям белками. У микроорганизмов (как и у растений) над цитоплазматической мембраной клетки располагается клеточная стенка, представляющая жесткий полимер, состоящий у высших растений из целлюлозы, у эубактерий и актиномицетов из пепти догликана, а у грибов из слоев хитина, глюкана и маннопротеина (т.е. из разных полимеров). Пространство между внешней и внутренней мембранами, в котором находится клеточная стенка, имеет структуру геля и на зывается периплазматическим. Животные клетки имеют только цитоплазматическую мембра ну. Так как цитоплазматическая мембрана присуща всем клеткам, то из этого следует, что системы регуляции транспорта из среды в клетку необходимых клетке веществ и системы выброса ненуж ных веществ из клетки в среду обязательно связаны с цитоплаз матической мембраной. Клеточная стенка не играет существенной роли ни в транспорте низкомолекулярных метаболитов, ни в ре гуляции этого процесса. Однако внешняя мембрана грамотрица тельных бактерий и, особенно, периплазматическое пространство содержат ряд ферментов, участвующих в процессах транспорта низкомолекулярных соединений. Процессы транспорта через клеточную оболочку подразделяют на пассивную диффузию, облегченную диффузию и активный транспорт. При пассивной диффузии, т.е. в соответствии с градиентом концентрации, когда в среде концентрация выше, чем внутри клетки, в клетку проникают вода, углеводороды, молекулы кис лорода, азота, водорода. В случае облегченной диффузии необходимые клетке вещества переносятся из среды в клетку с помощью пермеаз — особого класса белков, содержащихся в мембране. Переносимое вещество реагирует с пермеазой на наружной стороне мембраны и осво бождается после переноса через мембрану внутри клетки. При об легченной диффузии проникающее в клетку вещество продвига ется по градиенту концентрации. Затрат энергии на этот процесс не требуется, как и при пассивной диффузии. При активном транспорте вещества в клетку, требующем за траты энергии, движение переносимого вещества может проис ходить против градиента концентрации. При этом концентрация накапливающегося в клетке соединения может превзойти в сотни и тысячи раз его концентрацию в среде в связи с тем, что когда мембранный переносчик обращен к наружной поверхности мемб раны, он высокоспецифичен к переносимому им субстрату, ког да же он обращен внутрь клетки, сродство резко снижается в ре зультате диссоциации субстрата и переносчика. Если энергодающие реакции блокируются, например ферментными ядами, реагиру ющими с функциональными группами белковой части фермен тов, то активный транспорт в клетку низкомолекулярных веществ прекращается. Источником акапливаются определенные питательные соединения из среды. Говоря об активном транспорте веществ в клетку, нельзя не упомянуть о системах транслокации (переноса) групп. Их функ ционирование приводит к транспорту в клетку, например, угле водов в виде фосфатных эфиров, а внутриклеточная концентра ция оказывается гораздо выше, чем в среде. Фосфотрансферазы, участвующие в работе таких систем, ини циируют и ряд других реакций в клетке. Вообще транспорт многих субстратов в клетку подвержен регуляции на уровне как биосин теза компонентов этих систем, так и функциональной активно сти уже синтезированных компонентов.
2) Очень важное значение для высокого выхода пенициллина имеет питательная среда, примерный состав которой (в %) следующий:
Кукурузный настой – 3 (по объему)
Сульфат цинка – следы
Лактоза (или глюкоза) – 2 (по весу)
Карбонат кальция – 0,25
Нитрат натрия – 0,6
Магний сернокислый гептагидрат –0,05
Калий фосфорнокислый (однозамещенный) – 0,15
Вода ~ 90
Вместо какурузного настоя успешно применяется мука из хлопковых семян или мясные гидролизаты.
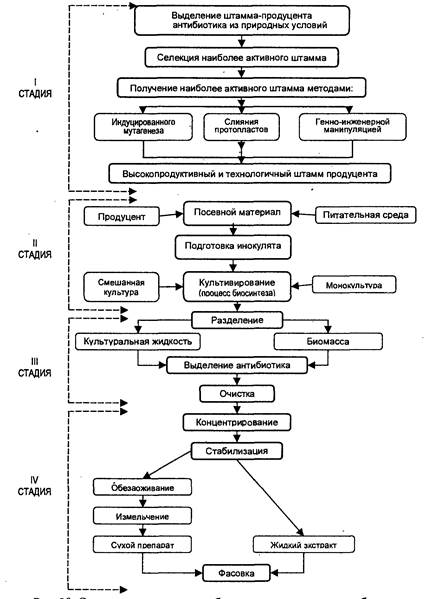
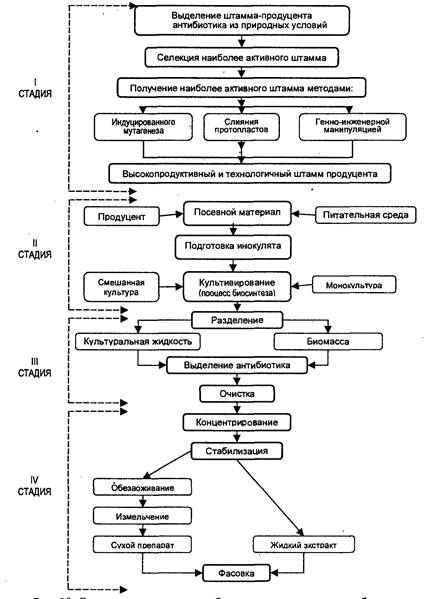
Приготовленную питательную среду подвергают стерилизации. Процесс ведут в колоннах непрерывного действия. Далее питательная среда поступает в аппарат-выдерживатель, где охлаждается в течение определенного времени до температуры 23–25 оС.
Первая стадия процесса – выращивание стандартной колонии штаммов плесени Penicillium chrysogenum – проводится в инокуляторах на питательной среде, где процесс идет ~30 часов. Подготовленный инокулят передают в посевной аппарат, объем которого ~ в 10 раз больше объема инокулятора. В посевном аппарате находится также стерилизованная питательная среда. Процесс роста здесь идет ~15–20 часов, и далее посевной материал передается на ферментацию в большие реакторы – ферментаторы объемом до 100 м3 на питательную среду. Процесс ферментации идет ~70 часов при температуре 23–24 оС, рН среды 6–6,5 и постоянной аэрации воздуха – 1 л воздуха/1 литр питательной среды/1 мин по всему объему ферментатора.
Основная задача этого процесса – создание оптимальных условий для развития продуцента и накопления антибиотика. Биосинтез антибиотика – двухфазный процесс. В течение первой фазы происходит быстрый рост и размножение мицелия или бактериальных клеток. Культуральная жидкость в этот период богата углеводами, азотом и неорганическим фосфором. Продукты обмена веществ микроорганизмов, в том числе и антибиотики, находятся в малых количествах.
Вторая фаза начинается с момента замедления роста культуры. Протекает она в культуральной жидкости, обогащенной продуктом жизнедеятельности организма с небольшим количеством углеводов и фосфора. В начале этой фазы мицелий обладает максимальной способностью к синтезу антибиотика.
Для увеличения выхода антибиотика в питательную среду вводят «предшественники», т. е. химические вещества, способствующие целенаправленному синтезу антибиотика. Так, в питательную среду при биосинтезе пенициллина вводят «предшественник» фенилацетамид – это увеличивает выход антибиотика более чем в 2 раза.
По окончании процесса ферментации культуральную массу передают на процесс выделения антибиотика.
Большинство продуцентов при биосинтезе выделяют антибиотик в водную фазу, поэтому процесс выделения антибиотика начинается с разделения твердой и жидкой фаз.
Твердая фаза, кроме массы мицелия, содержит значительное количество коллоидных примесей, затрудняющих фильтрование, поэтому культуральную массу предварительно подвергают различным типам коагуляции (электролитической, тепловой, кислотной и т. д.). Наиболее эффективным методом коагуляции культуральной массы является ее обработка флокулянтами (высокомолекулярными полиэлектролитами), например, поли-(4-винил)-N-бензилтриметиламмонийхлоридом. Оставшийся от фильтрации мицелия водный раствор антибиотика направляют на химическую очистку и выделение. Таким образом, водный раствор пенициллина направляют после фильтрации на экстракцию бутилацетатом при рН водной среды, равной 2. При таком значении кислотности среды подавляет кислотная ионизация пенициллина в водной фазе и он переходит в органическую фазу (в бутилацетат). Реэкстракцию пенициллина из бутилацетата проводят слабыми растворами щелочей.
Широко применяются сорбционные методы выделения и очистки антибиотиков. В качестве сорбентов широко используются синтетические ионообменные смолы.
Сушат пенициллины методом сублимации или распыления.
Билет 15
II ступень
Билет 16
Виды процессов биосинтеза. Процесс биосинтеза подразделяют на:
• периодический,
• полупериодический,
• непрерывный,
• многоциклический.
Любой биотехнологический процесс (лабораторный или промышленный) реализуют условно в три основных этапа. Первый из них – подготовительный (предферментация), когда необходимо выполнить все подготовительные работы (подготовка и стерилизация питательных веществ (субстрата для культивирования микроорганизмов-продуцентов), наработка (накопление) используемого продуцента, стерилизация и подготовка основного оборудования (реактора – ферментера). Второй этап – основной (ферментация)включает в себя стадию культивирования соответствующего микроорганизма-продуцента и накопления (наработки) целевого продукта. На третьем этапе – постферментационномосуществляется выделение и очистка целевого продукта.
Основные технологические стадии биотехнологического процесса включает:
1. приготовление и стерилизацию питательных сред
2. приготовление посевного материала
3. культивирование
4. обработку культуральной жидкости
5. выделение и очистку биопрепарата
6. получение готовой продукции
К определяющим факторам биотехнологического процесса относят:
· Вид используемого биотехнологического процесса
· Субстрат с его биохимическими и биофизическими характеристиками
· Аппаратурное оформление, включая систему контроля управления
· Технологический режим
· Соответствие требованиям GMP.
Моноклональные антитела
Способ получения моноклональных антител. Такой способ был предложен в 1975 году учеными Г.Келером и К. Мильштейном. Они вводили антиген в организм мыши и получали активно продуцирующие антитела β- клетки. Эти клетки могут жить только в организме хозяина, но если соединить иммунную клетку с клеткой опухолевой (эти клетки называют миеломные лимфоциты), то образуются гибридные клетки со свойствами своих предшественников, так как они способны долго жить в искусственных условиях и одновременно синтезировать антитела. Такие клетки называются гибридомами. Существуют методы отбора отдельных клеток, синтезирующих только один тип антител. Такие клетки помещают в культуральную жидкость, где они растут, образуя много родственных «клонов», синтезирующих большое количество антител под названием моноклональных. Отсюда возникает название монаклональные антитела.
Биотехнология получения моноклональных антител
1. Иммунизация животных – производят иммунизацию животных (мышей), от которых в дальнейшем получают селезеночные клетки (спленоциты), синтезирующие иммуноглобулины (антитела)
2. Гибридизация – создание гибридных клеток, образующих антитела.
После иммунизации необходимо изолировать антителообразующие клетки и размножить в клеточной культуре. Но плазматические клетки, продуцирующие антитела, не способны к размножению и продолжительной жизни в клеточной культуре. Этот барьер преодолевают созданием гибридных клеток, образующих антитела.
Исходным материалом для получения гибридов являются антителообразующая клетка селезенки и быстро делящаяся раковая клетка.
В результате образуется продукт слияния, который обладает способностью к беспредельному размножению в клеточной культуре и биосинтезу одного вида антител.
3. Селекция – производят выделение гибридов путем высева на селективную среду.
4. Клонирование – происходит идентификация и отбор гибридов, продуцирующих специфические иммуноглобулины.
5. Массовое культивирование отселектированного клона гибридом:
2 метода:
1. В виде перевиваемой культуры клеток
2. В виде развития асцитной опухоли, которая развивается в результате введения гибридомной клеточной взвеси мышам в\брюшинно.
В дальнейшем получают асцитную жидкость, из которой выделяют моноклональные антитела.
Концентрация моноклональных антител в клеточной культуре составляет 10³, при втором пути – 105-106 моноклонального антитела в 1мл жидкости.
Билет 17
1) Антибиотиками называют продукты жизнедеятельности организмов, обладающие антибактериальным действием. Большинство известных в настоящее время антибиотиков являются веществами, выделяемыми различного вида микроорганизмами – бактериями, дрожжами, плесенями, актиномицетами. Антибиотики получены также из животных тканей и высших растений (фитонциды).
1. Периодическое культивирование. При этом способе весь процесс развития микроорганизмов полностью завершается в одном ферментаторе, после чего ферментатор освобождается от культуральной жидкости, тщательно промывается, стерилизуется и вновь заполняется свежей питательной средой. Среда засевается изучаемым микроорганизмом, и процесс возобновляется.
2. Отъемный метод. Культивирование микроорганизмов осуществляется в ферментаторах с периодическим отбором части объема культуральной жидкости в ферментаторе и доводится свежей питательной средой до исходного уровня.
3. Батарейный способ. Микроорганизмы развиваются в ряду последовательно соединенных ферментаторов. Культуральная жидкость на определенной стадии развития микроорганизма перекачивается из первого ферментатора во второй, затем из второго в третий и т. д. Освобожденный ферментатор немедленно заполняется свежей питательной средой, засеянной микроорганизмом. При этом способе выращивания микроорганизмов емкости используются более рационально.
4. Непрерывное культивирование. В основе метода лежит принцип непрерывного протока питательной среды, что позволяет поддерживать развитие микроорганизма на определенной стадии его роста. Стадия развития микроорганизма определяется тем, что в этот период происходит максимальный биосинтез антибиотика или другого биологически
активного соединения. Установлено, что в условиях непрерывного процесса биосинтеза некоторых антибиотиков можно получить хорошие результаты, если процесс вести в две стадии. В первом аппарате батареи поддерживают высокую скорость потока, обеспечивающую большую скорость роста продуцента антибиотика, с тем, чтобы получить высокоактивную биомассу, а во втором аппарате – обеспечивают низкую скорость потока и соответственно небольшую скорость роста. Процесс непрерывного культивирования – перспективное направление современной биотехнологии.
Применение
Принимаются эти препараты во время еды или сразу после приема пищи. Дозировка зависит от конкретного лекарства и назначения врача, если корректируется какое-то индивидуальное заболевание. Глотать таблетку (капсулу) нужно целиком, не допуская повреждения оболочки.
Билет 18
1)антибиотикорезистентность – это не что иное, как снижение восприимчивости бактерий к противомикробным препаратам, которые были созданы для их уничтожения. Именно по этой причине лечение, казалось бы, правильно подобранными препаратами не дает ожидаемых результатов.Выделяют четыре основных механизма резистентности анти биотиков: I изменение конформации внутриклеточной мишени для данно го антибиотика. Антимикробный агент проникает в клетку, но его мишень (транспептидаза пептидогликана, рибосома, ДНК-гираза и т.д.) его не «связывает» и подавления метаболизма не происходит; • уменьшение проницаемости оболочки микробной клетки для антибиотика. Антибиотик хотя и проникает в клетку, но в незна чительных количествах; • появление в оболочке клетки системы активного «выброса», проникающего в клетку антибиотика, вследствие чего его внут риклеточная концентрация не может оказываться высокой; • ферментативная инактивация антибиотика защитными фер ментами. Этот последний тип защиты микробной клетки для нее наиболее эффективен и является очень частой причиной неудач антибиотикотерапии. Ферментативной инактивации подвергают ся все важнейшие группы антибиотиков: пенициллины и цефа- лоспорины, аминогликозиды, эритромицин, а также некоторые другие антибиотики.
Пути борьбы с антибиотикорезистентностью Потребность периодического обновления используемых в ме дицине антибиотиков обусловлена постепенным распространением в микромире вариантов резистентности к антимикробным препа ратам. Постоянное применение в клиниках определенного геогра фического региона конкретного антибиотика в течение 20 — 30 и более лет приводит к тому, что резистентные к нему штаммы начинают обнаруживаться все чаще. Применяемые в медицинской практике антимикробные антибиотики, непосредственно с гено мом микроорганизмов не реагируют, т.е. не являются мутагена ми. тказаться от бесконтрольного приема антибактериальных препаратов – они должны назначаться только специалистом и только по конкретным показаниям;
Зеленая галочкаиспользовать только тот антибиотик, который действительно губителен для данного вида бактерий – если принимать препараты из несоответствующей группы, можно сформировать резистентность для других микроорганизмов;
осуществлять антибактериальное лечение в те сроки, которые указаны специалистом – недостаточный прием препарата приводит к неполноценному уничтожению бактерий в организме человека. Как следствие, формируется носительство той клетки, которая уже знакома с принимаемым антибиотиком, и в следующий раз этот препарат просто не подействует.
Если же резистентность выявилась уже в процессе лечения, справиться с ней можно следующими способами:
уточнение чувствительности микроба и назначение препарата из той группы, которая оказывает влияние на данный возбудитель;
сочетание нескольких антибиотиков, каждый из которых обладает своим действием в отношении бактерий;
биохимическая резистентность решается путем использования защищенных антибактериальных средств. В их состав добавлены вещества, нечувствительные к действию ферментов микроба.
2) Ферменты – это катализаторы биологического происхождения. Наиболее ценные свойства ферментов – это высокая активность и специфичность (селективность) действия. Живые организмы содержат сотни и тысячи ферментов, основная функция которых заключается в регуляции практически всех химических реакций, определяющих жизнедеятельность организма.
Приведем классификацию ферментативных реакций.
Это:
1. окисление и восстановление
2. перенос функциональных групп от одних молекул на другие
3. гидролиз
4. реакции с участием двойных связей
5. изомеризация, или структурные изменения в пределах одной молекулы
6. синтез сложных соединений (обычно с энергетическими затратами).
У ферментов сложное пространственное строение, включающее определенную комбинацию химических групп. Имеются сведения, что в природе обнаружено свыше трех тысяч разных специфических ферментов.
Однако, технологическое применение ферментов имеет ограничения по следующим причинам:
1. большая затрата труда на отделение от исходных агентов (как правило ферменты используются однократно)
2. неустойчивость (лабильность ферментов при хранении)
3. большая затрата труда на очистку ферментов, что определяет высокую стоимость их производства.
Сравнительно недавно (несколько десятков лет назад) четко определились пути преодоления этих трудностей. Эти пути связаны с получением иммобилизованных ферментов и иммобилизованных клеток микроорганизмов.
Билет 19
1)Посевным материалом (инокулятом) называют чистую культуру микроорганизма, которую получают путем ее последовательного пересева из пробирки в колбу, а затем в аппараты увеличивающегося объема до количества, необходимого для промышленного производства.
Приготовление посевного материала состоит из следующих этапов:
Для крупномасштабного получения ферментов пригодны только некоторые рас-тительные организмы на определенной фазе их развития (проросшее зерно различных злаков и бобовых, латекс и сок зеленой массы ряда растений), а также отдельные ткани и органы животных (поджелудочная железа, слизистая оболочка желудочно-кишечного тракта, сычуг крупного рогатого скота, семенники половозрелых животных). Практически неограниченный источник ферментов — микроорганизмы (бактерии, грибы, дрожжи), содержащие набор большинства известных в настоящее время энзимов, количество которых можно повысить в десятки и сотни раз методами мутагенеза, селекции и индукции биосинтеза.
Для производства посевного материала используют исходный штамм продуцентов, получаемый из лабораторных чистых культур, который выращивают разными способами на предварительно стерилизованной твердой или жидкой питательной среде до определенного возраста. Посевной материал консервируют (высушиванием или хранением при низких температурах) вплоть до дальнейшего использования. Производственные культуры продуцента получают, выращивая посевной материал микроорганизмов как на поверхности твердых или жидких сред, так и в глубине жидких питательных сред.
Поверхностный метод выращивания продуцентов, предложенный И. Такамине еще в 1894 г., состоит в культивировании микроорганизмов на поверхности увлажненных стерилизованных отрубей, «размещенных в кюветах, к которым иногда добавляют солодовые ростки, древесные опилки, свекловичный жом. Инкубацию микроорганизмов ведут в специальном термостатируемом цехе при постоянном контроле в нем температуры, влажности и подачи воздуха.
В последние 15 лет для выращивания продуцентов ферментов, чаще используют более экономный — глубинный метод культивирования (рис. 1). В промышленных условиях для этих целей применяют ферментеры из нержавеющей стали, снабженные приспособлениями для перемешивания и подачи в жидкую питательную среду стерильного воздуха. Сначала ферментер заполняют питательной средой, автоклавируют, а затем засевают чистой культурой, подаваемой из специального генератора. Для предотвращения инфекции в ферментере поддерживают повышенное давление наряду с оптимальными значениями рН, температуры, редокспотенциала и другими условиями культивирования.наиболее прогрессивным признан проточный метод культивирования микроорганизмов, который обеспечивает непрерывную подачу в ферментер как питательной среды, так и посевного материала. Размножение микроорганизмов и биосинтез фермента регулируют при использовании этого метода по мере поступления питательной смеси в ферментер. Такой ферментер представляет собой вращающийся трубкообразный реактор, через один конец которого в него поступает питательная среда и культура микроорганизмов, а из другого — выводятся ферменты, продукты жизнедеятельности и бактериальная масса. Основное достоинство метода — возможность длительное время поддерживать в автоматическом режиме рост культуры микроорганизма.
Билет 21
1) Питательные среды принято делить на две группы:
1. Среды, требуемые внесения 5-25% природных сывороток (из крови человека или эмбриональных экстрактов крупного рогатого скота)
2. Синтетические питательные среды определенного химического состава.
Назначение питательных сред:
Ø Поддержание оптимальных для роста клеток физико-химических условий
Ø Обеспечение клеток питательными веществами для синтеза биомассы и других продуктов жизнедеятельности
Приготовление питательных сред для ферментационных процессов обычно рассматривается как мало интересная часть общей задачи, но фактически оно является краеугольным камнем, обеспечивающим успех всех последующих этапов. Среды неподходящего состава обусловят низкий уровень ростовых процессов и, следовательно, низкий уровень выхода целевого продукта. Поэтому рассмотрим основные моменты, связанные с этим процессом.
Жидкие компоненты питательных сред (кукурузный экстракт, патоку, мелассу, гидрол, растительные масла, рыбий жир) доставляют на производство в железнодорожных цистернах и хранят в специальных сборниках на складах заводов и транспортируют по коммуникациям с помощью вакуума, сжатого воздуха или перекачивают насосами. Дозировку жидких компонентов осуществляют по массе или по объему в соответствии с прописью среды и контрольными показателями каждой партии этого нестандартного вида сырья.
Сыпучие компоненты сред из транспортной тары забирают или в специальные бункеры или хранят на складах в исходной упаковке. Для транспортировки сыпучих компонентов используют ленточные и винтовые конвейеры, элеваторы, пневматический транспорт.
Жидкие питательные среды приготовляют в аппаратах-смесителях с мешалкой, куда загружают отдельные компоненты в определенной последовательности, установленной по регламенту.
Приготовление сложных комплексных сред, в состав которых, кроме минеральных компонентов и сахаров, входит мука, крахмал, кукурузный экстракт, проводят в нескольких смесителях. Кукурузный экстракт обычно кипятят с мелом для нейтрализации содержащихся в нем аминокислот и органических кислот. Муку, крахмал предварительно заваривают и тщательно перемешивают, чтобы не допустить образования крупных комков, которые могут быть причиной нестерильных операций, поэтому реакторы должны быть снабжены барботерами для подачи пара.
Часто для снижения вязкости питательной среды, содержащей достаточно большую концентрацию кукурузной муки или крахмала проводят их частичный гидролиз амилолитическим ферментом - оризином (продуцент - Aspergillus oryzae) с последующей его инактивавацией нагреванием.
2) Иммобилизованными ферментами называются ферменты, искусственно связанные с нерастворимым носителем, но сохраняющие свои каталитические свойства.
Иммобилизация – физическое разделение биообъекта (клетка, фермент) и растворителя, то есть биообъект закреплен на нерастворимом носителе, а субстрат и продукты свободно обмениваются между биообъектом и растворителем.
Биообъект может работать в этом случае многократно (неделя, месяц). Другими словами можно сказать, что иммобилизация ферментов – это перевод их в нерастворимое состояние с сохранением частичным или полным) каталитической активности.
Преимущества иммобилизации биообъекта:
1. многократность использования ферментов и живых клеток в наиболее продуктивной фазе
2. снижение количества отходов производства
3. повышение качества целевого продукта (он менее загрязнен), более простое выделение целевого продукта (особенно важно для производства инъекционных лекарственных препаратов, когда в продукте мало белка – нет пирогенности и аллергенности).
4. биотехнологический процесс становится более стандартным, более предсказуемым.
5. устойчивость к внешним воздействиям.
Для получения иммобилизованных ферментов обычно применяют следующие методы:
1. Ковалентное присоединение молекул ферментов к водонерастворимому носителю, в качестве которого используют как органические (природные и синтетические) полимеры, так и неорганические материалы. К природным материалам относятся целлюлоза, хитин, агароза, декстраны, бумага, ткани, полистирол, ионообменные смолы и так далее.
2. Захват фермента в сетку геля или полимера.
3. Ковалентная сшивка (сшивание) молекул фермента друг с другом или с инертными белками при помощи би- или полифункционального реагента.
4. Адсорбция фермента на водонерастворимых носителях (часто на ионитах)
5. Микрокапсулирование (захват раствора фермента в полупроницаемые капсулы размером 5-300 миллимикрон).
Такая ситуация приводит к совершенствованию технологических процессов.
В результате иммобилизации ферменты приобретают преимущества гетерогенных катализаторов – их можно удалять из реакционной смеси (и отделять от субстратов и продуктов ферментативной реакции) простой фильтрацией. Кроме того, появляется возможность перевода многих периодических ферментативных процессов на непрерывный режим, используя колонны или проточные аппараты с иммобилизованными
ферментами.
Иммобилизованные ферменты долговечны и в тысячи и десятки тысяч раз стабильнее свободных энзимов. Так, происходящая при температуре 65°С термоинактивация лактатдегидрогеназы, иммобилизованной в 60%-м полиакриламидном геле, замедлена в 3600 раз по сравнению с нативным ферментом. Все перечисленное обеспечивает высокую экономичность, эффективность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
Билет 22
1)
Микроклональное размножение (культура органов растений)
Культуры клеток и тканей для массового размножения растений и оздоровления посадочного материала, в том числе лекарственных растений, нашли широкое применение в растениеводстве. Этот метод, названный микроклональным размножением, позволяет от одной меристемы получить (регенерировать) достаточно большое количество новых растений, в том числе и в культуре in vitro.
Обязательным условием для микроклонального размножения является идентичность полученного растительного материала исходному материнскому растению. Для обеспечения максимальной генетической стабильности клонируемого материала в качестве исходного экспланта используют молодые слабодифференцированные ткани, в частности кончики молодых стеблей и корней, пазушные почки, зародыши, части молодых проростков и другие меристематические ткани. Культуры клеток, полученные из меристематических тканей, дают возможность получить безвирусные клоны. Распределение вирусов в различных частях растения неравномерное, а меристема, как правило, их лишена.
Восстановление целого растения с помощью изолированных культур может происходить разными путями.
Прямая регенерация - это получение растений «в пробирке» непосредственно из верхушечных побегов, пазушных почек и т.д.
Косвенная регенерация - получение целых растений из меристематических тканей, но с промежуточной стадией каллуса. В обоих случаях дифференциация и органогенез управляется фитогормонами. Выросшее в пробирке растение переносится в грунт.
Основное преимущество метода микроклонального размножения, по сравнению с другими классическими методами, - значительно более высокий коэффициент размножения. Если обычным способом (черенками, луковицами, корневищами и т.д.) от одного растения можно получить от 2-3 до 100 растений в год, то методом микроклонального размножения их число можно увеличить от нескольких тысяч до миллиона.
К настоящему времени показана возможность клонировать «в пробирке» около тысячи видов растений. Более чем у ста видов этот метод имеет коммерческое значение. Среди них - декоративные, плодово-ягодные, овощные, древесные, а также некоторые лекарственные растения.
Метод культуры тканей и клеток успешно используется для выведения новых сортов, в том числе и высокопродуктивных лекарственных растений. Для создания нового сорта классическим способом в грунте требовалось 10-30 лет. Благодаря методу культуры тканей этот период можно сократить до нескольких месяцев, поскольку сезонность значения не имеет.
2) 
Билет 23
Билет 24
Ферментаторы с подводом энергии к газовой фазе (рис. 7). Их общий признак – подвод энергии в аппарат через газовую фазу, которая является ее носителем. Ферментаторы характеризуются достаточно простой конструкцией (отсутствуют трущиеся, движущиеся узлы), высокой эксплуатационной надежностью, но имеют не очень высокие массообменные характеристики (коэффициент массопередачи кислорода менее 4 кг/м3·ч). Данные аппараты представляют собой вертикальную емкость, снабженную газораспределительным устройством одного из известных типов.
Барботажный– газораспределительное устройство данного типа обычно устанавливается в нижней части аппарата; подаваемый сверху через распределительную трубу воздух, пройдя через барботер, насыщает кислородом толщу среды. Коэффициент массопереноса кислорода невысок, 1–2 кг/м3·ч.
Барботажно-колонный– в нижней части корпуса такого аппарата устанавливается перфорированная пластина с диаметром отверстий 0,0005 м или сопловой эжектор с диаметром сопла 0,004 м.
Барботажно-эрлифтныйаппарат характеризуется наличием внутри одного или нескольких диффузоров («стаканов») или нескольких перегородок для принудительного разделения восходящих и нисходящих потоков циркулирующей жидкости; эти элементы расположены равномерно по сечению аппарата или концентрично.
Газлифтный колонныйферментатор состоит из двух колонн разного диаметра, соединенных между собой; одна представляет собой барботажную колонну с восходящим потоком воздуха, другая – циркуляционную с нисходящим потоком. Воздух вводится в нижнюю зону аппарата, в барботажную колонну; камера, соединяющая колонны в верхней части аппарата, образует большую поверхность контакта фаз.
Трубчатыйаппарат сконструирован по типу теплообменных труб; взаимодействие газа в трубе при высоких скоростях продувки более интенсивное, чем в большом объеме, поэтому массообмен интенсивнее.
В эжекционных ферментаторах возможна рециркуляция газовой фазы, что экономит субстрат, однак
