Тема: Возбудитель лептоспироза
Цель занятия: Ознакомить студентов с правилами взятия пат. материала, его пересылки в лабораторию и с методами бактериологического и серологического исследования при диагностике лептоспироза. Обучить методике микроскопирования в темном поле, методике постановки реакции микро- и макроагглютинации.
Задание:
1. Приготовить препарат с раздавленной каплей из чистой культуры лептоспир.
2. Просмотреть под микроскопом в темном поле микроскопа.
3. Микрокартину зарисовать.
4. Поставить реакцию микроагглютинации.
Материалы и оборудование: Пробирки с чистой культурой лептоспир, стекла предметные и покровные чистые и обезжиренные, стерильные пастеровские пипетки (одна пачка), пипетки мерные (стерильные, на 1 мл 2 пипетки), резиновые груши, спирт, микроскоп с темнопольным конденсором и осветителем ОИ-17, пробирка с дистиллированной (стерильной) водой — 5 мл, пластины из плексигласа с луночками (или чистые пробирки и штативы к ним), лептоспирозные агглютинирующие сыворотки (две ампулы двух различных серогрупп лептоспир, пробирка стерильного физраствора, антигены для диагностики лептоспироза, реакцией микроагглютинации). Для демонстрации необходимы таблицы, пробирки с культурой лептослир (например, L. biflexa), чашки Петри с агаровой культурой лептоспир два готовых препарата-мазка (один — из культуры лептоспир, окрашенный методом Романовского — Гимзы, другой мазок — обработанный для люминесцентной микроскопии). МЛ-2, нефлуоресцирующее масло, биопрепараты.
Классификация:
Отдел – Firmicutes;
Секция – 1, спирохеты;
Порядок – Spirochaetales (м/о, состоящие из осевой нити, вокруг которой спиралеобразно
закручена цитоплазма. Подвижны.);
Семейство – Spirochetaceae;
Род – Leptospira;
Виды – L.interrogans, L.biflexa.
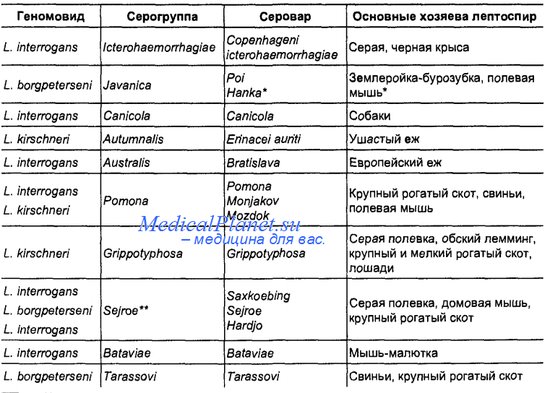
Среди лептоспир различают две группы — патогенные для животных и человека (L. interrogans) и непатогенные (L. biflexa). У патогенных лептоспир выделено 25 серологических групп, более 180 серовариантов (сероваров). Основными возбудителями лептоспироза считают лептоспиры серогрупп батавие, гебдомадис, гриппотифоза, иктерогеморрагие, каникола, помона, тарассови. Лептоспироз –инфекционное заболевание разных видов животных, болеет и человек.Заболевание характеризуется кратковременной лихорадкой, острым и подострым течением болезни, нередко с гемоглобинурией (особенно у телят), анемией, желтушностью, атонией желудочно-кишечного тракта, истощением. Переболевшие животные длительное время остаются лептоспироносителями и лептоспировыделителями. Следует учитывать, что у коров и свиноматок лептоспироз может проявляться абортами.
Патологический материал направляют в лабораторию при жизни животного и посмертно. При жизни животного отправляют кровь 5 мл для бактериологического исследования в период лихорадки и 5—10 мл для серологического исследования, обязательно нужно брать пробу крови от абортировавшего животного. Мочу собирают в стерильные емкости во время естественного мочеиспускания утром (до кормления). Абортированный плод посылают целиком или его желудок с содержимым (перевязанный с двух сторон), паренхиматозные органы плода (отдельно от желудка). Посмертно от крупных животных посылают сердце с перевязанными сосудами, кусочки паренхиматозных органов, почку, лучше целиком (если кусочки, то стараются сохранить корковый слой), транссудат грудной и брюшной полостей, мочевой пузырь с содержимым (перевязанный лигатурой), спинномозговую жидкость. Трупы мелких животных посылают целиком.
Помимо материала от больных (и павших) животных, в лабораторию могут быть направлены для исследования пробы воды (редко корм, навоз). Пробу воды объемом 1—2 л из водоема.
В лаборатории присланный материал положено исследовать в течение 6 часов с момента отбора проб (или гибели животного) и 10—12 часов — при хранении его в охлажденном состоянии, мочу — в течение 3 часов (то есть сроки выживания лептоспир в данных условиях). Лептоспироз диагностируют бактериологическим, серологическим и гистологическим методами.
 Для бактериологического исследования предварительно материал следует подготовить: мочу — центрифугируют (при 10—15 тыс об/мин 30 минут) и исследуют осадок и надосадочную жидкость; кровь (цитратную) отстаивают, исследуют плазму; из проб органов готовят суспензию в стерильном физрастворе, исследуют в нативном состоянии или после центрифугирования.
Для бактериологического исследования предварительно материал следует подготовить: мочу — центрифугируют (при 10—15 тыс об/мин 30 минут) и исследуют осадок и надосадочную жидкость; кровь (цитратную) отстаивают, исследуют плазму; из проб органов готовят суспензию в стерильном физрастворе, исследуют в нативном состоянии или после центрифугирования.
Микроскопия. Лептоспиры плохо воспринимают окраску. Их исследуют методом раздавленной капли (не менее трех мазков) при темнопольном конденсоре  (объектив х20, Х40). Морфологически лептоспиры характеризуются спиралеобразной формой, это прямые или S-образные тонкие светящиеся в темном поле подчужные нитевидные организмы; длина лептоспир 5—20 мкм, диаметр 0,1—0,2 мкм, концы загнуты в виде крючков или имеют булавовидные утолщения. Движение лептоспир может быть поступательное, вращательно-поступательное и колебательное. Жгутиков у лептоспир нет, подвижность их осуществляется за счет сокращений фибрилл осевой нити тела, идущих во встречном направлении от полюсов клетки. Лептоспиры по Граму окрашиваются отрицательно, по Романовскому — Гимзе (при длительной окраске в 48 часов) — в розово-фиолетовый цвет. Рассматривают эти препараты при обычном конденсоре светового микроскопа (конденсор Аббе). Для люминесцентной микроскопии, готовят препараты-мазки из того же материала, окрашивают флуоресцирующим глобулином для диагностики лептоспироза (глобулины агглютинирующей лептоспирозной сыворотки, меченной ФИТЦ). Просматривают препараты в люминесцентном микроскопе.
(объектив х20, Х40). Морфологически лептоспиры характеризуются спиралеобразной формой, это прямые или S-образные тонкие светящиеся в темном поле подчужные нитевидные организмы; длина лептоспир 5—20 мкм, диаметр 0,1—0,2 мкм, концы загнуты в виде крючков или имеют булавовидные утолщения. Движение лептоспир может быть поступательное, вращательно-поступательное и колебательное. Жгутиков у лептоспир нет, подвижность их осуществляется за счет сокращений фибрилл осевой нити тела, идущих во встречном направлении от полюсов клетки. Лептоспиры по Граму окрашиваются отрицательно, по Романовскому — Гимзе (при длительной окраске в 48 часов) — в розово-фиолетовый цвет. Рассматривают эти препараты при обычном конденсоре светового микроскопа (конденсор Аббе). Для люминесцентной микроскопии, готовят препараты-мазки из того же материала, окрашивают флуоресцирующим глобулином для диагностики лептоспироза (глобулины агглютинирующей лептоспирозной сыворотки, меченной ФИТЦ). Просматривают препараты в люминесцентном микроскопе.
Выделение культуры лептоспир, культуральные свойства. Материал высевают на специальные питательные среды – среда Любащенко, Терских (на обычных средах не растут). Из каждой пробы засевают пастеровской пипеткой по 3—5 капель несколько пробирок (5—6) с полужидкой или жидкой средой. Мочу для посева и выделения лептоспир используют только из утренних порций (до кормления животных).
Лептоспиры — факультативные аэробы, культивируются при +28—30°С в течение 3 месяцев. Через 3, 5, 7, 10, а затем каждые 5 дней из содержимого всех пробирок готовят препараты для исследования методом раздавленной капли, просматривают их в темном поле микроскопа. Обычно рост микробов появляется на 3—5-й день. При обнаружении лептоспир по 0,5 мл культуры пересевают в 3—5 пробирок с 5—10 мл свежей питательной среды, культивируют при +28—30 °С. Через 4—7 дней наблюдается максимальное накопление лептоспир в среде. Наличие роста и чистоту культуры определяют просмотром пробирок в луче света от осветителя (ОИ-19) и с помощью микроскопии.
Посевами материала на питательные среды культуру лептоспир не всегда удается выделить. Прибегают к постановке биопробы. Заражают 20—30-дневных золотистых хомяков и 10—20-дневных крольчат (сосунов). Исследуемый материал (кровь, моча, суспензии паренхиматозных органов животных, абортированных плодов и др.) вводят подкожно или внутрибрюшинно: 0,3—0,5 мл хомякам и 2—3 мл крольчатам. В опыт берут по два животных на каждую пробу. На 4—5-й день убивают одно животное; другое, если оно не погибнет,— на 14—16-й день. Животных вскрывают, кровь исследуют в РМА с лептоспирами (антиген) 13 серог-рупп (разведение кровяной сыворотки начинают с 1: 10). Положительная РМА свидетельствует о наличии лептоспир в исследуемом материале. Кроме того, если была выделена культура и нужно определить ее патогенность, животным вводят 5—7-дневную культуру внутрибрюшинно (70—100 лептоспир в поле зрения микроскопа). Высоко вирулентной считают культуру, которая в дозе 0,1 мл вызывает гибель золотистых хомяков на 5—12-й день.
Выделенную чистую культуру исследуют в РМА для определения антигенной (серогрупповой) принадлежности с групповыми агглютинирующими лептоспирозными сыворотками, предварительно разведенными стерильным физиологическим раствором 1 : 50, 1 : 500, 1 : 1000, 1 : 2000, 1 : 4000, 1 : 16 000 и 1 : 32 000. Сыворотки биопромышленность выпускает в двух наборах: первый набор включает 15 сывороток к лептоспирам серогрупп, главным образом гриппотифоза помона,тарассови каникола, иктерогеморрагие, батавие, гебдомадис и др. Второй набор-20 сывороток. Реакцию ставят в пластинах с луночками (или в пробирках), смешивая 0,1 мл сыворотки каждого разведения с 0,1 мл выделенной (типируемой) 5—7—10-С очной культуры лептоспир с накоплением 70—100 подвижных микробных клеток. Разведения сыворотки последовательно удваиваются. Пластины (пробирки) выдерживают 1 час в термостате при +37 "С, затем проводят учет результатов — из каждой лунки (каждого разведения, сыворотки, начиная с наибольшего) готовят препараты раздавленной капли, которые исследуют в темном поле микроскопа. Реакцию оценивают в крестах, основываясь на наличии и характере агглютинации лептоспир: ++++ (четыре креста) — полная 100 %-пая агглютинация лептоспир— склеивание лептоспир с образованием скоплений в виде «паучков», состоящих из разного количества лептоспир (от нескольких клеток до нескольких десятков и даже сотен), свободные концы которых сохраняют подвижность; +++(три креста) — агглютинированы 75% лептоспир; ++ (два креста)—50%-+ (один крест) — агглютинированы 25 %; (—) минус ~ агглютинация отсутствует. Положительную РМА считают если она выражена на четыре, три и два креста. Испытуемую культуру относят к серологической группе лептоспир, с сывороткой которой она дает реакцию на 2—4 креста до 50—100 % ее титра, указанного на этикетке.
Бактериологическое исследование воды осуществляется несколькими методами. Чаще используют следующую методику: пробу воды 500 мл центрифугируют при 10—15 тыс. об/мин в течение 30 минут. Осадок в дозе 2—3 мл вводят подкожно взрослым кроликам, кровь которых предварительно исследовали в РМА на наличие антилептоспирных антител. Результаты должны быть отрицательными. Через 7, 14 и 20 дней кровь кроликов исследуют методом РМА с лептоспирами 13 серологических групп. Положительная РМА в титре 1 : 10 и выше свидетельствует о наличии патогенных лептоспир в данной пробе воды.
Серологическая диагностика лептоспироза осуществляется методами РМА и РА (реакция макроагглютинации). Разработаны также методики РСК и двухступенчатого варианта МФА (флуоресцирующих антител), которые позволяют установить наличие антител у больных лептоспирозом животных. Кровь (сыворотку крови) для исследования необходимо брать на 5-7-й день болезни и повторно — через 7—10 дней
Контрольные вопросы:
1. Возбудитель лептоспироза, его морфологическая, тинкториальная характеристика;
2. Правила взятия и пересылки патологического материала для микробиологической
диагностики лептоспироза;
3. Особенности культивирования лептоспир;
4. Особенности микроскопирования лептоспир;
5. Методы серологической диагностики лептоспироза, серологической идентификации
лептоспир;
6. Антиген для серологических исследований, подготовка материала для
бактериологической диагностики.
Тема: Возбудители микозов
Цель занятия: Ознакомить студентов с правилами взятия патологического материала и методами микологического исследования на дерматомикозы (трихофития, микроспория), кандидамикоз и плесневые микозы.
Задание:
1. Приготовить препараты раздавленной капли из культур грибов;
2. Исследовать культуральные свойства возбудителей.
Материалы и оборудование:Культуры грибов (Trichophyton verrucosum, Microsporum canis, Candida albicans) на среде Сабуро (или другой), патологический материал от животных, больных трихофитией и микроспорией, препаровальные иглы, микологические крючки, предметные и покровные стекла, а также плакаты, таблицы, биопрепараты.
Микозы — группа специфических болезней, вызываемых патогенными микроскопическими грибами, активно паразитирующими в животном организме.
Возбудители дерматомикозов.К дерматомикозам относятся микозы, сопровождающиеся поражением кожи и ее производных. Зона паразитирования возбудителей ограничена тканями, в которых имеется кератин. Болеют сельскохозяйственные животные всех видов (преимущественно молодняк), пушные и хищные звери, а также человек. Возбудителей дерматомикозов относят к высшим несовершенным грибам (класс Deuteromycetes). Несмотря на сходство клинического проявления болезни (стригущий лишай), возбудителей относят к различным родам — Trichophyton(вызывающий трихофитию),Microsporum(вызывающий микроспорию) и Achorion(возбудитель парши). Основными возбудителями трихофитии крупного рогатого скота и овец являются Trichophyton verrucosum, Tr.faviforme, а для других видов животных — Тr. mentagrophytes, Тr. equinum. Тr. gallinae, вызывающие трихофитию у птиц, у млекопитающих, кур и индеек, а также у мышей, крыс, собак, кошек, пушных зверей.
Трихофития – дерматомикоз, характеризующийся появлением облысевших участков кожи, в первую очередь в области головы, затем поражение может распространиться на поверхность тела животного. в области поражения волос ломкий, хрупкий, эпидермис отторгается в виде слипшихся чешуек.
Морфологические и культуральные свойства возбудителей трихофитии млекопитающих. В местах поражения, как это видно в препаратах из патологического материала, гриб располагается снаружи или внутри пораженного волоса в виде правильных рядов септированного мицелия. Аналогичным образом в виде цепочек располагаются округлые или овальные споры, нередко образующие чехол у основания волоса. На питательных средах возбудители трихофитии могут образовывать артроспоры, алейрии, хламидоспоры, микроконидии и веретенообразные макроконидни, одиночные или пучками, расположенные на концах мицелия, чего не наблюдается при паразитировании гриба на животных тканях.
Возбудитель трихофитии — аэроб, хорошо растет на специальных питательных средах. На агаре Сабуро через 10—20 суток инкубирования в термостате при температуре +26—28 °С образует гладкие, кожистые, складчатые, иногда с мучнистым налетом колонии, от которых отходят мощные глубокие ветвления в субстрат.
При трихофитии птиц(фавус — белый гребень, парша) болезнь характеризуется поражением кожи, перьев, внутренних органов. На гребне, сережках, ближе к клюву, обнаруживают корки (скутулы), имеющие серовато-белый цвет.У кошек и собак стукулярная форма возникает на лапах,когтях и голове.При генерализованной форме поражаются голова, оперенная часть туловища, носоглотка зоб, тонкий отдел кишечника.
Морфологические и культуральные свойства возбудителя трихофитии птиц. Trichophyton gallinae имеет часто вид ветвящихся гифов, которые образуют густые скопления в виде войлока. Гифы мицелия септированные, состоящие из прямоугольных клеток с двухконтурной оболочкой. Распавшийся мицелий образует округлые или многогранные споры, располагающиеся цепочками или отдельными скоплениями. Мицелий в молодой культуре тонкий, в старой — грубый, четко сегментированный. Концы мицелия могут иметь различные образования: веретенообразные, боковые вздутая, утолщенные стенки. Края и ветвления на концах могут иметь вид рога оленя, гребешка. В препарате обнаруживаются и хламидоспоры, мицелии с артроспорами, многоклеточными (5—8) макроконидиями. На агаре Сабуро Т. gallinae через 4—5 суток культивирования образует сероватые маленькие колонии, которые к 10—12-му дню достигают размеров 10— 12 мм. Колонии имеют желтовато-белый цвет, розовый, красный или малиновый, гладкую и кожистую поверхность. Позднее они становятся восковидными с морщинистой поверхностью (как губка). Старые культуры сухие с порошкообразным налетом, приобретают серо-белый цвет.
Возбудители микроспории (стригущий лишай)вызывают заболевание у собак, кошек, хищных зверей, редко обезьян, морских свинок, овец и других животных. Болеет и человек, особенно чувствительны дети. Род Microsporum включает три вида Microsporum lanosum, M.equinum и M.gypseum.
Морфологические и культуральные свойства. В патологическом материале грибы рода Microsporum имеют вид разветвленного мицелия, который, распадаясь, образует округлые споры. Вокруг пораженного волоса образуется чехол (муфта), состоящий из спор с беспорядочным мозаичным расположением. На агаре Сабуро с глюкозой при температуре +26—28 °С М. equinum развивается на 6— 7-й день, образуя кожистые колонии, покрытые серо-белым воздушным мицелием. Цвет зрелой колонии желтый или коричневый. Мицелий септирован. Образуемые микроконидии имеют грушевидную форму, макроконидии — многоклеточные. М. canis на сусло-агаре на 3—4-й день образует серовато-белого цвета округлые колонии с концентрическими кругами с лучистым центром. Зрелые колонии желтого и коричневого цвета. Образуемые микроконидии имеют вид многокамерных клеток. М. gypseum на сусло-агаре образует плоские мучнистые желтовато-светло-коричневые колонии. Мицелий ракетообразной формы. Образуемые макроконидии имеют многоклеточную форму. Грибы рода Microsporum продуцируют флуоресцирующий пигмент (птеридин).
Патологическим материалом служат соскобы с пораженных частей тела животного вместе с корочками и чешуйками, пораженные волосы с участков, граничащих со здоровой кожей.
Лабораторные исследования включают микроскопию, люминесцентный анализ и выделение чистой культуры гриба. Микроскопическое исследование является основным в лабораторной диагностике дерматомикозов. Чаще готовят неокрашенные (нативные) препараты. Исследуемый материал помещают в чашки Петри, измельчают ножницами и расщепляют с помощью скальпеля. Затем кусочки волос, чешуек, корочек переносят на предметное стекло, наносят каплю 20 %-ного раствора NaOH или КОН и слегка подогревают над пламенем горелки. После этого добавляют каплю 50 %-ного водного раствора глицерина. На приготовленный таким образом препарат накладывают покровное стекло и просматривают сначала под малым увеличением сухого объектива (Х8), а потом — под большим (Х40) или с помощью иммерсионной системы. Обнаружение мицелия гриба и различных спор в патматериале является достаточным основанием для постановки диагноза на дерматомикозы.
С целью дифференциации грибов родов Trichopthyton и Misrosporum учитывают характер расположения спор в пораженном волосе (цепочками или мозаичное) и результаты люминесцентного анализа. В сомнительных случаях для подтверждения диагноза идентифицируют культуру гриба.
Люминесцентный анализ. Исследуемый материал помещают в чашки Петри и просматривают под ультрафиолетовыми лучами ртутно-кварцевой лампы типа ПРК-2 или ПРК-4 с фильтром Вуда на расстоянии 20 см в затемненном помещении. Пораженные возбудителем микроспории волосы дают яркое зеленоватое свечение под действием у/ф лучей (возбудители трихофитии не флюоресцируют). Корочки, чешуйки не светятся. Кроме того, люминесценция позволяет провести раннюю диагностику атипичных и скрытых форм микроспории.
Выделение чистой культуры. Делают посевы из культуры гриба на специальные питательные среды — Сабуро, сусло-агар, МПА с 2 % глюкозы, Чапека и некоторые другие. Перед высевом патматериала на питательные среды иногда прибегают к его обработке 60%-ным спиртом в течение 5-7 минут, а затем дважды отмывают дистиллированной водой и подсушивают в термостате при +37 °С с целью освобождения от сопутствующей микрофлоры или в питательные среды добавляют антибиотики (пенициллин, стрептомицин) из расчета 100—200 ЕД/мл среды. Посевы инкубируют при температуре +26—28 °С в течение 20—30 суток. У выросших культур грибов изучают культуральные и морфологические свойства.
Возбудители плесневых микозов— это различные виды микроскопических грибов родов Aspergillus, Penicillium, Mucor и др.
Возбудители аспергиллезов относят к высшим несовершенным грибам класса Deuteromyces, рода Aspergillus. Данные грибы — постоянные обитатели организма многих здоровых животных. При нарушении условий содержания и кормления животных, влекущих снижение резистентности организма, грибы могут стать причиной аспергиллеза, а токсинообразующие штаммы вызывают аспергиллотоксикозы.
Аспергиллез— незаразное заболевание домашних и диких птиц, редко млекопитающих (крупный рогатый скот, овцы, свиньи, козы, лошади, пчелы). Болезнь характеризуется гранулематозным поражением органов дыхания, в основном легких. Патологическим материалом служат свежие трупы мелких животных, наложения, узелки, пораженные органы или кусочки их, яйца, соскобы с трупов.
Лабораторный диагноз устанавливают на основании микроскопического исследования препаратов из патматериала и выделения чистой культуры возбудителя. Для посева используют агар Чапека, Сабуро, кровяной, мозговой и кукурузный агары, МПА (рН 5,5—6,5). Гранулематозную ткань обжигают над пламенем, вырезают стерильно кусочки из середины и раскладывают их на агар в 56 чашке Петри, а экссудат засевают в пробирки со средой, инкубируют при +25 и 37°С На 3—5-е сутки на плотных средах образуются характерные для аспергилл колонии.
A. flavus, A. niger на агаре Чапека образуют разрастающиеся широко колонии с обильным спороношением. Цвет колоний зависит от массы конидий, развивающихся на конидиеносцах. Под микроскопом обнаруживают бесцветный или светлоокрашенный септированный мицелий. Часто образуются склероции шаровидной формы, представленные толстостенными клетками.
Возбудители мукоромикоза— различные представители рода Mucor, относящиеся к низшим, совершенным грибам класса Oomycetes. Наиболее часто возбудителем является М.racemosus. Мукоромикоз (фикомикоз)- хроническое заболевание, характеризующееся развитием гранулематозного процесса, сходного с туберкулезом в лимфатических узлах и в легких, реже в других органах и тканях. К возбудителю мукоромикоза восприимчивы свиньи, лошади, крупный рогатый скот, овцы, пушные звери; из лабораторных животных — морские свинки, мыши. Описаны случаи заболевания человека. Материалом для лабораторного исследования являются гной, некротическая ткань, экссудат, гранулематозная ткань. Диагноз ставят на основании микроскопии патологического материала и выделения чистой культуры. При микроскопии препаратов в положительных случаях обнаруживают несептированный мицелий. В крупных спорангиях на спороносной гифе видны развивающиеся споры. Для старых культур характерно наличие хламидоспор.
Для выделения чистой культуры возбудителя кусочки гранулематозной ткани обжигают над пламенем горелки и стерильно вырезают из середины кусочки, которые раскладывают на поверхности среды Чапека (в чашках Петри) или других сред. Инкубируют посевы при +25—30 °С. Культуры грибов вырастают на третьи сутки в виде войлочных клочковатых серовато-белых колоний, в последующем цвет может изменяться до коричневого или бурого.
Микроскопию препаратов, приготовленных из патматериала для исследования на микозы, вызываемые грибами рода Aspergillus, Penicillium и Мисог, проводят в два этапа.
Исследуют под микроскопом (X200 - 300) колонии на месте их роста (в чашках Петри). При этом рассматривают расположение конидиеносцев и спор, наличие или отсутствие воздушного мицелия, общее строение конидиеносного аппарата. Изучают под микроскопом элементы гриба в препарате «раздавленная капля».
Возбудители кандидамикоза— дрожжевидные микроскопические грибы из рода Candida, среди которых наибольшего внимания заслуживает гриб Candida albicans, относящийся к высшим несовершенным грибам. Грибы данного рода факультативные паразиты, постоянно обитающие на слизистых оболочках животных, вызывают заболевание животных — кандидамикоз (кандидоз, монилиоз, молочница и др.), характеризующийся поражением слизистых оболочек пищеварительного тракта и различных органов и тканей. С. albicans в основном поражает птиц, а также кур, гусей, уток, цесарок, индеек, голубей, фазанов и др. Более тяжело болезнь протекает у молодняка. Реже болеют поросята, телята, ягнята, щенки. Возникновению кандидамикоза способствует понижение резистентности организма животных. Кандидамикоз может быть первичным и вторичным (на фоне антибиотикотерапии). Для проникновения гриба в организм животного необходима травма слизистых покровов.
Пат. материалом для исследования являются соскобы со слизистой ротовой полости, пищевода, зоба, налетов, наложений, молоко от коров, больных маститом, и др. Диагноз ставят на основании микроскопии и выделения чистой культуры возбудителя.
Микроскопию патматериала проводят в неокрашенных и окрашенных по Граму, Цилю — Нильсену, Романовскому-Гимзе препаратах. В неокрашенных мазках грибы представлены бесцветными нитями псевдомицелия с перегородками, состоящего из 2—4 вытянутых почкующихся клеток, или густо переплетенным септированным мицелием. Обнаруживают также множество овальных, почкующихся и не почкующихся тонкостенных дрожжевидных клеток — бластоспор, которые имеют фиолетовый, синий или розовый цвет с мелкозернистыми включениями.
Для получения чистой культуры патматериал высевают на агаризованные среды: агар Сабуро, сусло-агар, МПА с добавлением 2 % глюкозы и др. Так как исследуемый материал загрязнен бактериальной микрофлорой его следует обработать 0,5%-ным раствором фенола, в питательные среды добавляют пенициллин и стрептомицин. Инкубируют посевы при температуре +25—30 °С. Первичные колонии вырастают на 2— 3-й день. Для дифференциации выросшие колонии грибов снова пересевают на различные твердые питательные среды (сусло-агар, Сабуро, кукурузный агар, кровяной 5%-ный агар) и в жидкие цветные среды, содержащие 1 % пептона, 1 % реактива Андрадэ, 2 % глюкозы, сахарозы, лактозы. рН питательных сред 2,5-3,0. На твердых средах грибы рода Candida образуют S- и R-формы. При микроскопии S-формы колоний обнаруживают овальные, иногда почкующиеся клетки, в колониях R-формы могут быть и удлиненные клетки псевдомицелия. В жидких средах С. albicans образует пристеночное кольцо и осадок, а на кукурузном агаре — хламидоспоры и бластоспоры.
Контрольные вопросы:
1. Отличительные особенности разных родов дерматомицетов.
2. Патологический материал для исследования на дерматомикозы.
3. Морфологические и культуральные особенности возбудителей дерматомикозов.
4. Люминесцентная микроскопия при дерматомикозах.
5. Возбудители кандидамикоза, аспергиллеза, их культивирование.
6. Патогенные свойства грибов рода Candida.
