Лабораторная работа № 6
Электролиз
Цель работы
1. Познакомиться с электрохимическими процессами, происходящими при электролизе.
2. Научиться записывать уравнения процессов электролиза растворов и расплавов солей, щелочей и кислот.
2. Контрольные вопросы
1. Какой процесс называется электролизом?
2. Какая величина называется «потенциалом разложения»?
3. Каким закономерностям подчиняются количественные соотношения при электролизе?
4. От каких факторов зависит процесс электролиза, на какие группы он делится?
5. .Будут ли отличаться по составу продукты электролиза расплава и водного раствора 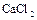 ?
?
6. Составить схемы электролиза водных растворов 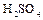 ,
, 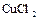 ,
, 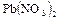 с платиновыми электродами.
с платиновыми электродами.
7. Написать уравнения электродных процессов, протекающих при электролизе водных растворов 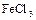 и
и 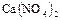 с инертным анодом.
с инертным анодом.
8. Составить схемы электролиза водного раствора сульфата меди, если:
а) анод медный; б) анод угольный.
9. В какой последовательности будут выделяться металлы при электролизе раствора, содержащего в одинаковой концентрации сульфаты никеля, серебра, меди?
10. При электролизе растворов 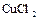 на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде.
на аноде выделилось 560 мл газа (условия нормальные). Найти массу меди, выделившейся на катоде.
11. Вычислить массу серебра, выделившегося на катоде при пропускании тока силой 6А через раствор нитрата серебра в течение 20 минут.
Содержание работы и методические указания к ее выполнению
На «рабочем столе» ПК найдите значок программы « 1C: Химия». После загрузки программы, найдите вкладку «Альбом».
1. Постепенно открывая гипертекстовые ссылки, указанные ниже, наблюдайте проведение опытов и запишите уравнения реакций для следующих процессов электролиза:
· ссылка «Водород»
1.1.Электролиз водного раствора гидроксида калия.
· ссылка «Галогены»
1.2.Электролиз фтороводорода.
1.3.Электролиз хлорида натрия.
· ссылка « Элементы III группы»
1.4.Электролиз раствора оксида алюминия в расплавленном криолите.
· ссылка « Элементы II группы»
1.5.Электролиз расплава хлорида кальция.
· ссылка « Элементы I группы»
1.6 Электролиз расплава гидроксида натрия.
1.7 Электролиз расплава хлорида калия.
· ссылка « Переходные металлы»
1.8 Электролиз водного раствора сульфата марганца.
1.9 Электролитическое рафинирование меди.
Составьте схемы процессов электролиза.
Приложение
Электролизом называется окислительно-восстановительный процесс, протекающий при прохождении электрического тока, подаваемого от внешнего источника, через раствор или расплав электролита. При этом энергия постоянного тока превращается в химическую.
Электролизером называют ячейку с электролитом, в которую помещены два электрода, соединенных с внешним источником постоянного тока. Для исключения взаимодействия продуктов электролиза, образующихся на катоде и аноде, применяют диафрагмы или мембраны. Например, ионообменные мембраны, проницаемые только для ионов одного знака. Обычно катоды изготавливают из графита, стали, ртути, платины и никеля; аноды - из нержавеющей стали, графита, платины, никеля, а также из титана, покрытого оксидами металлов.
Электролиз протекает при определенном значении внешней разности потенциалов, называемом напряжением (потенциалом) разложения U нр. Потенциал разложения - это минимальное значение внешней разности потенциалов, приложенной к электродам, при котором начинается электролиз данного соединения. Это характерная для каждого соединения величина, стандартное значение которой приводится в справочниках.
Для простых соединений типа 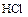 ,
,  ,
, 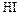 и др. U нр почти совпадает со стандартными окислительными потенциалами процессов их образования.
и др. U нр почти совпадает со стандартными окислительными потенциалами процессов их образования.
Количественные соотношения при электролизе подчиняются общим закономерностям всех электрохимических систем - законам Фарадея. Их общая формулировка: масса электролита, подвергающаяся превращению при электролизе, а так же масса образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ:
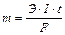 , где
, где
m – масса образовавшегося или подвергшегося превращению вещества; Э – его эквивалентная масса; I – сила тока; t – время; 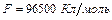 - число Фарадея, т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
- число Фарадея, т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита, материал электродов и режим электролиза (температура, напряжение, плотность тока и др.).
Процессы, протекающие при электролизе можно разбить на группы:
1. электролиз, сопровождающийся химическим разложением электролита;
2. электролиз, сопровождающийся химическим разложением растворителя;
3. электролиз растворов солей ряда металлов с растворимыми анодами из тех же металлов.
Часто 1 и 2 группы объединяют под общим названием электролиза с нерастворимыми (инертными) анодами. Инертные аноды в процессе электролиза химически не изменяются, а служат лишь для передачи электронов во внешнюю цепь.
Примеры электролиза:
1) Электролиз водного раствора 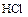 с инертным анодом.
с инертным анодом.
Ионы  и
и  , образующиеся при диссоциации
, образующиеся при диссоциации 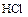 , переносят электричество и участвуют в электродных процессах, что приводит к разложению электролита –
, переносят электричество и участвуют в электродных процессах, что приводит к разложению электролита – 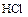 :
:
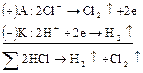
Схематически весь процесс можно представить следующим образом:
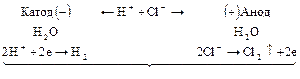
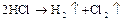
В ходе электролиза уменьшается содержание 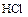 в электролите.
в электролите.
2) Электролиз водного раствора  с платиновыми электродами.
с платиновыми электродами.
Ионы 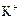 и
и 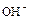 , образующиеся при диссоциации
, образующиеся при диссоциации  , переносят электричество, но в электродном процессе (анодном) участвует только один вид ионов,
, переносят электричество, но в электродном процессе (анодном) участвует только один вид ионов, 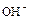 , что не ведет к разложению электролита:
, что не ведет к разложению электролита:
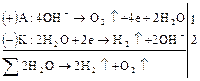
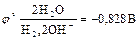
На катоде при более высоком катодном потенциале возможен процесс:
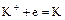 ;
; 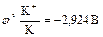
Однако преимущественно протекает процесс разложения молекул воды, разложение  не происходит, его содержание в растворе не меняется, но среда у анода становится более кислотной, а у катода более щелочной. Схема процесса:
не происходит, его содержание в растворе не меняется, но среда у анода становится более кислотной, а у катода более щелочной. Схема процесса:
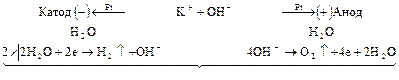
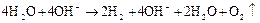
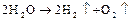
Аналогично происходит электролиз водных растворов 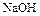 ,
, 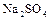 и кислородсодержащих кислот.
и кислородсодержащих кислот.
3) Электролиз водного раствора 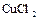 с медными электродами.
с медными электродами.
Ионы 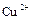 и
и  , образующиеся при диссоциации
, образующиеся при диссоциации 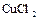 , являются переносчиками электричества, но в электродных процессах принимают участие лишь ионы
, являются переносчиками электричества, но в электродных процессах принимают участие лишь ионы 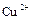 , поэтому катодный процесс обратен анодному:
, поэтому катодный процесс обратен анодному:
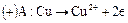
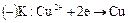
Химического разложения электролита не происходит, если значения выходов по току одинаковы для катодного и анодного процессов. Вследствие электродных процессов и переноса ионов изменяется содержание 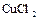 около электродов: в катодном пространстве оно уменьшается, а в анодном - увеличивается. Схема процесса:
около электродов: в катодном пространстве оно уменьшается, а в анодном - увеличивается. Схема процесса:
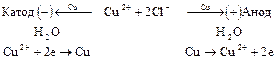
Электролиз расплавов электролитов протекает наиболее просто, поскольку в электролите находится лишь один вид катионов и один вид анионов: 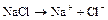
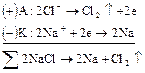
Схема всего процесса:
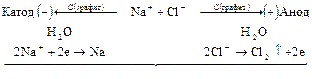
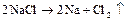
Электролиз растворов электролитов сложен из-за присутствия нескольких видов катионов и анионов, а так же недиссоциированных молекул воды. Когда на одном и том же электроде возможно протекание двух или более процессов, наиболее вероятен тот, осуществление которого связано с минимальной затратой энергии. Последовательность протекания электродных процессов определяется значениями их потенциалов и величиной поляризации. Поэтому на катоде восстанавливаются в первую очередь окисленные формы окислительно-восстановительных систем (окислители) с наибольшим (наиболее положительным) электродным потенциалом, а на аноде окисляются восстановленные формы (восстановители) с наименьшим (наиболее отрицательным) электродным потенциалом.
Литература
1. Степин, Б. Д. Неорганическая химия / Б.Д. Степин, Л.Л. Цветков. – М.: Высшая школа, 1994. – 608 с.
2. Глинка, Н. Л. Общая химия: Учебное пособие для вузов / Н.Л. Глинка / под ред. В.А. Рабиновича. – Л.: Химия, 2002. – 704 с.
3. Швехгеймер, М. Г. Органическая химия / М.Г. Швехгеймер, К.И. Кобраков. – М.: Высшая школа, 1994. – 544 с.
4. Глинка, Н.Л. Задачи и упражнения по обшей химии: Учебное пособие для вузов / Н.Л. Глинка / под ред. В.А. Рабиновича и Х.М. Рубиной. – М.: Интеграл-пресс, 2002. – 240 с.
5. Ахметов, Н.С. Общая и неорганическая химия: Учеб. для вузов / Н.С Ахметов. – М.: Высшая школа, 2003. – 743 с.
6. Угай, Я. А. Общая химия / Я.А. Угай. – Высшая школа, 2000. – 590 с.
7. Угай, Я. А. Общая и неорганическая химия / Я.А. Угай. – М.: Высшая школа, 2000 – 605 с.
