Классификация адсорбционных процессов
В зависимости от природы адсорбционных сил, адсорбция может быть физической и химической.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия. Если молекулы полярны, возникают ориентационное, индукционное и дисперсионное взаимодействия. В случае неполярных молекул возможны только дисперсионные взаимодействия.
Особенности физической адсорбции:
1. Обратимость. Имеет место динамическое равновесие:
Сорбция  Десорбция
Десорбция
Десорбция обусловлена тепловым движением. Например, при адсорбции уксусной кислоты на угле на поверхности возникает адсорбционный комплекс:
С+СН3СООН  С·СН3СООН.
С·СН3СООН.
При десорбции комплекс разрушается и адсорбтив выделяется в химически неизменном виде.
2. Малая специфичность. На полярных адсорбентах адсорбируются полярные вещества, на неполярных – неполярные.
3. Незначительная теплота адсорбции (теплота, которая выделяется при адсорбции). Она составляет всего 8–40 кДж/моль, т.е. соизмерима с теплотой конденсации.
4. С повышением температуры адсорбция уменьшается, так как увеличивается скорость десорбции.
Химическая адсорбция (хемосорбция) возникает в результате химической реакции между адсорбтивом и адсорбентом с образованием нового поверхностного соединения. Процесс происходит только на поверхности адсорбента.
Особенности химической адсорбции:
1. Необратимость. При десорбции с поверхности уходит поверхностное соединение. Десорбция обусловлена какими-то внешними воздействиями.
Например, адсорбция кислорода на угле:
С+О2  С·СО2.
С·СО2.
При нагревании происходит десорбция:
С·СО2  С+СО2.
С+СО2.
2. Специфичность. Адсорбция происходит, только если возможна химическая реакция.
3. Высокая теплота адсорбции, которая может достигать 800–1000 кДж/моль, т.е. сопоставима с тепловыми эффектами химических реакций.
4. Повышение температуры приводит к увеличению хемосорбции, так как увеличивается скорость химического взаимодействия.
Следует подчеркнуть, что явления физической и химической адсорбции чётко различаются в очень редких случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо и лишь небольшая часть – прочно. Например, кислород на металлах или водород на никеле при низких температурах адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать химическая адсорбция.
При постоянной температуре количество адсорбированного вещества зависит только от равновесных давления либо концентрации адсорбата; уравнение, связывающее эти величины, называется изотермой адсорбции.
Теории адсорбции
Рассмотрим некоторые наиболее распространённые теории адсорбции, описывающие отдельные виды адсорбции на поверхности раздела твёрдое тело–газ или твёрдое тело–раствор.
Закон Генри
В основу этой теории положена следующая модель. Поверхность адсорбента однородна и распределение адсорбата происходит в мономолекулярном слое.
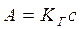 , , 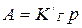 , , | (5.1) |
где p – давление газа или пара, которое связано с концентрацией согласно уравнению Менделеева-Клапейрона, для идеального газа p=cRT, т. е.
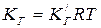 . . | (5.2) |
Уравнения (5.1) представляют собой изотермы адсорбции вещества при малых концентрациях. В соответствии с ними закон Генри можно сформулировать так: величина адсорбции при малых давлениях газа (концентрациях вещества в растворе) прямо пропорциональна давлению (концентрации).
При адсорбции на твёрдых адсорбентах область действия этого закона мала из-за неоднородности поверхности. Но даже на однородной поверхности с увеличением концентрации вещества или давления пара обнаруживается отклонение от линейной зависимости.
