Образец билета тестированного контроля
по теме «Автопротолиз воды. Водородный и гидроксильный показатели. Гидролиз солей»
1. Укажите рН 0,01 н раствора HCl, если a = 80%:
а) 2,1 б) 11,9 в) 10-2 г) 8.10-3
2. Укажите рН 0,001 М раствора СН3СООН, если Kа = 1,8.10-5:
а) 3,87 б) 11,13 в) 1,8.10-3 г) 1,35.10-4
3. Вычислите Kгидр. фторида калия, зная, что Kа = 6,5.10-4:
а) 1,54.10-12 б) 1,54.10-11 в) 1,54.10-10 г) 1.10-14
4. Значения рН и характер среды в водном растворе K2CO3:
а) равна 7, нейтральная б) меньше 7, кислая
в) больше 7 , щелочная г) меньше 7 щелочная
5) Выберите формулу для расчета [Н+] :
а) 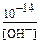 б) [ОН–] в) С.a2 г)
б) [ОН–] в) С.a2 г) 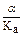
Ответы на задания образца билета ТК:
| Номер вопроса | |||||
| Код ответа | а | а | б | в | а |
ЗАНЯТИЕ 4
Тема: Буферные растворы. Гетерогенное равновесие.
Буферные растворы.
Растворы слабых кислот или слабых оснований в присутствии их солей проявляют буферное действие: рН таких растворов мало изменяется при разбавлении и при добавлении к ним небольших количеств сильной кислоты или щёлочи.
Для вычисления концентрации ионов Н+ и рН в буферных растворах слабых кислот HАn и их солей, образованных сильным основанием, применяют уравнения:
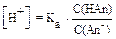 ,
, 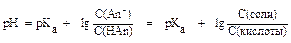
где pKa = - lg Ka.
Аналогично можно рассчитать концентрацию ионов ОН- и рН в буферных растворах слабых оснований (KtOH) и их солей, образованных сильной кислотой: 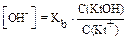 ,
,
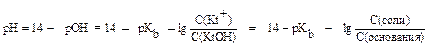
Если буферный раствор состоит из средней соли (Kt2An) и кислой соли (KtHAn) двухосновной кислоты H2An, то рН вычисляется по формуле:
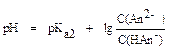 , где pKa2 = - lg Ka2, показатель константы диссоциации H2An по второй ступени.
, где pKa2 = - lg Ka2, показатель константы диссоциации H2An по второй ступени.
Если буферная смесь образована кислыми солями (Kt2HАn и KtH2An) трехосновной кислоты H3An, то для расчета применяют уравнение:
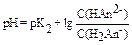
Каждый буферный раствор имеет определённую ёмкость. Число эквивалентов кислоты или щёлочи, необходимое для смещения рН 1 л буферного раствора на одну единицу, называют буферной ёмкостью: 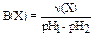 , приV(буф.p-pa) = 1 л, в общем виде:
, приV(буф.p-pa) = 1 л, в общем виде:
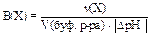
где Х - формула кислоты или щёлочи.
Задачи с решениями
1. К 15 мл 0,03 М раствора НСООН добавили 15 мл 0,03 М раствора
НСООNa. Вычислите рН полученного буферного раствора. Ka=1,77.10-4.
 Дано: V1 = V2 = 15 мл C1 = C2 = 0,03 моль/л Ka = 1,77.10-4 pН = ? Дано: V1 = V2 = 15 мл C1 = C2 = 0,03 моль/л Ka = 1,77.10-4 pН = ? | Решение: I вариант: [H+] = 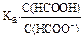 pH = -lg[H+] pH = -lg[H+] |
1) [HCOO-] в буферном растворе = 15.0,03/30 = 0,015 моль/л
2) [HCOOH] в буферном растворе = 15.0,03/30 = 0,015 моль/л
3) [H+] = 1,77.10-4.0,015/0,015 = 1,77.10-4
4) pH = -lg1,77.10-4 = 4 - lg1,77 = 3,75
II вариант:
Решение задачи можно упростить, если учесть, что объём буферного раствора входит и в числитель и в знаменатель данного выражения:
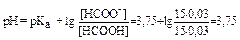
Ответ: 3,75.
2. Как изменится рН буферной смеси, образованной 0,1 М раствором
СН3СООН и 0,1 М раствором СН3СООNa при добавлении: а) 0,001 М раствора HCl; б) 0,001 М раствора NaOH? Ka = 1,8. 10-5.
Решение:
В буферной смеси 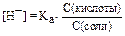 =
= 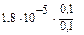 = 1,8.10-5,
= 1,8.10-5,
pH = pKa = -lg1,8  . 10-5 = 4,75.
. 10-5 = 4,75.
При добавлении соляной кислоты:
0,001 0,001 0,001
CH3COONa + HCl = CH3COOH + NaCl
[CH3COOH] = 10-1 +10-3 = 1,01.10-1 (моль/л)
[CH3COONa] = 10-1 -10-3 = 0,99.10-1 (моль/л)
[H+] = 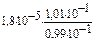 = 1,76.10-5 (моль/л)
= 1,76.10-5 (моль/л)
При добавлении щелочи: CH3COOH + NaOH = CH3COONa + H2O
[H+] =  = 1,76.10-5
= 1,76.10-5
pH = - lg 1,76.10-5 = 5 - 0,24 = 4,76. Ответ: практически не меняется.
3. Рассчитайте буферную ёмкость сыворотки крови по кислоте, если на титрование 50 мл сыворотки для изменения рН от 7,4 до 7,0 было затрачено 10 мл 0,1 N раствора HCl.
| Дано: pН1 = 7,4 pH2 = 7,0 V(p-pa HCl) = 10 мл C(HCl) = 0,1 моль/л B(HCl) = ? V(сыв.) = 50 мл | Решение: 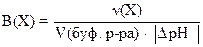 1) n(HCl) = 10.10-3.0,1=1.10-3 (моль) 2) DpH = pH1- pH2 = 7,4 - 7,0 = 0,4 B(HCl) = 1) n(HCl) = 10.10-3.0,1=1.10-3 (моль) 2) DpH = pH1- pH2 = 7,4 - 7,0 = 0,4 B(HCl) = 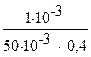 = 0,05 (моль/л). = 0,05 (моль/л). |
Вопросы и задачи для самоподготовки.
1. Какие растворы (смеси) называют буферными?
2. Что называют сопряженной кислотой, сопряженным основанием? Приведите примеры протолитических реакций.
3. На какие типы делятся буферные растворы? Приведите примеры.
4. Каков механизм буферного действия на примере ацетатного буферного раствора?
5. Каков механизм буферного действия на примере аммиачного буферного раствора?
6. Как рассчитать концентрацию ионов Н+ в буферном растворе кислотного типа?
7. Как рассчитать концентрацию ионов Н+ в буферном растворе основного типа?
8. Как объяснить тот факт, что при добавлении небольших количеств сильных кислот, щелочей и разбавлении кислотность раствора практически не меняется?
9. Как рассчитываются значения рН в буферных растворах кислотного и основного типа?
10. Что понимают под а) буферной ёмкостью раствора; б) буферной силой раствора?
11. К 20 мл 1%-ного раствора NH4NO3 (r= 1 г/мл) добавили 1 мл 0,5М раствора аммиака. Раствор разбавили в мерной колбе до 100 мл. Вычислите рН полученного раствора. Kb = 1,8.10-5, pKb = 4,75. Ответ: 8,55.
12. К 25 мл 0,2 М раствора KH2PO4 прибавили 15 мл 0,2 М раствора K2HPO4. Вычислите рН полученного раствора. Ka1 = 7,6.10-3, pKa1 = 2,12; Ka2 = 6,3.10-8, pKa2 = 7,2; Ka3 = 1,3.10-12, pKa3 = 11,87. Ответ: 6,98.
13. К 12 мл 0,03 М раствора НСООН прибавили 15 мл 0,15 М раствора НСООK. Вычислите рН полученого раствора. Ka = 1,8.10-4, pKa = 3,75.
Ответ: 4,55.
14. Вычислите рН раствора, в 500 мл которого содержится 1 г НСООН и 1 г НСООK. Ka = 1,8.10-4, pKa = 3,75. Ответ: 3,49.
15. Смешали поровну 0,5%-ные растворы аммиака и нитрата аммония. Найдите рН полученного раствора, плотность которого 1 г/мл. Kb= 1,8.10-5, pKb = 4,75. Ответ: 9,92.
16. Сколько мл 0,2 М раствора карбоната натрия надо добавить к 10 мл 0,3 М раствора гидрокарбоната натрия, чтобы получить раствор с рН = 10? Ka1 = 4,4.10-7, pKa1= 6,36; Ka2 = 4,7.10-11, pKa2 = 10,33. Ответ: 7 мл.
17. Сколько (г) Na2CO3 надо добавить к 100 мл 0,3 М раствора NaHCO3, чтобы получить раствор с рН 10? Ka1 = 4,4.10-7, pKa1= 6,36; Ka2 = 4,7.10-11, pKa2 = 10,33. Ответ: 1,49 г.
18. Сколько (в моль эквивалентов) щелочи нужно добавить к 1 мл буферного раствора, чтобы изменить рН от 7,36 до 7,50, если буферная емкость его равна 0,034 моль/л?
Гетерогенное равновесие.
В насыщенном растворе малорастворимого электролита KtAn устанавли-вается химическое равновесие: KtAn(тв) « Kt+(р-р) + An-(р-р), которое количес-твенно характеризуется при постоянной температуре константой гетерогенного равновесия, называемой произведением растворимости (ПР): ПР(KtAn) = [Kt+].[An-]. Произведение [Kt+].[An-] называют ионным произведением и
обозначают ИП(KtAn).
В насыщенном растворе ПР(KtAn) = ИП(KtAn), в ненасыщенном—
ПР(KtAn) > ИП(KtAn), в пересыщенном: ПР(KtAn) < ИП(KtAn).
Концентрация электролита Х в насыщенном растворе называется растворимостью (s(X) в моль/л): s(X) = L(X)/M(X), где L(X) - растворимость электролита в г/л. Связь между растворимостью и произведением растворимости электролита в зависимости от числа ионов в молекуле электролита удобно представить в виде таблицы:
| Формула электролита Х (пример) | Число ионов в молекуле | ПР (Х) | s(X) |
| KtAn (AgCl) | s2 | 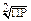 | |
| KtAn2 (PbI2) | 4s3 | 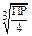 | |
| KtAn3 (Fe(OH)3) | 27s4 | 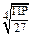 | |
| Kt3An2 (Ca3(PO4)2) | 108s5 | 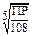 | |
| KtnAnm | n + m | nnmmsn+m | 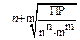 |
Задачи с решениями.
1. В 1 л воды растворяется 2,88.10-6 г AgI. Вычислите ПР(AgI).
| Дано: V(H2O) = 1 л m(AgI) = 2,88.10-6г. ПР(AgI) = ? | Решение: AgI (тв)  Ag+(р-р) + I-(р-р) ПР(AgI) = [Ag+].[I-] [Ag+] = [I-] = C(AgI) = Ag+(р-р) + I-(р-р) ПР(AgI) = [Ag+].[I-] [Ag+] = [I-] = C(AgI) = 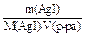 |
1) V(p-pa) = V(H2O) = 1 л, M(AgI) = 235 г/моль
2) C(AgI) = = 1,225.10-8 (моль/л)
3) ПР(AgI) = (1,225.10-8)2 = 1,5.10-16. Ответ: 1,5.10-16
2. Образуется ли осадок Fe(OH)3 в растворе, содержащем 1,5.10-3
моль/л FeCl3 и 5.10-5 моль/л NaOH? ПР(Fe(OH)3) = 3,8.10-38.
Дано: C(FeCl3)= 1,5.10-3моль/л C(NaOH) = 5.10-5 моль/л ПP(Fe(OH)3) = 3,8.10-38 ИП   ПР - ? ПР - ? | Решение: Fe(OH)3(тв) 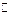 Fe3+(р-р) + 3 OH-(р-р) ПP(Fe(OH)3) = [Fe3+].[OH-]3 1) [Fe3+] = C(FeCl3) = 1,5.10-3 моль/л 2) [OH-] = C(NaOH) = 5.10-5 моль/л 3) ИП(Fe(OH)3) = [Fe3+].[OH-]3 = 1,5.10-3.(5.10-5)3 = 1,9.10-6 Fe3+(р-р) + 3 OH-(р-р) ПP(Fe(OH)3) = [Fe3+].[OH-]3 1) [Fe3+] = C(FeCl3) = 1,5.10-3 моль/л 2) [OH-] = C(NaOH) = 5.10-5 моль/л 3) ИП(Fe(OH)3) = [Fe3+].[OH-]3 = 1,5.10-3.(5.10-5)3 = 1,9.10-6 |
4) ИП >> ПР, следовательно, осадок образуется.
Ответ: осадок образуется.
3. При какой концентрации ионов Al3+ будет образовываться осадок
Al(OH)3 из раствора с рН = 6? ПР(Al(OH)3) = 5,1.10-33.
| Дано: pH = 6 ПР(Al(OH)3) = 5,1.10-33 [Al3+] = ? | Решение: Al(OH)3(тв) «Al3+(р-р) + 3 OH-(р-р) [OH-] =  ; ; 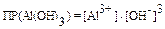 |
1) [H+] = 10-pH = 10-6 (моль/л);
2) [OH-] = 10-14/10-6 = 10-8 (моль/л);
3) [Al3+] = 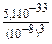 = 5,1.10-9 (моль/л). Ответ: 5,1.10-9 моль/л.
= 5,1.10-9 (моль/л). Ответ: 5,1.10-9 моль/л.
Вопросы и задачи для самоподготовки
1. Какое равновесие называют гетерогенным?
2. Выведите выражение произведения растворимости (ПР) малорастворимой соли на примере AgCl. При каких условиях осадки выпадают, растворяются
и находятся в равновесии с насыщенным раствором? Сравните ионное
произведение (ИП) с произведением растворимости (ПР).
3. Как влияет на растворимость вещества введение в его насыщенный раствор одноимённого иона? Ответ мотивируйте.
4. Выведите формулы для расчёта ПР по известной растворимости (s) для случаев: а) BaSO4; б) Mn(OH)2; в) Cr(OH)3; г) Mg3(PO4)2; д) KtnAnm.
5. Сколько (г) CaSO4 растворяется в 1 л воды, если ПР(CaSO4) = 6,1.10-5? Ответ: 1,062 г.
6. В 1 л воды растворяется 0,001215 г Са3(РО4)2. Вычислите ПР(Са3(РО4)2). Ответ: 1.10-25.
7. Какая из солей более растворима в воде и во сколько раз: хлорид или хромат серебра, если ПР(AgCl)= 1,1.10-10, ПР(Ag2CrO4) =1,6.10-12? V(p-pa) = V(H2O).
Ответ: хромат серебра, в 7,3 раза по молям, в 16 раз по массе.
8. Сколько (г) AgBr содержится в 10 л насыщенного раствора, если ПР(AgBr) = 4.10-13. Ответ: 1,19.10-3г.
9. Сколько (г) BaSO4 содержится в 100 л насыщенного раствора, если ПР(BaSO4) = 1.10-10 . Ответ: 0,23 г.
10. Сколько (г) NaOH надо прибавить к 20 мл 5.10-5М раствора МgCl2, чтобы образовался осадок Mg(OH)2? ПР(Mg(OH)2) = 1,2.10-11. Изменением объема при добавлении щелочи и выпадении осадка пренебречь. Ответ: 3,9.10-4 г.
11. Сколько мл 2М раствора HCl необходимо прибавить к 20 мл 0,03М раствора Pb(NO3)2, чтобы образовался осадок PbCl2? ПР(PbCl2) = 2,4.10-4.
Ответ: 0,94 мл.
12. Образуется ли осадок CaSO4, если к 0,1М раствору CaCl2 добавить равный объём 0,1 М раствора H2SO4? ПР(CaSO4) = 6,1.10-5.
Ответ: ИП = 2,5.10-3; образуется.
13. При каком значении рН начнется образование осадка Mg(OH)2 из 2.10-2М раствора MgSO4? ПР(Mg(OH)2) = 1,2.10-11. Ответ: 9,38.
