Опыт 5. Различия в растворимости сульфатов щелочно-земельных металлов
А. К растворам солей магния, кальция, стронция и бария прилить раствор сульфата натрия. Отметить изменения в растворах. Результат записать в таблицу:
Таблица 1.
| № | Соль | Образование осадка | Произведение растворимости сульфата металла |
Сульфат какого металла наименее растворим? Как меняется растворимость сульфатов от магния к барию?
К осадку сульфата бария добавить несколько капель соляной кислоты. Пояснить отсутствие взаимодействия сульфата бария с соляной кислотой.
Б. К растворам солей стронция и бария прилить по нескольку капель насыщенного раствора сульфата кальция (гипсовой воды). Отметить образование осадков сульфата бария (сразу) и сульфата стронция (медленно). Почему образуются осадки сульфатов бария и стронция? Ответ дать на основании значений произведений растворимости сульфатов.
Опыт 6. Образование и растворение хромата бария. К 3–4 каплям раствора хлорида бария прилить 2–3 капли хромата калия. Полученный осадок обработать соляной кислотой. Почему осадок хромата бария растворяется в соляной кислоте? Попробовать растворить осадок хромата бария в уксусной кислоте.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Уравнения реакций в молекулярной и ионной форме, результаты проведения реакций, ответы на вопросы.
Лабораторная работа № 3. Свойства бора и алюминия
Цель работы: изучение химических свойств бора и алюминия.
Бор
Общие сведения
Элементы главной подгруппы третьей группы – бор, алюминий, галлий, индий, таллий – характеризуются наличием трех электронов в наружном слое атома. Поэтому тенденция к дальнейшему присоединению электронов для них не характерна. В соединениях они проявляют степень окисления +3. С возрастанием атомной массы проявляются и более низкие степени окисления: для таллия наиболее устойчивой является степень окисления +1.
С увеличением порядкового номера металлические свойства элементов III А группы усиливаются. Кислородные соединения бора (оксид, гидроксид) имеют кислотный характер. Оксид и гидроксид алюминия, галлия, индия проявляют амфотерный характер. Оксид и гидроксид таллия (III) имеют основной характер, а гидроксид таллия (I) является сильным основанием.
В практическом отношении наиболее важными из элементов III А группы являются бор и алюминий.
Бор является выраженным неметаллом. Наиболее характерны для бора кислородные соединения: собственно борная кислота и ее соединения – бораты и тетрабораты.
Борная кислота – слабая одноосновная кислота. Она не диссоциирует обычным образом. В водном растворе борная кислота реагирует как кислота Льюиса с присоединением гидроксил-иона:
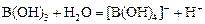 , pK = 9,00.
, pK = 9,00.
Борная кислота является настолько слабой кислотой, что ее водные растворы нельзя точно оттитровать щелочью. Соли борной кислоты и сильного основания, например, бура Na2B4O7, наоборот, часто применяются в аналитической химии для определения концентрации сильных кислот. При взаимодействии буры с кислотами реализуется реакция:
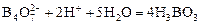 ,
,
при протекании которой одновременно происходит гидролитическое расщепление полимерного аниона 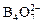 .
.
Выполнение работы
Опыт 1. Окрашивание пламени солями бора. В пламя спиртовки внести каплю борной кислоты. Пламя окрасится в зеленый цвет.
Опыт 2. Получение ортоборной (борной) кислоты. В пробирку с 5–6 каплями горячего насыщенного раствора буры Na2B4O7·10Н2О внести 2–3 капли концентрированной H2SO4. Отметить быстрое выпадение кристаллов борной кислоты.
Написать уравнение реакции получения борной кислоты из тетрабората натрия и серной кислоты. Солью какой кислоты является тетраборат натрия? Написать формулу этой кислоты.
Опыт 3. Кислотные свойства борной кислоты. В трех пробирках с 5–8 каплями дистиллированной воды растворить при нагревании по нескольку кристалликов борной кислоты. В одну из пробирок прибавить 3–5 капель нейтрального раствора лакмуса. Отметить изменение его окраски. В другую пробирку внести кусочек магниевой ленты. Отметить выделение газа. В третью пробирку опустить полоску универсальной индикаторной бумажки и сравнить ее окраску с окраской эталонной шкалы. Сделать вывод о рН борной кислоты в полученном растворе.
Написать уравнения реакций: а) взаимодействия борной кислоты с магнием; б) диссоциации борной кислоты; в) значения рН в полученном растворе борной кислоты и константы диссоциации по первой ступени. Сильным или слабым электролитом является борная кислота?
Опыт 4. Повышение силы кислоты при комплексообразовании. В 2 пробирки налить насыщенный раствор борной кислоты. Прибавить смешанный индикатор (метиловый красный и метиловый синий) и отметить цвет раствора. В одну пробирку добавить глицерин (СН2ОН−(СНОН)4−СН2ОН), в другую – этиленгликоль. Отметить изменение окраски индикатора.
Опыт 5. Кислотно-основные свойства боратов. В пробирку отобрать 3–4 капли раствора тетрабората натрия и прибавить 2 капли фенолфталеина.
Опыт 6. Осаждение и гидролиз боратов. В три пробирки внести по 3–4 капли раствора буры (Na2B4O7) и добавить по нескольку капель растворов: в первую – нитрата серебра, во вторую – сульфата меди, в третью – сульфата алюминия. Отметить цвета выпавших осадков.
Пробирку с осадком нитрата серебра нагреть – осадок потемнеет, так как метаборат серебра гидролизуется с образованием борной кислоты и оксида серебра.
Написать уравнения протекающих реакций, учитывая, что во всех реакциях участвует вода и получается борная кислота, выпадающие осадки представляют собой в первой пробирке метаборат серебра, во второй – основную соль меди СuОНВО2 – гидроксометаборат меди, в третьей пробирке – гидроксид алюминия. Почему в двух последних случаях не получились средние соли – борат меди и борат алюминия? Ответ объяснить, написав уравнения соответствующих реакций.
Алюминий
Общие сведения
Алюминий – достаточно активный металл, его стандартный электродный потенциал равен −1,663 В. Однако образующаяся на поверхности алюминия защитная оксидная пленка препятствует взаимодействию алюминия с водой. Однако, если оксидную пленку убрать, энергично взаимодействует с водой с выделением водорода.
Алюминий, как любой активный металл, легко реагирует с разбавленными кислотами (серная, соляная). Сильно разбавленная и холодная концентрированная азотная кислота на алюминий не действует. Алюминий, а также его оксид и гидроксид хорошо растворяется в крепких растворах щелочей с образованием гексагидроксоалюминатов – здесь проявляется амфотерный характер алюминия.
Алюминий заметно растворяется в растворах солей, которые имеют вследствие гидролиза кислую или щелочную среду.
Выполнение работы
Опыт 1. Восстановительные свойства алюминия – образование амальгамы ртути. Кусочек металлического алюминия зачистить от оксидной пленки и поместить в раствор нитрата ртути (II). Наблюдать появление пленки амальгамы ртути на поверхности алюминия.
Опыт 2. Влияние хлор-иона на коррозию алюминия. Ион хлора является сильным активатором коррозии. Его присутствие в растворе способствует разрушению защитной пленки оксида алюминия, вследствие чего коррозия усиливается.
А. В две пробирки поместить по кусочку алюминия и добавить в одну из них 5 – 8 капель раствора сульфата меди, а в другую – столько же раствора хлорида меди. Отметить различный результат в обоих случаях: в то время как в первой пробирке алюминий остается почти без изменения, во второй он быстро покрывается налетом меди. Написать соответствующее уравнение реакции.
Б. Зачистить алюминиевую пластинку. Положить в воду. Посмотреть на реакцию. Если видимых изменений не происходить – добавить насыщенный раствор хлористого калия.
